毛细管电泳-间接紫外检测法测定蜂蜜中的氨基酸
2013-10-22周贤婧师彦平
周贤婧, 师彦平
(1.中国科学院兰州化学物理研究所中国科学院西北特色植物资源化学重点实验室/甘肃省天然药物重点实验室,甘肃兰州 730000;2.中国科学院大学,北京 100039)
蜂蜜作为一种潜在的生物抗氧化[1,2]、抗菌[3]的功能性食品,其抗氧化能力不仅受黄酮多酚类化合物的影响,同时也受蜂蜜中氨基酸成分的影响,而且相关性强于多酚类化合物[4]。蜂蜜中氨基酸的含量和种类依蜂蜜的品种和花粉不同而异,尽管依据氨基酸含量不能完全鉴别蜜源,但是不同种类蜂蜜的氨基酸含量的差异在蜜源鉴别方面也能起到一定的作用[5,6]。
自动化分析氨基酸是采用阳离子交换色谱分离与柱后茚三酮衍生结合的方法实现的,最初用于分析蛋白质中的氨基酸。随后,人们不断地发展新的氨基酸分析方法,如:氨基酸自动分析仪[7]、柱前衍生反相高效液相色谱法[8]、高效阴离子交换色谱-积分脉冲安培检测法[9]、高效液相色谱与质谱联用法[10]、高效液相色谱-蒸发光散射检测法[11]等技术相继应用于氨基酸分析。这些方法发展成熟并广泛用于生化、医学、生物工程、农业和食品等领域。但是大多会存在着试剂消耗多、操作成本高、分析方法复杂、分析时间长等问题。由于大部分氨基酸没有紫外吸收,因此不能采用简单、方便的直接紫外检测,需进行衍生化处理。目前使用的柱前衍生试剂主要有邻苯二甲醛 (OPA)[12,13]、异硫氰酸苯酯(PITC)[14]、氯甲酸芴甲酯(FMOC-Cl)[15]、丹酰氯(Dansyl-Cl)[16]等。但衍生化反应存在产物不稳定、剩余试剂对检测造成干扰、衍生化条件苛刻等局限性,而间接检测可克服这些缺点[17-19]。
本文应用高效毛细管电泳(HPCE)-间接紫外检测法于11 min内同时分离检测了蜂蜜中9种游离氨基酸。
1 实验部分
1.1 仪器与试剂
安捷伦公司7100毛细管电泳仪(配二极管阵列检测器),安捷伦化学工作站用于获取和处理色谱数据。分离用未涂层熔融石英毛细管(内径75 μm,总长48.5 cm,有效长度40 cm,河北省永年光导纤维厂);PB-10型酸度计(北京赛多利斯仪器有限责任公司);KQ-250型超声波清洗器(昆山市超声波仪器有限公司);超纯水由实验室纯水制备仪(上海涞科仪器有限公司)制备;分析级甲醇、烟酸、氢氧化钠、磷酸二氢钠和盐酸(天津化学试剂厂);十六烷基三甲基溴化铵(CTAB)(北京化学试剂公司);732强酸型阳离子交换树脂(国药集团化学试剂有限公司);蜂蜜样品购于超市。
氨基酸标准品:谷氨酸(Glu)、天冬氨酸(Asp)、赖氨酸(Lys)、甲硫氨酸(Met)、脯氨酸(Pro)、苏氨酸(Thr)、异亮氨酸(Ile)、色氨酸(Trp)、丝氨酸(Ser)(纯度均为99.5%,上海生工生物工程公司)。
1.2 标准溶液配制
准确称量氨基酸对照品,溶于超纯水,配制氨基酸混合标准品储备液,其中 Trp质量浓度为25 mg/L,其余8种氨基酸质量浓度为100 mg/L。该溶液用于条件优化实验。
1.3 样品处理
1.3.1 树脂处理
将100 g阳离子树脂置于洁净的容器中,用清水漂洗,直到排水清澈为止。用水浸泡树脂12~24 h,使树脂充分膨胀。用树脂体积2倍量的5%HCl溶液浸泡树脂2~4 h,并不时搅拌。然后用纯水洗涤树脂,直至溶液的pH接近4,再用5%NaOH溶液处理,处理后用水洗至微碱性,再一次用5%HCl溶液处理,使树脂变为氢型,最后用纯水洗至pH=4、无氯离子即可。
1.3.2 蜂蜜样品预处理
将蜂蜜在烘箱中恒温40℃下干燥至恒重,置于广口瓶中备用。准确称取膏体20.00 g,将其完全溶于30 mL超纯水中,倒入阳离子交换柱中,用95 mL 4 mol/L氨水洗脱,洗脱液于60℃下浓缩至干,用超纯水溶解定容至25 mL。进样前用0.45 μm微孔滤膜过滤。
1.4 电泳条件
毛细管柱活化后,在每天使用前依次用0.5 mol/L盐酸冲洗5 min、0.5 mol/L NaOH冲洗5 min、超纯水冲洗1 min、电泳缓冲液冲洗5 min;每次分离前用电泳缓冲液冲洗2 min。运行缓冲液为含有0.5 mmol/L十六烷基三甲基溴化铵、20 mmol/L烟酸、10%甲醇的10 mmol/L磷酸二氢钠缓冲溶液(pH 10.2),运行缓冲液需要当天配制。检测波长为220 nm;分离温度为20℃;进样量:在5 kPa压力下进样5 s。
2 结果与讨论
2.1 样品前处理
本实验采用阳离子交换树脂,能够去除蜂蜜中的糖类物质,减少样品基质对电泳的影响,并对氨基酸分析具有较好的纯化作用。阳离子交换树脂对无机阳离子有较好的吸附分离性能,其分离原理是α-氨基与树脂上的磺酸基存在静电作用。不同氨基酸的α-氨基的碱性存在微小差异,故可通过柱色谱分离。此外,文献[20,21]表明,在配体交换色谱分离氨基酸时,氨基酸的侧基与树脂的骨架可能存在疏水作用,对柱色谱的分离也有一定的贡献。
2.2 分离条件的优化
2.2.1 缓冲液的选择与优化
毛细管电泳-间接紫外检测是基于样品注入后背景吸收添加剂吸光度的减小来定量的。背景吸收一般较大,因此保持基线稳定是一个很大的挑战。本实验考察了磷酸二氢钠浓度对分离效果的影响(见图1),发现10 mmol/L磷酸二氢钠缓冲液具有足够的缓冲容量、良好的分离效果和较稳定的基线。

图1 NaH2PO4浓度对9种氨基酸迁移时间的影响Fig.1 Effect of NaH2PO4concentration on the migration time of the nine amino acids
文献报道对氨基苯甲酸和对羟基苯甲酸均可作为缓冲液中的背景吸收添加剂[18],但二者在高电压下均会发生电极反应,缓冲液变色。烟酸与对氨基苯甲酸和对羟基苯甲酸有类似的结构,而含烟酸的缓冲液具有与文献[18]报道的含对氨基苯甲酸缓冲液近似的分离效果,且不发生电极反应,因此本文选择烟酸作为背景吸收添加剂。烟酸的浓度对检测灵敏度有一定的影响,我们考察了烟酸浓度为10~30 mmol/L时分析物的峰高变化,最终确定在运行缓冲液中添加20 mmol/L烟酸。
2.2.2 缓冲液pH的优化
通常,缓冲液的pH是控制电渗流和决定被分析物离子状态的一个重要参数。不同解离常数(pKa)的被分析物在一定的pH下的解离度不同,从而导致电泳迁移速度的不同,因此被分析物不同解离常数是实现分离的基础。本实验考察了pH值在9.0~10.7范围内变化时被分析物的迁移行为和峰形的变化。分析物迁移时间与pH的关系图见图2。当pH为10.2时,所有分析物达到基线完全分离,故选择缓冲液的pH为10.2。本实验所分析的9种氨基酸中pKa最小的是苏氨酸(pKa2=9.1),当pH<pKa1时,其带正电;当pH>pKa2时,其带负电;故选择缓冲液的pH>9。由于赖氨酸在pH=10.2的条件下依然带正电,所以其在电渗流之后出峰,最先出峰的是谷氨酸和天冬氨酸。另外,不仅氨基酸的pKa影响其出峰时间,其相对分子质量的大小也对出峰顺序有影响。
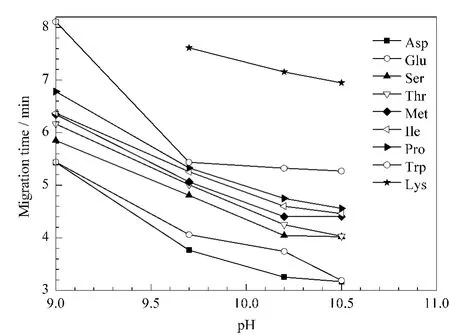
图2 缓冲液pH对9种氨基酸迁移时间的影响Fig.2 Effect of buffer pH on the migration time of the nine amino acids
2.2.3 进样方式
以100 mg/L质量浓度的Asp和Trp为分析对象,考察进样方式对分离的影响。电动进样:在-10 kV下进样10~30 s;试验结果表明,进样20 s的进样量适中,峰形较佳。压力进样:在5 kPa下进样3~10 s。对比两种进样方法在其他优化条件下的进样量,发现采用压力进样方式的进样量适中,且没有进样组分歧视,故本文选择在5 kPa下进样5 s。
2.2.4 十六烷基三甲基溴化铵浓度的优化
在碱性条件下,氨基酸通常以阴离子的形式存在,在电泳过程中向阳极移动,与电渗流方向相反。加入阳离子表面活性剂CTAB后可改变毛细管壁的电荷密度,使电势改变方向,从而改变电渗流的方向。此时,待测阴离子的电泳和电渗流方向相同,故可实现快速分离。同时CTAB的加入也抑制了氨基酸在管壁的吸附,降低了噪声和基线的波动,提高了检测灵敏度。在上述缓冲液条件下L-Met、L-Pro和L-Ile仍未能得到基线分离。考察了CTAB的浓度为0.05~1.5 mmol/L范围变化对分离的影响,当其浓度为0.05 mmol/L时,离子迁移时间长,峰宽大;增大CTAB的浓度,峰宽减小,分离效率增大;CTAB浓度大于1 mmol/L时,分离速度加快,但Ile与Pro不能达到基线分离;当CTAB浓度为0.5 mmol/L时,分离效率最好(见图 3),故本文选择 0.5 mmol/L的CTAB为电渗流改性剂。
图3 CTAB浓度对目标物迁移时间的影响Fig.3 Effect of CTAB concentration on the migration time of the analytes
为了改善迁移时间相近的几组氨基酸(如Asp和Glu、Ile和Pro)的分离,本文考察了有机溶剂乙腈和甲醇对9种氨基酸分离度的影响,发现甲醇能显著改善峰形,改善Asp和Glu的分离度,实现基线分离。但甲醇也有抑制电渗的作用,延缓出峰时间。考察在运行缓冲液中添加5%~20%(v/v)的甲醇后分析物的保留时间和峰形,发现添加10%的甲醇时分离效果较佳。
2.3 方法学考察
2.3.1 线性关系、精密度与重现性
将9种氨基酸混合标准品储备液用超纯水配成质量浓度为50、25、15、10 mg/L 的溶液,其中 Trp的质量浓度为12.5、6.25、3.75、2.5 mg/L。不同浓度溶液依次进样,在最佳条件下进行电泳分析测定。以各氨基酸的峰面积(Y)对其质量浓度(X,mg/L)做线性回归,得到的回归方程及相关系数见表1。以响应值3倍于噪声所对应的浓度为检出限,得到9种氨基酸的检出限在0.3~1.5 mg/L范围内。该方法灵敏度高,可满足样品测定要求。在各自的线性范围内的线性相关系数范围为0.9828~0.9999,表明线性关系良好。
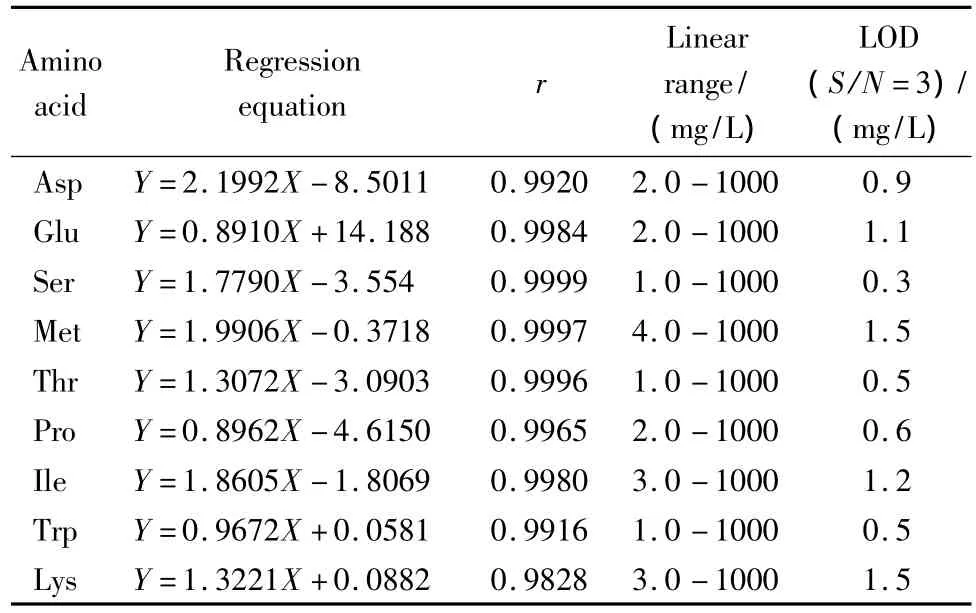
表1 9种氨基酸的线性方程、相关系数、线性范围及检出限Table 1 Regression equations,correlation coefficients(r),linear ranges and limits of detection(LOD)of the nine amino acids
在5份相同蜂蜜样品中添加氨基酸混合标准品溶液储备液,按照1.3.2节的样品处理方法,配制相同浓度供试品溶液5份,在最佳条件下,连续5日分析测定,由峰面积及迁移时间算得相对标准偏差(RSD)为日间精密度;一日内连续分析同一浓度的溶液5次,由峰面积及迁移时间算得RSD为日内精密度。由表2可见,峰面积精密度范围在2.16%~5.83%,迁移时间精密度在0.64%~2.33%范围内,表明该方法精密度良好。

表2 被测组分的日内及日间测定精密度Table 2 Intra-day and inter-day precision of the determination of the amino acids
以含20 mmol/L烟酸、0.5 mmol/L CTAB、10%甲醇的10 mmol/L NaH2PO4缓冲溶液(pH=10.2)为运行缓冲液,在-15 kV为分离电压、检测波长为220 nm条件下,混合标准溶液的电泳谱图见图4,其中Trp为25 mg/L,其余标准品的质量浓度均为100 mg/L。

图4 9种氨基酸混合标准溶液的电泳谱图Fig.4 Electropherogram of a mixture of the nine amino acid standards
2.3.2 加标回收率
从广西荔枝蜂蜜样品中取24份样品,每份20 g,平均分为3组,每组样品中分别加入原始量的80%、100%和120%的氨基酸混合标准溶液;按照建立的方法进行样品预处理与测定,考察了荔枝蜂蜜样品内含有的8种氨基酸的加标回收率。由表3给出的结果可见,在上述3个加标水平下,8种氨基酸的回收率在60.00%~118.2%之间,RSD在2.16%~9.87%之间。广西荔枝蜂蜜的电泳谱图见图5。

图5 广西荔枝蜂蜜的电泳谱图Fig.5 Electropherogram of litchi honey from Guangxi For peak identifications,see Fig.4.

表3 广西荔枝蜂蜜中8种氨基酸的加标回收率及精密度(n=9)Table 3 Recoveries and precisions of the eight amino acids spiked in litchi honey from Guangxi(n=9)
2.4 实际样品的测定
选取了不同蜜源植物、不同产地的5种蜂蜜,分别是兰州枣花蜜、景泰枣花蜜、陕西枣花蜜、广西荔枝蜜和兰州槐花蜜。由表4的结果可见,不同产地的相同蜜源植物的蜂蜜所含氨基酸的种类和含量有明显差异。蜂蜜中游离氨基酸主要以脯氨酸为主,其中在荔枝蜜中含量最高,在洋槐蜜中含量则较低。在本实验检测的蜂蜜中均未检出甲硫氨酸。

表4 蜂蜜样品中氨基酸的含量Table 4 Contents of amino acids in honeys mg/kg
3 结论
本文测定的5种蜂蜜均属于由天然原料加工而成的蜜蜂的采集物,但是由于采集原料不同,因此其氨基酸组成和含量有显著差异。另外,由于蜜源植物的不同,同产地蜂产品的氨基酸组成也有显著的差异,本文测定的不同蜂蜜产品之间的氨基酸总量和个体氨基酸的含量均有不同。蜂产品作为世界性的食疗保健品,产品种类繁多,同时我国是世界植物资源最丰富的国家,蜜源植物更是有几万种。因此开展对不同种类蜂产品和蜜源植物不同的蜂产品的营养成分研究对于蜂产品的开发和利用有着重要的意义。
[1]Blasa M,Candiracci M,Accorsi A,et al.Food Chem,2007,104:1635
[2]Lachman J,Orsák M,Hejtmánková A,et al.LWT-Food Sci Technol,2010,43:52
[3]Boorn K L,Khor Y Y,Sweetman E,et al.J Applied Micro,2010,108:1534
[4]Dong R,Zheng Y N.Food Science(董蕊,郑毅男.食品科学),2011,32(21):66
[5]Cotte J F,Casabianca H,Giroud B,et al.Anal Bioanal Chem,2004,378(5):1342
[6]Hamide Z,Senyuva H Z,Gilbert J,et al.J Agric Food Chem,2009,57(9):3911
[7]Katarzyna J,Magda A,Piotr N.Pol J Food Nutr Sci,2012,62(2):85
[8]Sun Y C,Xu X Z,Xu Y L,et al.Chinese Journal of Chromatography(孙言春,许宪祝,徐衍岭,等.色谱),2013,31(3):275
[9]Feng L,Yan A P,Wan Y Q,et al.Chinese Journal of Chromatography(冯蕾,鄢爱平,万益群,等.色谱),2010,28(4):408
[10]Tang X X,Gu Y,Wang C,et al.Chinese Journal of Chromatography(汤新星,顾源,王畅,等.色谱),2012,30(7):696
[11]Wang Y H,Shen K Y,Li P,et al.Chinese Journal of Chromatography(王玉红,申克宇,李鹏,等.色谱),2011,29(9):908
[12]Pereira V,Pontes M,Camara J S,et al.J Chromatogr A,2008,1189(1/2):435
[13]Huang Y T,Chen P C,Chen R L C,et al.Food Chem,2010,118(3):876
[14]Hu J H,Qiu L Y,Wang C R,et al.Food Science and Technology(胡建鸿,邱利焱,王成润,等.食品科技),2008(10):211
[15]Rebane R,Herodes K.J Chromatogr A,2012,1245(6):134
[16]Huang H,Gong X H,Liu H H,et al.Food Science(黄会,宫向红,刘慧慧,等.食品科学),2012,33(8):207
[17]Fu C G,Yang D Z,Wang L X.Food Science(傅崇岗,杨冬芝,王立新.食品科学),2005,26(12):196
[18]Fu G N,He Y Z,Wang X K,et al.Chinese Journal of Chromatography(付国妮,何友昭,王晓葵,等.色谱),2007,25(2):193
[19]Chen B,Li X G,He P,et al.Chinese Journal of Chromatography(陈冰,李小戈,何萍,等.色谱),2004,22(1):74
[20]Yan H S,Cheng X H,He B L.Chemical Journal of Chinese U-niversities(阎虎生,程晓辉,何炳林.高等学校化学学报),1992,13(2):270
[21]Liu J X,Liu G D,Yan H S,et al.Chemical Journal of Chinese Universities(刘菊湘,刘国栋,阎虎生,等.高等学校化学学报),2001,22(12):2100
