加速溶剂萃取-超高效液相色谱-串联质谱快速测定棉花中残留的8种脱叶剂
2013-10-22董锁拽潘璐璐赵珊红王力君郭方龙
吴 刚, 董锁拽, 潘璐璐, 赵珊红, 王力君, 郭方龙, 李 丹
(1.浙江省检验检疫科学技术研究院,浙江杭州 310015;2.浙江出入境检验检疫局丝类检测中心,
浙江杭州310012;3.浙江立德产品技术有限公司,浙江杭州 310015)
棉花是目前世界用量最大的单纤维品种,其用量达到纤维消耗总量的40%以上,占天然纤维的3/4,是纺织工业最重要的纤维产品[1]。近年来,随着绿色环保和穿着天然化要求的提高,棉花在纺织制品尤其是在服装和家纺产品的比例又有所上升。然而,棉花是农药消耗量最大的农副产品之一,世界上大约60%的农化制剂被用于棉花生产,超过了其他任何农作物[2]。在棉花收获前还使用了大量的脱叶剂,促使棉株的叶片尽快脱落,以提高机械采收的作业效率并降低籽棉的含杂率。日常棉花上使用的脱叶剂从作用机制上可分为两类:第一类为触杀型化合物,如脱叶膦、噻节因、唑草酯、敌草隆、草甘膦、百草枯、氯酸镁等;第二类是促进内源乙烯生成的化合物,能够诱导棉铃开裂和叶柄离层形成,如乙烯利和噻苯隆等。但是,这些农药都有一定的毒性,对人类和生态系统有着直接和间接的潜在危害[3-5]。国际生态纺织品研究和检验协会颁布的Oeko-Tex Standard 100标准中,规定禁用和限用的与棉花生产直接有关的农药就达54种,包含杀虫剂、除草剂和脱叶剂等[6]。近年来,我国检验检疫监管人员曾随机抽取了6个国家的棉花样品共21个,经检测发现13个样品含有农药残留,占总样品数的61.9%,表明棉花中的农药残留问题不容忽视[7]。当前,进口棉花检测一般都是重量鉴定和极其普通的长度测试等物理指标,基本不涉及生态指标。然而,在国际技术壁垒设置越来越苛刻的情况下,对棉花生态方面的限量规定是必然趋势。目前,鲜见关于棉花中脱叶剂农药多残留检测方法的报道[8-11],因此,开展棉花中脱叶剂多残留检测方法研究有着重大的现实意义。
1 实验部分
1.1 仪器、试剂与材料
超高效液相色谱-串联质谱联用仪(Acquity UPLC Quattro Premier XE型,配电喷雾离子源(ESI),美国Waters公司),ASE350加速溶剂萃取仪(美国Dionex公司,带22 mL萃取池),0.22 μm有机相过滤头等。
甲醇、乙腈、乙醇、丙酮、甲酸(96%)(均为HPLC级);脱落酸(abscisic acid,ABA)(纯度99%)、甲基苯噻隆(methabenzthiazuron)(纯度98.6%)、噻苯隆(thidiazuron)(纯度99.5%)、嘧草硫醚(pyrithiobac-sodium)(纯度98.5%)、氟酮唑草酯(carfentrazone-ethyl)(纯度98%)、敌草隆(diuron)(纯度97.5%)、百草枯(paraquat)(纯度97.5%)和脱叶膦(butiphos)(纯度99%)等8种脱叶剂农药标准物质购自德国Dr.Ehrenstorfer公司。
1.2 实验步骤
1.2.1 提取
取进口美国皮棉样品混匀,称取1.0 g试样,精确至0.01 g,装入加速溶剂萃取池,置于加速溶剂萃取仪的样品管卡口处,按设定的提取程序运行:温度100 ℃,压强10.34 MPa(1500 psi),预热2 min,加热5 min,用甲醇静态萃取5 min,60%萃取池体积甲醇快速冲洗样品,氮气吹扫60 s,收集全部提取液,静态萃取运行2个周期。提取完成后,将提取液收集于平底烧瓶中,于40℃水浴中减压浓缩至近干,准确加入5 mL乙腈-水溶液(1∶9,v/v)涡旋溶解残留物,用0.22 μm有机相过滤头过滤至样品瓶中,用UPLC-MS/MS进行测定。
1.2.2 色谱条件
色谱柱为Acquity UPLC®HSS T3(50 mm×2.1 mm,1.8 μm,美国 Waters公司);柱温:40 ℃;样品室温度:10℃;进样体积:5 μL。流动相A:乙腈;流动相B:0.05%甲酸水溶液。梯度洗脱程序:0~2 min,10%A~90%A;2~3.5 min,90%A;3.5~4 min,90%A ~10%A;流速:0.3 mL/min。
1.2.3 质谱条件
离子源:电喷雾离子源;检测方式:正离子扫描多反应监测(MRM)模式;毛细管电压:3.2 kV;萃取电压:3.0 kV;离子源温度:120℃;脱溶剂气温度:380℃;脱溶剂气(N2气)流速:600 L/h;锥孔反吹气(N2气)流速:50 L/h;碰撞气(Ar气)流速:0.13 mL/min;其他质谱条件参见表1。
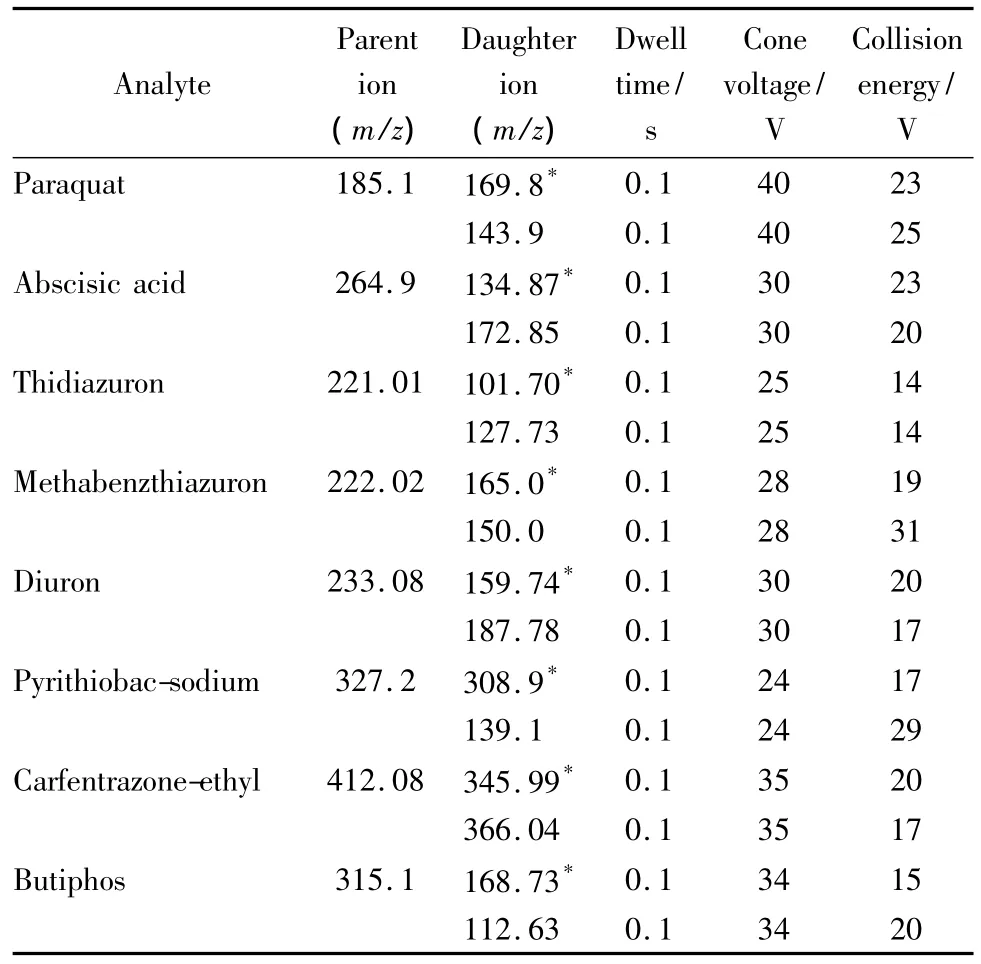
表1 8种脱叶剂的质谱检测条件Table 1 MS parameters for the determination of the eight defoliants
2 结果与讨论
2.1 提取溶剂的选择
本文研究的8种农药在低浓度时能溶于甲醇、乙醇、丙酮等少数有机溶剂[4]。比较了甲醇、乙醇与丙酮的提取效果,发现甲醇与乙醇的提取效率相差不大。但用丙酮提取,部分农药如百草枯的提取率较低,且提取液中脂肪含量较高,对色谱柱的污染较大,因此本文选择甲醇作为提取溶剂。
2.2 色谱条件的选择
本文研究的8种棉花脱叶剂农药的分子极性及溶解性有较大差异,因此,在同一色谱条件下进行分离测定有一定难度。本方法利用UPLC系统及HSS T3柱,在提高分离度的同时获得更快的分析速度,从而获得了更高的灵敏度[12]。采用电喷雾正离子模式,采用5个通道分别分时段同时采集的不同农药的总离子流色谱图,大大提高了方法的检测灵敏度。8种棉花脱叶剂农药的UPLC-MS/MS总离子流图见图1,图2~图6为8种农药分通道采集的UPLC-MS/MS多反应监测谱图。图2为第1通道的百草枯的多反应监测谱图;图3为第2通道的脱落酸和噻苯隆的多反应监测谱图;图4为第三通道的甲基苯噻隆、敌草隆和嘧草硫醚的多反应监测谱图;图5为第四通道的氟酮唑草酯的多反应监测谱图;图6为第五通道的脱叶磷的多反应监测谱图。由图2~图6可知,在以上色谱-质谱条件下,4 min内就能够对8种脱叶剂农药进行有效的分离与测定,对于同一时刻的色谱共流出物,可通过对总离子流图的解卷积积分方法实现在不同离子通道下的分离与定量测定。

图1 8种脱叶剂混合标准溶液的UPLC-MS/MS总离子流色谱图Fig.1 Total ion chromatograms of the standard mixture of eight defoliants by UPLC-MS/MS
2.3 方法学考察
2.3.1 检出限与线性相关性
本实验采用外标定量的检测方法,将8种脱叶剂农药混合标准溶液的母液用乙腈-水(1∶9,v/v)稀释成一系列不同浓度的标准溶液,分别为10、50、100、200、300 μg/L。在上述色谱条件下进样检测,得到农药质量浓度与UPLC-MS/MS响应值的线性关系(结果见表2)。结果表明8种脱叶剂的线性关系都较好,相关系数均在0.99以上。

图2 通道1的MRM谱图Fig.2 Multiple reaction monitoring(MRM)chromatograms of channel 1

图3 通道2的MRM谱图Fig.3 MRM chromatograms of channel 2

图4 通道3的MRM谱图Fig.4 MRM chromatograms of channel 3

图5 通道4的MRM谱图Fig.5 MRM chromatograms of channel 4

图6 通道5的MRM谱图Fig.6 MRM chromatograms of channel 5
以3倍信噪比(S/N)确定方法的检出限(LOD),以10倍S/N确定方法的定量限(LOQ),求得8种脱叶剂农药的检出限和定量限见表2。从表2中的结果可以看出:UPLC-MS/MS对各种脱叶剂农药的响应值可达ng级,其中甲基苯噻隆的检出限最低,为0.8 μg/kg,其对应的定量限也最低为2.5 μg/kg;对脱落酸的检出限最高,为 29 μg/kg,其对应的定量限也最高,为96 μg/kg。
2.3.2 回收率与精密度
分别在空白皮棉试样中加入8种脱叶剂农药的标准溶液,添加水平(见表3)分别为0.1、0.5和1.0mg/kg,每个水平设置6个平行样品,按上述前处理和分析方法,测定农药在棉花中的添加回收率。结果表明:在所选用的仪器条件下,同一试样的重现性较好,相对标准偏差均小于15%,农药不同添加水平的回收率有一定的差异;随着添加水平的增高,回收率有上升的趋势。
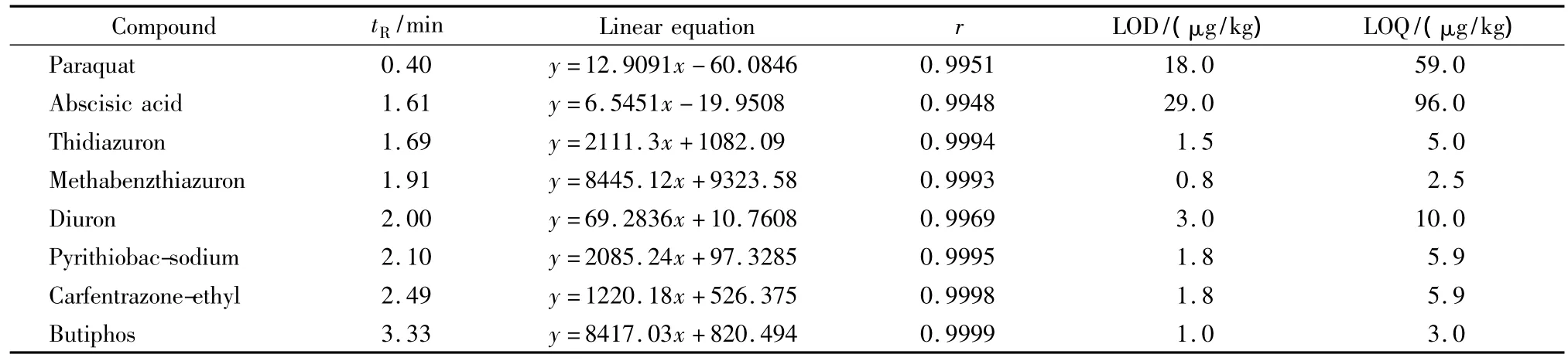
表2 8种脱叶剂的保留时间、线性方程、相关系数、检出限及定量限Table 2 Retention times,calibration curve equations,correlation coefficients(r),limits of detection(LOD)and limits of quantification(LOQ)of the eight defoliants

表3 脱叶剂在棉花样品中3个添加水平的回收率及相对标准偏差(n=6)Table 3 Recoveries and relative standard deviations(RSDs)at three fortification levels of the eight defoliants in cotton samples(n=6)
2.4 实际样品的测定
在上述条件下,对实验室随机抽取的几份皮棉样品进行测定(见表4),结果表明部分皮棉样品中存在脱叶磷农药残留。

表4 实际样品的测定结果Table 4 Results of the determination of real samples
3 结论
本文利用加速溶剂萃取快速提取棉花中的多种脱叶剂农药残留,采用超高效液相色谱-串联质谱在4min内就能够快速、准确地对8种脱叶剂农药进行分离测定,方法灵敏度高、操作简便、准确可靠。
[1]Yu W D.Science of Textile Materials.Beijing:China Textile Press(于伟东.纺织材料学.北京:中国纺织出版社),2006:5
[2]Chaudhry M R.Trends in Agrochemicals Used to Grow Cotton,Technical Information Section.Washington,DC,USA:International Cotton Advisory Committee,1996
[3]Tian X L,Duan L S,Li Z H,et al.Plant Physiology Communications(田晓莉,段留生,李召虎,等.植物生理学通讯),2004,40(6):758
[4]Wang Z R,Li B Q.Complete Works of Pesticide Commodity.Beijing:China Commerce Press(王振荣,李布青.农药商品大全.北京:中国商业出版社),1998:8
[5]Yang W H.China Cotton(杨伟华.中国棉花),2005,32(2):2
[6]OEKO-TEX Standard 100,Edition 01/2012
[7]Zhang Y M.China Inspection and Quarantine(张宇明.中国检验检疫),2010(4):32
[8]Zeng R,Sun J,Zhao R F,et al.Standard Science(曾蓉,孙近,赵瑞方,等.标准科学),2010(5):22
[9]Mao J S,Liu B,Guo D L,et al.Ecology and Environmental Sciences(毛江胜,刘宾,郭栋梁,等.生态环境学报),2011,20(2):364
[10]Zheng L G,Yang R B,Li B,et al.Journal of Ecology and Rural Environment(郑立国,杨仁斌,李蓓,等.生态与农村环境学报),2009,25(3):109
[11]Li X A,Chen X L,Zhao H.Acta Agriculturae Zhejiangensis(李新安,陈锡岭,赵华.浙江农业学报),2011,23(6):1172
[12]Wu G,Zhao S H,Wu J J,et al.Chinese Journal of Chromatography(吴刚,赵珊红,吴俭俭,等.色谱),2011,29(6):501
