体积排阻色谱法测定低分子量肝素抗凝血因子Xa的活性
2013-10-22张倩倩康经武
张倩倩, 康经武
(中国科学院上海有机化学研究所,上海 200032)
低分子量肝素(LMWHs)是一类抗凝血药物,广泛用于血栓栓塞性疾病的预防及治疗[1]。其抗凝作用是通过与血液中的抗凝血酶Ⅲ(ATⅢ)发生相互作用完成的。高负电荷密度的肝素能与ATⅢ上带正电的赖氨酸结合,使ATⅢ的分子结构发生变化,暴露出活性部位的精氨酸,从而大大增加了ATⅢ与凝血因子中丝氨酸接触的概率,可使其抗凝血活性增强1000倍左右[2]。与普通肝素相比,LMWHs增强了对凝血因子Xa(FXa)活性的抑制,但降低了对凝血酶活性的抑制,同时减少了它与内皮细胞、巨噬细胞及其他非特异性血浆蛋白的结合,因而具有出血副作用小、生物利用率高、皮下注射吸收好、半衰期长等优点[1,2]。
经典的肝素活性的检测方法是凝血实验,如活化部分凝血活酶时间(activated partial thromboplastin time,APTT)和活化凝血时间(activated clotting time,ACT)[3-5]。这些方法易受实验室、试剂、仪器设备等条件变化的影响,并且灵敏度低,通常只能得到半定量的结果[3]。由于LMWHs能够非常显著地抑制FXa的活性,因此,测定LMWHs对FXa活性的抑制作用被认为是检测LMWHs活性的黄金标准[6]。目前,最广泛使用的测定肝素抗FXa活性的方法是底物生色法[7]。其测试原理为:LMWH与过量的ATⅢ、FXa混合,形成三元复合物LWMH·ATⅢ·FXa;形成复合物的FXa不再具有凝血活性,而剩余的未形成复合物的FXa仍能够水解其标记有发色团(常用发色团为对硝基苯胺,pNA)的肽底物,释放出可以被光度计定量测定的对硝基苯胺[8]。在405 nm波长下检测到的吸光度值与样品中LWMH的活性成反比,这样就可以间接获得LMWHs的活性。尽管测定抗FXa活性的分光光度测试比传统的凝血测试具有更高的检测灵敏度和准确度,但仍然存在一些缺点:分光光度法要求样品足够清澈透明,而ATⅢ和FXa都有紫外吸收,复杂样品如血浆还有一定的浊度,因而在测定LMWHs活性时会引起一定的误差;此外,分光光度法所需要的样品量较大,尤其是ATⅢ和FXa,这些试剂价格昂贵,使得测试成本较高[9]。最近 Harris 等[9-11]发展了基于荧光分析的抗FXa测试方法,虽然可以避开样品背景吸收的干扰,但荧光底物的背景荧光对检测仍有较明显的干扰。
体积排阻色谱(SEC)采用化学惰性的多孔物质为固定相,按样品中各个组分相对分子质量大小实现分离。另外,熵驱动的SEC分离机制,最大限度地降低了分析物与固定相间的直接作用,大大简化了分离条件,仅使用温和的流动相和简单的洗脱条件就可以实现分离[12]。目前SEC已被广泛应用于大分子甚至是血浆蛋白的分离[12]。采用SEC色谱分离的方法排除复杂样品基质的干扰,就可以实现更准确的测量。
依诺肝素是当前使用最广泛的一种LMWH。用本文发展的基于体积排阻色谱的方法对依诺肝素抗FXa的活性进行了测试。方法以液相色谱自动进样器作为微量的酶反应器,依诺肝素、ATⅢ、FXa和生色底物的溶液依次进样,在进样器中混合、孵育,反应一段时间后,注入体积排阻色谱中进行分离检测。自动进样器大大减少了样品的消耗量。将酶反应产生的pNA与样品中的其他物质分离后在其最大吸收波长(385 nm)下测定,提高了测试的灵敏度。通过方法的验证,证明了该方法具有较好的准确性和精密度。这种基于体积排阻色谱-液相色谱的方法还可以用于血浆中依诺肝素抗FXa活性的监测。
1 实验部分
1.1 仪器、试剂与材料
Agilent 1260高效液相色谱仪,配置有二元泵、紫外检测器、柱温箱和高性能自动进样器;TSKgel MP(PW)-M预柱(35 mm×4.6 mm)。
ATⅢ(25 IU/支)和 FXa(71 nkat/支)购自意大利Chromogenix公司。FXa发色肽底物(chromogenic peptide substrate,CPS,序列:CH3OCO-DCHA-Gly-Arg-pNA·AcOH)、对硝基苯胺、人混合血浆购自Sigma公司。欧洲药典LMWH标准品(美国USP公司)。两批LMWH(依诺肝素钠)注射液(克赛)200806和200912购自法国赛诺菲·安万特(Sanofi Aventis)公司;供试品依诺肝素钠(固体)20110401和20110402由杭州九源基因工程有限公司提供。
1.2 溶液配制
分别配制 0.50 mol/L Tris,1 mol/L NaCl,1 mol/L HCl和0.5 mol/L EDTA储备液各500 mL。pH 8.4缓冲液的配制:分别量取一定量的Tris、NaCl和EDTA储备液,用1 mol/L HCl调至pH 8.4,定容后溶液中含50 mmol/L Tris,175 mmol/L NaCl和7.5 mmol/L EDTA。pH 7.4缓冲液的配制:分别量取一定量的 Tris、NaCl,用1 mol/L HCl调至 pH 7.4,定容后溶液中含50 mmol/L Tris和150 mmol/L NaCl。FXa生色肽底物用超纯水配制成3 mmol/L的储备液,使用前用 pH 8.4缓冲液稀释至0.5 mmol/L。
依诺肝素钠标准品溶液(S):按0.78的剂间比,用 pH 7.4缓冲液分别稀释,得到 0.087 IU/mL(S1)、0.111 IU/mL(S2)、0.143 IU/mL(S3)、0.183 IU/mL(S4)的工作溶液。依诺肝素钠供试品溶液(TA):克赛预估效价为10000 IU/mL,按剂间比0.78,用pH 7.4缓冲液分别稀释,得到 0.087 IU/mL(T1)、0.111 IU/mL(T2)、0.143 IU/mL(T3)、0.183 IU/mL(T4)的工作溶液;供试品溶液(TB):杭州九源提供的依诺肝素钠预估效价为110 IU/mg,按照剂间比0.78,用pH 7.4缓冲液配制20 mg/mL的溶液,再分别稀释,得到 0.087 IU/mL(T1)、0.111 IU/mL(T2)、0.143 IU/mL(T3)、0.183 IU/mL(T4)的工作溶液。抗凝血酶ATⅢ溶液:25 mL水溶解得1 IU/mL的溶液。凝血因子FXa溶液:10 mL水溶解得7.1 nkat/mL的溶液。所有溶液由超纯水配制(Millipore UV超纯水系统,美国Millipore公司),缓冲液在使用前用0.45 μm的滤膜过滤。
1.3 SEC色谱分离条件
色谱柱:TSKgel MP(PW)-M预柱(35 mm×4.6 mm),工作范围为DNA 500~5000 bp;流动相A为H2O;流动相 B为乙腈和 50 mmol/L NaH2PO4-H3PO4混合溶液(20∶80,v/v),pH 3.0,使用前用0.45 μm的微孔过滤膜过滤。洗脱条件为:0~1 min保持100%A;1~1.5 min从100%A线性过渡到100%B;1.5~8.5 min保持100%B;8.5~9 min线性梯度回到100%A;9~13.5 min保持100%A。检测波长385 nm;流速0.6 mL/min;柱温25℃;进样量 5 μL。
1.4 低分子量肝素的活性测定
将液相色谱自动进样器作为自动的微酶反应器。LMWH、ATⅢ、FXa和底物CPS依次进样,在进样器内混合孵育反应,然后用体积排阻色谱分离酶解产物。通过定量测定生成的pNA,实现LMWH活性的测定。在设定的自动进样程序中,样品瓶放置次序为:1#,水(清洗瓶);2#,LMWH 样品;3#,ATⅢ;4#,FXa;5#,底物 CPS。进样程序为:从2#和3#瓶中分别抽取1 μL,混合3次,静置1 min;从4#瓶中抽取2 μL,混合进样针内的4 μL溶液3次,静置1 min;从5#瓶中抽取5 μL,混合针内的9 μL 溶液3次,静置4 min;最后进样。按照优化的色谱分离条件分离分析产物。
按照已经优化好的方法,变换LMWH的浓度,按照 S1、S2、S3、S4、T1、T2、T3、T4、T1、T2、T3、T4、S1、S2、S3、S4的排列顺序测试16次,记录下每次反应产生的pNA的峰面积。以pNA的峰面积为纵坐标,LMWHs标准品(或供试品)溶液浓度的对数值为横坐标分别做线性回归曲线,并按照生物活性测定的统计方法(中国药典2005年版第二部附录XIV)计算效价和实验误差[13,14]。
1.5 血浆中低分子量肝素抗FXa活性的测定
测试血浆样品中依诺肝素活性时未用自动进样器。首先用pH 8.4的缓冲液分别配制0、0.1、0.2、1 IU/mL的依诺肝素钠溶液。取20 μL某一浓度的依诺肝素钠溶液与20 μL血浆混合,30℃水浴孵育2 min后加入40 μL FXa,混匀孵育2 min;加入40 μL CPS,混匀后置于30℃水浴孵育,计时;分别在孵育5、10、15、20、30、45、60 min 时间节点取 9 μL反应液,用6 μL 20%(体积分数)乙酸溶液淬灭酶反应;取10 μL反应液注入SEC分离,其他色谱条件与自动进样分析相同。根据对硝基苯胺的峰面积随时间变化曲线,并由每条曲线的斜率绘制血浆中依诺肝素的剂量反应曲线[15]。
2 结果与讨论
2.1 SEC方法的建立
样品中主要含有 ATⅢ、FXa、人血清白蛋白、LMWHs、生色底物肽CPS和pNA。ATⅢ、FXa和人血清白蛋白的相对分子质量分别为62~67 kDa,43 kDa和67 kDa;依诺肝素钠的平均相对分子质量为4.5 kDa,底物CPS的相对分子质量622.7 Da,pNA的相对分子质量为138 Da。分离时,蛋白质在柱内无保留,首先洗脱出来,相对分子质量越小的组分保留越强,洗脱时间越长,从而实现各组分的分离。结果发现,在 TSKgel MP(PW)-M预柱上以150 mmol/L NaH2PO4-NaOH(pH 7.4)缓冲液作为流动相,流速为0.35 mL/min时pNA在20.2 min时可以被洗脱出来,但CPS不能被洗脱出来,这是由于碱性的精氨酸使得肽吸附在色谱柱上。将缓冲液由中性调为酸性(pH 3.0),CPS能够较快地洗脱出来,但是却很难洗脱出 pNA。推测由于 TSKgel MP(PW)-M柱填料的亲水性差,使得疏水性的pNA吸附在填料上。为了增强缓冲液对疏水性物质的洗脱强度,在流动相中加入一定量乙腈,同时也将流动相中盐的浓度降为50 mmol/L。如图1所示,当乙腈从10%增加到20%时,pNA的洗脱时间变短,柱效也大大提高。考虑到色谱柱对有机溶剂的承受力和分离效率,我们选用了含20%ACN的50 mmol/L NaH2PO4-H3PO4(pH 3.0)作为流动相。
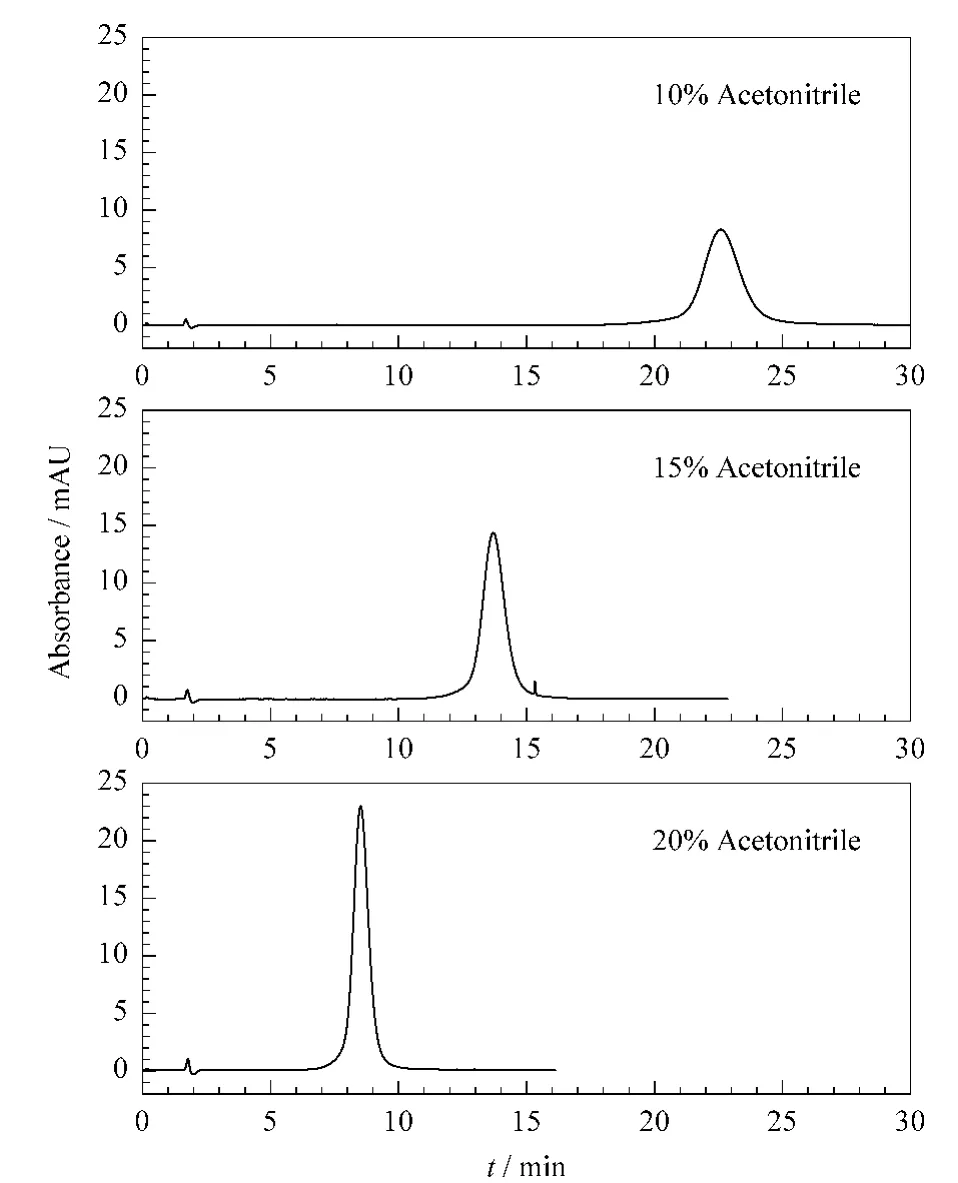
图1 流动相中有机溶剂浓度对pNA洗脱时间的影响Fig.1 Effect of organic composition in mobile phase on the elution time of pNA
尽管上述色谱条件可以满足分离度和效率的要求,但pH 3.0的酸性缓冲液和乙腈都有可能引起蛋白的沉淀,所以采用两种流动相接力洗脱的方式。流动相A为50 mmol/L NaH2PO4-H3PO4缓冲液(pH 7.4);流动相B为含20%ACN的50 mmol/L NaH2PO4-H3PO4缓冲液(pH 3.0)。先用流动相A将蛋白等大分子洗脱出柱,再用流动相B将CPS和pNA洗脱出来。但两种pH值差异较大的洗脱液交替洗脱时产生大量的气泡,分离效果差。所以将流动相A改为纯水,避免了气泡的产生。最终选择1.3节所述色谱洗脱条件。
在经过优化的洗脱条件下,血浆样品中的蛋白、CPS、pNA被分离开,结果如图2所示。传统的分光光度法中,为了避免发色肽底物的干扰,只能选择在405 nm的波长下检测,降低了检测的灵敏度[8]。而在我们的方法中,由于pNA能与酶反应液中其他成分分开,因此可以在其最大吸收波长385 nm下检测,获得最佳的检测灵敏度。如图2所示,考察了不同检测波长下对硝基苯胺的峰面积,在385 nm下得到的峰面积(1288)比在405 nm下得到的峰面积(895)高40%。
2.2 方法验证
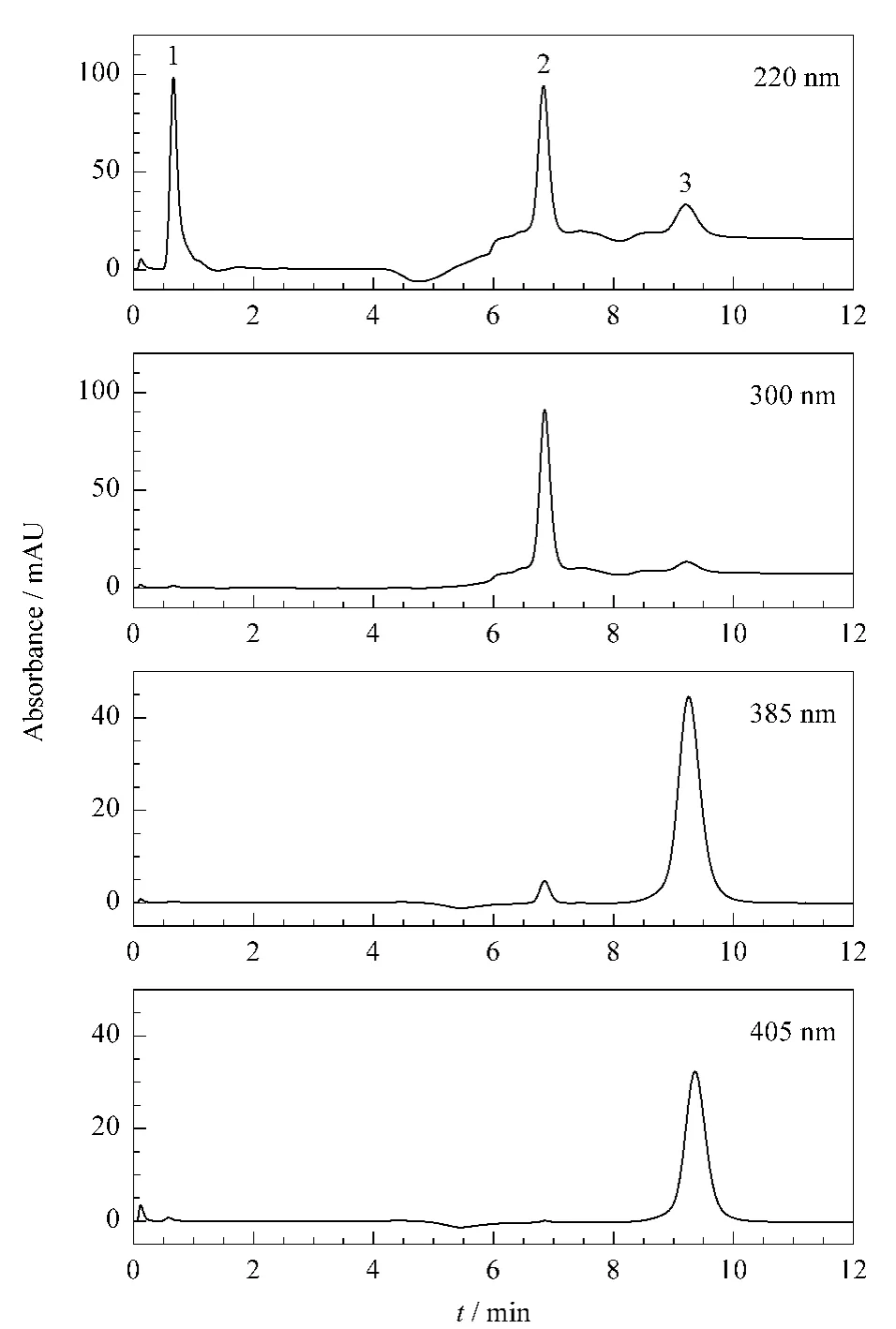
图2 不同吸收波长下标准品混合物分离的色谱图Fig.2 Chromatograms obtained at different detection wavelengths
在优化的色谱条件下考察了方法的重复性。pNA的洗脱时间和峰面积在日内和日间的重复性列于表1中,该方法日间和日内重复性的RSD均小于1%,具有优良的方法重现性。
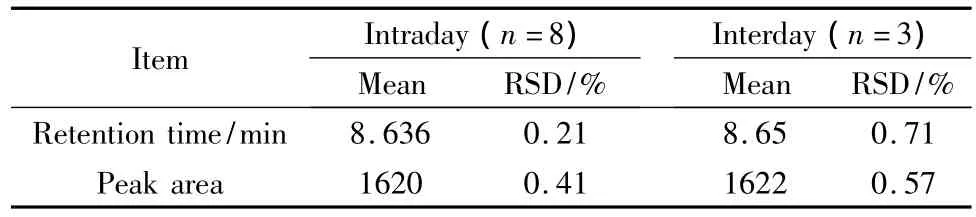
表1 对硝基苯胺的洗脱时间和峰面积在日内与日间的重复性Table 1 Intraday and interday repeatabilities in terms of the retention time and peak area of pNA
随后,我们对pNA的浓度与峰面积关系的线性范围进行了考察,在0.05~1 mmol/L的浓度范围内,r2为0.9998,线性关系良好。
2.3 LMHWs抗FXa的活性测定
2.3.1 在线酶反应条件的选择
首先考察了酶FXa在测试过程中的稳定性。将FXa从4℃冰箱中取出,室温下至少放置20 min后恢复活力[15],用自动进样器取 FXa溶液2 μL和CPS溶液5 μL混合3次,静置4 min后进样分离。酶活性随测试时间变化的趋势如图3所示。
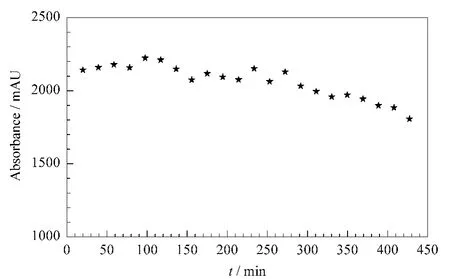
图3 室温下FXa活性随测试时间变化趋势图Fig.3 Time course of the FXa activity at room temperature
从图3中可以看出,FXa在室温下放置200 min以内,其活性基本保持不变,实验前后10个点的RSD为2.1%。200 min之后,酶活性衰减明显。随后考察了酶ATⅢ在室温下的稳定性,测试时先抽取1 μL的依诺肝素钠溶液和1 μL的ATⅢ溶液,混合后静置1 min,再抽取2 μL FXa混合并静置1 min,最后抽取5 μL CPS混合后静置4 min,进样分离。发现在室温下放置40 min的FXa活力保持不变,再延长放置时间,其活力会明显衰减。因此在进行肝素活性测试时每分析8次后,更换一次 FXa,每次使用前在室温下放置20 min恢复活力。ATⅢ每次分析更换一次,每次使用前在室温下放置20 min恢复酶活力。
2.3.2 LMWHs抗 FXa 的效价测定
将依诺肝素钠标准品按照1∶0.78的剂间比配制一组梯度效价溶液(即 S1、S2、S3、S4)。对于供试品依诺肝素钠,首先预估一个效价,再根据预估效价配制出与标准品效价浓度相同的梯度溶液,分别标记为T1、T2、T3、T4。由于使用的是分离分析的方法,不需要扣除空白,所以省去了空白对照组。
用已经优化好的方法,按照以下顺序:S1、S2、S3、S4,T1、T2、T3、T4,T1、T2、T3、T4,S1、S2、S3、S4测试16次,记录下每次反应中 pNA的峰面积。以pNA的峰面积为纵坐标,标准品(或供试品)效价浓度的对数值为横坐标分别做线性回归曲线,并按照中国药典2005年版第二部附录XIV中生物检定统计方法计算效价和实验误差,平均可信限率(FL)不得大于15%,剂间、回归需显著,偏离平行、二次曲线、反向二次曲线需不显著。
测试了克赛的两批依诺肝素钠试剂,以及由杭州九源公司提供的依诺肝素钠。以标准品(或供试品)溶液浓度的对数值为横坐标的线性回归曲线都表现出良好的线性和双平行线性质(见图4)。实验数据用4×4量平行统计方法进行了统计(见表2)。
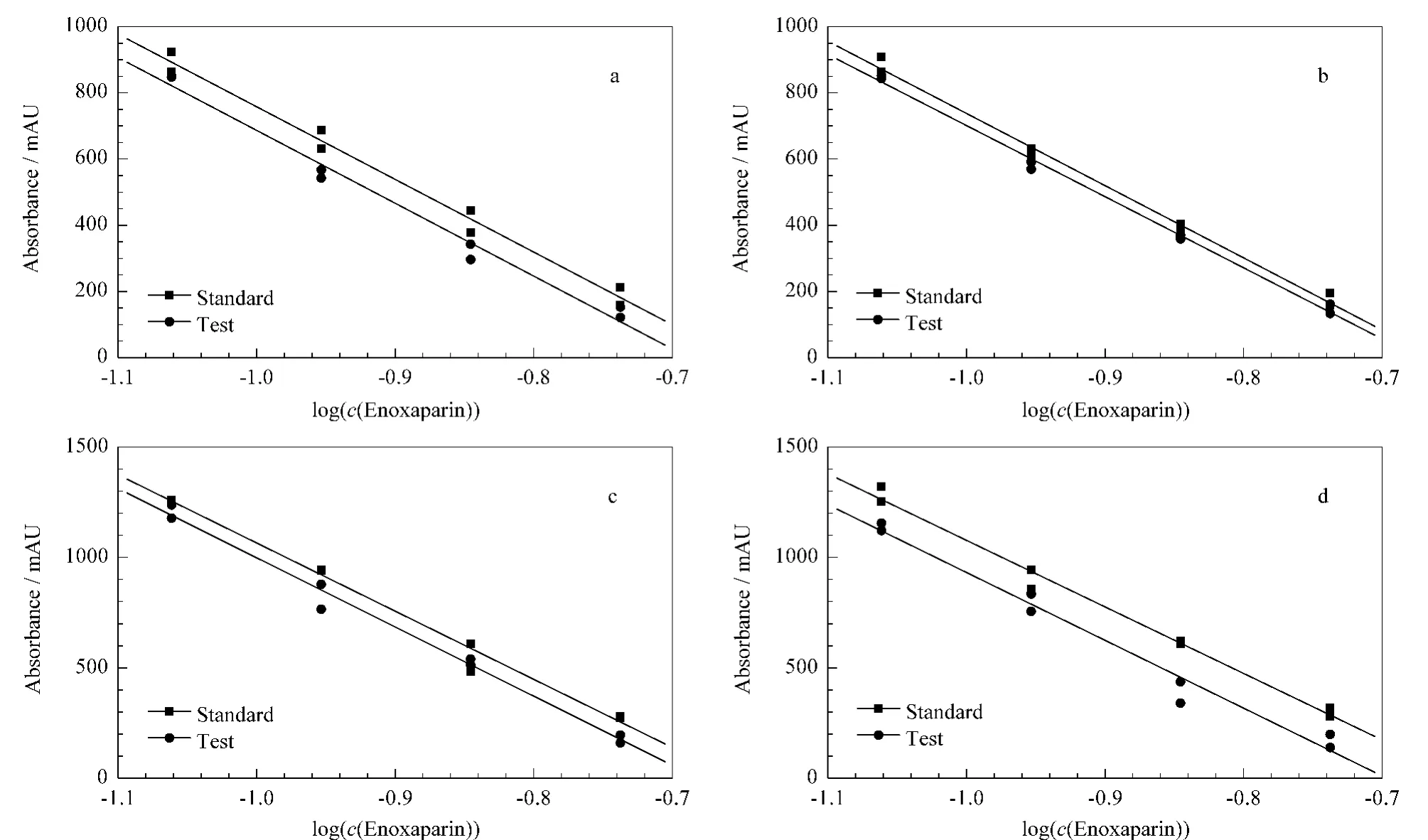
图4 供试品和标准品的峰面积与浓度对数值的线性回归曲线Fig.4 Regression curves of the peak areas against the log concentrations of the test samples and a standard sample Lot No.:a.200806;b.200912;c.20110401;d.20110402.
本实验测得的结果与标示值结果接近,FL小于15%,可靠性检测全部通过,剂间、回归显著,偏离平行、二次曲线、反向二次曲线不显著。基于SEC测得的4批依诺肝素钠的效价与它们由分光光度法测定的标示效价一致。
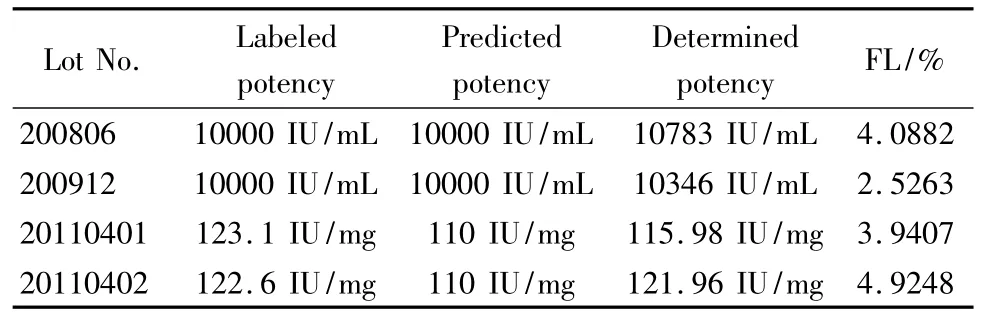
表2 实验测得样品效价Table 2 Determined potency of enoxaparin
2.4 血浆中低分子量肝素抗FXa活性研究
依诺肝素具有较好的药物动力学可预测性,因此对绝大部分病人而言不需要进行血药浓度的监测。然而,对于一些特殊的受药群体,如肥胖病患者、肾功能缺陷患者、孕妇、老人、儿童等,由于他们药代动力学的改变,国际血栓和止血协会(International Society of Thrombosis and Haemostasis)建议对依诺肝素的血药浓度进行监测[16,17]。本文考察了血浆中依诺肝素在0~1 IU/mL范围内抗FXa活性的动力学变化。图5a为pNA紫外吸收强度随时间变化的曲线。当依诺肝素为0时,只需反应5 min紫外吸光度值便可达1000 mAU以上;当依诺肝素超过0.1 IU/mL时,紫外吸收强度随反应时间的增加缓慢增加。剂量反应曲线是由紫外吸光强度曲线的线性区域计算出的斜率(反应速率)与剂量关系的曲线(图5b)。剂量反应曲线中,反应速率随着LWMH的增加而减小。当血浆中依诺肝素超过0.2 IU/mL时斜率值变化很小,即抗凝血效果显著。通过测定血液中依诺肝素的抗凝血活性,由图5b即可反推出依诺肝素在血液中的浓度。
3 结论
本文发展了一种基于SEC测试低分子量肝素抗FXa活性的方法,为低分子量肝素效价的测定提供了一个简单、高效、自动化的方法,有助于低分子量肝素生产过程中的质量控制。在自动进样器上完成溶液的混合、反应,大大简化了手工操作程序。只需使用一根长30 mm的体积排阻色谱柱即可实现复杂酶反应液中的生色底物、游离发色团和各种蛋白的分离。因此对游离发色团的定量不再受血浆中其他成分的干扰,拓展了样品的应用范围。同时也可以在对硝基苯胺的最大吸收波长下检测而不用担心受到底物在此波长下的吸收干扰。并且该方法极大地减少了样品的消耗量,大大地降低了成本。因此有可能用于各种复杂样品中依诺肝素抗FXa活性的监测,对肝素临床治疗和疗效评价有着重要的意义。
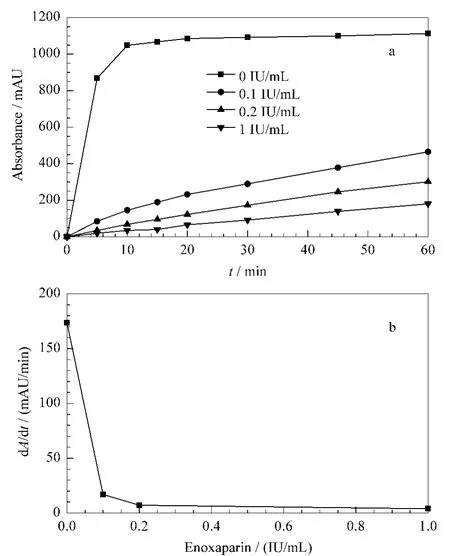
图5 SEC测量的抗FXa活性的动力学变化曲线Fig.5 Pharmacokinetic profiles of SEC-based anti-FXa assay in the presence of enoxaparin(0-1 IU/mL)
[1]Weitz J I.New Engl J Med,1997,337(10):688
[2]Hirsh J,Raschke R.Chest,2004,126(Suppl 3):188S
[3]Baglin T,Barrowcliffe T W,Cohen A,et al.Br J Haematol,2006,133(1):19
[4]Anand S,Ginsberg J S,Kearon C,et al.Arch Intern Med,1996,156(15):1677
[5]Martindale S J,Shayevitz J R,D’Errico C.J Cardiothorac Vasc Anesth,1996,10(4):458
[6]Hammerstingl C.Cardiovasc Hematol Agents Med Chem,2008,6(4):282
[7]Teien A N,Lie M,Abildgaard U.Thromb Res,1976,8(3):413
[8]Witt I.Eur J Clin Chem Clin Biochem,1991,29(6):355
[9]Harris L F,O’Brien A,Castro-Lopez V,et al.Thromb Res,2011,128(6):e166
[10]Harris L F,Castro-Lopez V,Jenkins P V,et al.Thromb Res,2011,128(6):e125
[11]Harris L F,Castro-Lopez V,Hammadi N,et al.Talanta,2010,81(4/5):1725
[12]Manley S A,Gailer J.Expert Rev Proteomics,2009,6(3):251
[13]The United States Pharmacopeial Convention.Revision Bulletin,Enoxaparin,2008
[14]Pharmacopoeia Commission of the People’s Republic of China.Pharmacopoeia of the People’s Republic of China.Part 3.Beijing:Chemical Industry Press(国家药典委员会.中华人民共和国药典.三部.北京:化学工业出版社),2005:Appendix 166
[15]Castro-Lopez V,Harris L F,O’Donnell J S,et al.Anal Bioanal Chem,2011,399(2):691
[16]Clark N P.Thromb Res,2008,123(Suppl 1):S58
[17]Greaves M.Thromb Haemost,2002,87(1):163
