基于液相色谱-质谱联用技术的肺癌细胞代谢组学分析
2013-10-22余欣尉马小琼
余欣尉, 吴 谦, 吕 望, 王 彦, 马小琼, 陈 喆*, 阎 超*
(1.上海交通大学药学院,上海 200240;2.浙江中医药大学附属第一医院中心实验室,浙江杭州 310006)
根据世界卫生组织报告,每年全球有上百万人死于肺癌。肺癌原位癌治愈率接近100%,但由于肺癌早期临床表现不明显,大部分患者确诊时已属晚期,只能采用姑息治疗,预后较差,总的5年生存率约10%~15%[1],因此,发展有效的早期诊断方法无疑能使患者尽早得到治疗,明显改善患者预后,延长肺癌患者的生存时间。目前肺癌诊断的常用方法有影像学检查方法、痰脱落细胞学检查和支气管镜检技术[2],这些方法容易造成漏诊与误诊,且仪器价格昂贵,不适合作为肺癌早期筛查手段。
近年来,随着系统生物学的飞速发展,肿瘤标志物的识别已成为恶性肿瘤早期诊断的研究热点。肿瘤标志物是指在肿瘤发生和增生过程中,由肿瘤细胞生物合成、释放或者是肿瘤与宿主相互作用而产生的一类物质,其最终导致体内的代谢物质发生变化[3]。代谢组学可以对肿瘤发生发展过程中的所有代谢物进行定性和定量分析,并能识别未知代谢产物[4]。这种方法已经成功地应用于乳腺癌[5]、前列腺癌[6]的肿瘤标志物识别中,对建立肺癌的早期诊断方法具有重要的参考价值。
目前肺癌早期标志物的代谢组学研究主要通过对比肺癌病人与健康人的血液或尿液,但在很多代谢过程中,代谢产物个体差异大,极易受到饮食、环境、年龄和其他疾病等因素的干扰,在如此复杂的背景下识别疾病标志物极有难度。而以肿瘤细胞作为代谢组学研究对象,通过细胞代谢物的差异表达寻找潜在的特异性疾病标记物,可以避免常规实验中样本个体差异与复杂性问题,是一种极有前景的技术方法。Sheikh等[7]考察了细胞培养与提取方法对代谢物的影响,Gao等[8]考察了细胞脂质代谢物的提取方法和条件,这些研究都为开展细胞代谢组学研究提供了基础,但相关研究国内外尚无报道。
本课题组以肺癌与对照细胞为样本,采用高效液相色谱-四极杆飞行时间质谱(HPLC-Q-TOF/MS)技术结合代谢组学数据处理手段,探索新的研究思路以识别疾病标志物,同时与传统肺癌代谢组学研究结果相互验证,为肺癌的早期诊断提供参考。
1 实验部分
1.1 仪器与试剂
Paradigm MG4高效液相色谱仪(美国Michrom公司);maXis UHR-TOF超高分辨四极杆-飞行时间质谱仪(德国Bruker公司);IEC MICROCL 17R微量冷冻高速离心机(美国Thermo公司);VXR旋涡混合器(德国IKA公司);离心浓缩干燥器(太仓市华美生化仪器厂);25 cm2斜颈细胞培养瓶(美国BD Falcon公司)。
胎牛血清、McCoy's 5A培养液、DMEM(Dulbecco's modified eagle medium)高糖培养液、1640培养液(美国Gibco公司);甲醇、乙腈(HPLC级,德国Merck公司);甲酸、醋酸铵(LC-MS级,瑞士 Fluka公司);去离子水由 NANOpure超纯水系统(美国Barnstead公司)制备。
1.2 细胞来源
人肺癌细胞 H358、A549、HCC827、H1299、Calu-3、Calu-1、PC-9和人正常胚肺成纤维细胞MRC-5均购自中国科学院上海细胞库。
1.3 细胞培养
取Calu-1细胞使其贴壁生长于含10%(体积分数,下同)胎牛血清的 McCoy's 5A培养液中;取MRC-5细胞使其贴壁生长于含10%胎牛血清的DMEM 高糖培养液中;取 H358、A549、HCC827、H1299、Calu-3、PC-9使其贴壁生长于含10%胎牛血清的1640培养液中;所有细胞均培养于25 cm2斜颈细胞培养瓶中。将所有培养瓶置于37℃,5%CO2的恒温培养箱中培养。每种细胞平行培养6份,其中1份用于细胞计数,另外5份用于细胞提取。
1.4 细胞提取方法
取一盒对数生长期的细胞,倒掉培养基,用10 mL冰磷酸盐缓冲液(PBS)清洗两遍,液氮淬灭。在每盒细胞中加入0.75 mL甲醇-水(4∶1,v/v)溶液,用细胞刮刀刮下细胞,置于1.5 mL离心管中。在液氮、37℃水浴中反复冻融两次。加入3 μL 100 μg/mL L-2-氯苯丙氨酸(内标)与 3 μL 100 μg/mL溶血卵磷脂(lysophosphatidylcholine,LPC)12:0,加入0.45 mL二氯甲烷。置冰上,每5 min短暂涡旋一次,每次涡旋30 s,持续30 min。加入0.15 mL水促进分层。在4℃下12000 r/min离心5 min,置于-20℃冰箱中过夜。将离心管上层与下层分别转移至两个新离心管中,旋干,上层用60 μL含0.1%甲酸的水溶液复溶,下层用60 μL含5 mmol/L醋酸铵的甲醇-水-甲酸(74∶25∶1,v/v/v)溶液复溶。分别进样分析。
1.5 上层提取物的色谱条件
C18 色谱柱(100 mm ×2.1 mm,3 μm,日本Shisedo公司);流动相A:含0.1%甲酸的水溶液,流动相 B:含 0.1%甲酸的乙腈溶液;流速:200 μL/min。梯度洗脱程序:0~5 min 0%B,5~25 min 0~50%B,25~30 min 100%B;柱温:25℃;进样量:20 μL。
1.6 下层提取物的色谱条件
C18 色谱柱(100 mm ×2.1 mm,3 μm,日本Shiseido公司);流动相A:含5 mmol/L醋酸铵的甲醇-水-甲酸(74∶25∶1,v/v/v);流动相 B:含 5 mmol/L醋酸铵的甲醇-甲酸(99∶1,v/v);梯度洗脱程序:0~10 min 50%B~100%B,10~30 min 100%B;柱温:25 ℃;进样量:20 μL。
1.7 质谱条件
采用电喷雾离子源(ESI)正离子模式检测,喷雾电压:+4.5 kV;雾化气压:80 kPa;干燥气流速:6.0 L/min;干燥气温度:200℃;碰撞池电压(RF):500 Vpp;质量扫描范围:m/z 50~1000;质量校正液:1 mmol/L甲酸钠。
1.8 数据统计分析
将HPLC-MS获得的原始质谱数据通过Bruker DataAnalysis 3.3软件转换成 NetCDF格式,导入metAlignTM软件包进行峰识别、峰对齐、基线矫正和峰面积归一化法预处理。然后导入SIMCAP 11.5软件进行多维统计分析,在本实验中采用PLS-DA模型区别各组代谢物差异,通过 R2X、R2Y、Q2参数值评价模型质量,其中R2X、R2Y越接近1表示模型越稳定,Q2>0.5表示预测率高。根据PLS-DA模型得到的变量权重值(VIP)找到潜在的疾病生物标志物,其中VIP>1。为了验证多维统计中找到的差异物是否在单位统计上具有显著差别,实验中采用 T检验,其中 p<0.05有显著性差异[9]。通过差异物的精确质荷比及同位素比例,在 HMDB(http://www.hmdb.ca/)和 METLIN(http://metlin.scripps.edu/)数据库中搜索可能的结构式进行推测。
2 结果与讨论
2.1 细胞提取方法的优化
液液萃取是代谢物提取方法中常用的方法之一,Sana等[10]以血红细胞为研究对象,系统考察了液液萃取过程中有机相和水相的性质、两相溶剂比例、水相pH等因素对提取到的化合物数量和实验方法重现性的影响。Lorenz等[11]详细考察了不同的淬灭方法、清洗溶剂、提取溶剂对INS-1细胞代谢物的提取效率与稳定性的影响。本实验对文献所述的样品前处理方法进行了优化,采用液液萃取的方法,分别提取细胞极性代谢物与非极性代谢物。实验表明,用PBS进行清洗,液氮淬灭有助于稳定样品代谢物。样品在液氮及37℃水浴中反复冻融两次,细胞可完全破碎。以甲醇-水-二氯甲烷(4∶2∶3,v/v/v)作为提取液,水相和有机相的互溶性最小,得到的细胞代谢物数量最多。此外,本实验中以二氯甲烷代替文献中常用的氯仿,减少了萃取溶剂对实验人员与环境的危害。
2.2 分析条件的优化
实验中考察了流动相性质与洗脱梯度对样品分离效果的影响。
细胞上层提取物主要为极性代谢物,适合使用含0.1%甲酸的乙腈-水流动相体系。同时,比较了不同梯度(27 min、37 min、47 min)下的色谱分离情况,实验表明,采用1.5节所述的梯度条件对细胞极性代谢物样品的分析速度适中,分离效果最佳。
细胞下层提取物主要为脂质等非极性代谢物,这些物质在色谱柱中的保留时间较长,且难以洗脱。实验中考察了含5 mmol/L醋酸铵的甲醇-水-甲酸体系流动相与含10 mmol/L醋酸铵的甲醇-水-甲酸体系流动相对脂质的洗脱能力,同时比较了不同梯度(27、37、47 min)下的色谱分离情况,实验表明,5 mmol/L醋酸铵流动相体系下质谱信号基线稳定,峰形较好,采用1.6节所述的梯度条件能检测到的色谱峰个数最多。
在最优HPLC-MS分析条件下,分别对人肺癌细胞 H358、A549、HCC827、H1299、Calu-3、Calu-1、PC-9及人胚肺成纤维细胞MRC-5的极性代谢物与非极性代谢物进行分析,得到不同细胞的代谢物指纹图谱。在S/N=10时,8种细胞的极性代谢物谱图分子特征峰个数在4000~6000之间,非极性代谢物谱图分子特征峰个数比较接近,在2400~2600之间。较大的色谱峰容量为细胞代谢物的分析提供了丰富信息。图1为典型的细胞极性和非极性代谢物谱图。
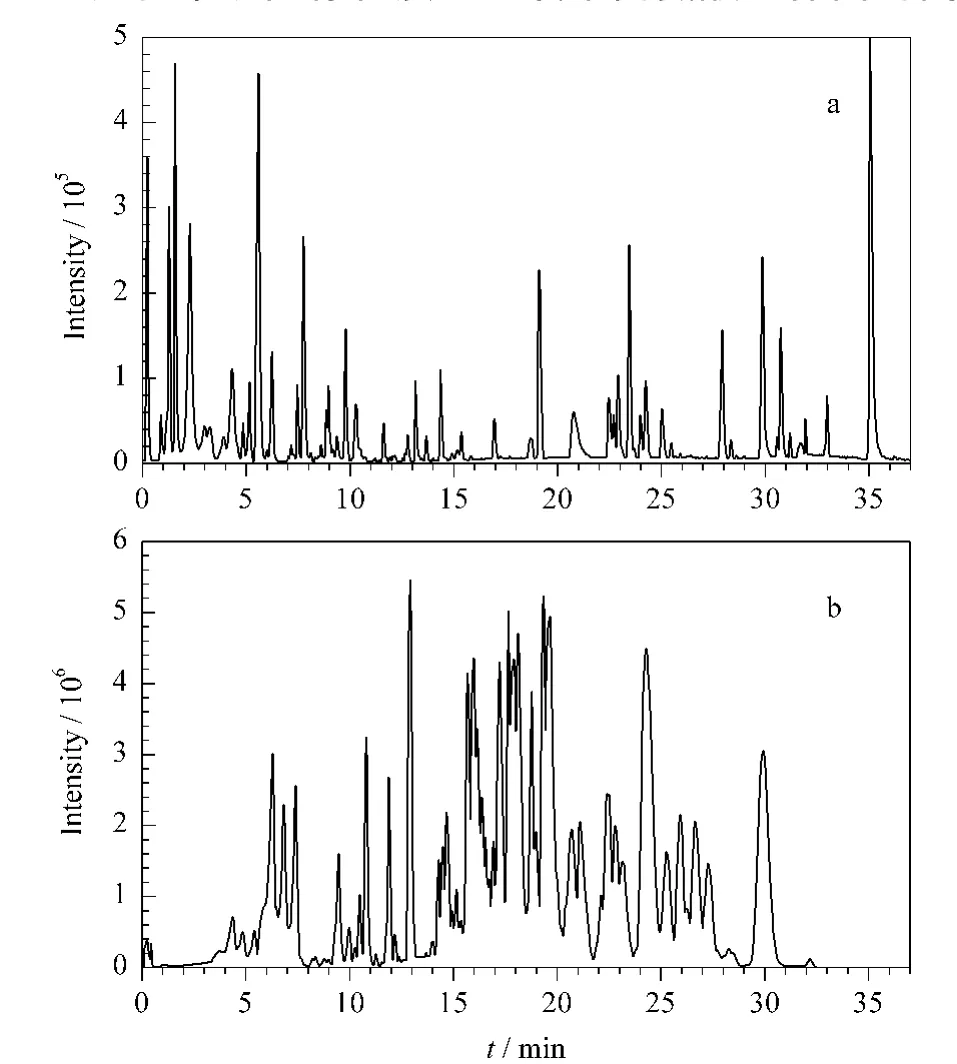
图1 H358细胞的(a)极性、(b)非极性代谢物谱图Fig.1 Typical HPLC-MS base peak chromatograms of(a)polar metabolite profile and(b)non-polar metabolite profile of lung tumor cell H358
实验中以内标物质L-2-氯苯丙氨酸与保留时间为 6.46、7.70、10.30、26.32 min 的 5 个主要色谱峰的保留时间考察了极性代谢物层实验方法的重现性,谱峰保留时间的RSD均小于1.37%;同时以内标物质 LPC 12:0 与保留时间为 11.49、16.31、20.11、24.23 min的5个主要色谱峰的保留时间考察了非极性代谢物层实验方法的重现性,谱峰保留时间的RSD均小于1.04%,表明实验所用方法具有较好的重现性。在优化的色谱条件下,系统对标准品L-2-氯苯丙氨酸和LPC 12:0的检出限均为0.5 ng/mL。
实验中还考察了同一样品在正、负离子两种模式下的出峰情况,发现细胞样品在正离子模式下的色谱峰较多,获得的信息量更多,且信号强度较大,因此选择正离子模式对细胞代谢物进行分析。
2.3 PLS-DA模型结果
在上述色谱条件下,分别对8种细胞的极性与非极性代谢物进样分析,采用PLS-DA模型进行多维统计分析[11]。图2分别为8种细胞的极性代谢物与非极性代谢物的PLS-DA得分图。对于极性代谢物,该模型包含5个主成分,其拟合参数为R2X=0.779,R2Y=0.98,Q2=0.954;对于非极性代谢物,该模型包含3个主成分,其拟合参数为R2X=0.481,R2Y=0.983,Q2=0.974;说明模型的稳定性和预测率较高。
由图2可见,在极性代谢物层与非极性代谢物层,人胚肺成纤维细胞MRC-5均与其他7种人肺癌细胞相距较远,说明非肿瘤细胞与肿瘤细胞代谢物有着显著差异。在极性代谢物层,MRC-5细胞相对比较分散,其他各种肿瘤细胞组内聚类较好,这可能是由于人胚肺细胞分化程度低,而肿瘤细胞分化程度高,这与栗晖等[12]的研究结果一致。从图2中还可以看出,无论是在极性代谢物层还是在非极性代谢物层,7种人肺癌细胞的代谢物之间也存在细微的差异,这种差异可能是由于各细胞不同的组织来源、形态和治疗背景造成的。
2.4 代谢差异物
通过HMDB和METLIN数据库搜索差异物的精确质荷比,对一些具有显著性差异的物质进行了初步的结构鉴别,获得了10种细胞极性代谢差异物(见表1)与21种细胞非极性代谢差异物结构信息(见表2)。
在肿瘤细胞的极性代谢物层,苯丙氨酸含量增加,缬氨酸、蛋氨酸、脯氨酸含量减少,与正常对照组相比均具有显著性(p<0.05),这可能是由于癌症细胞的蛋白质代谢紊乱造成的,该结果与肺癌患者血、尿代谢组学研究结论基本吻合[13-16]。
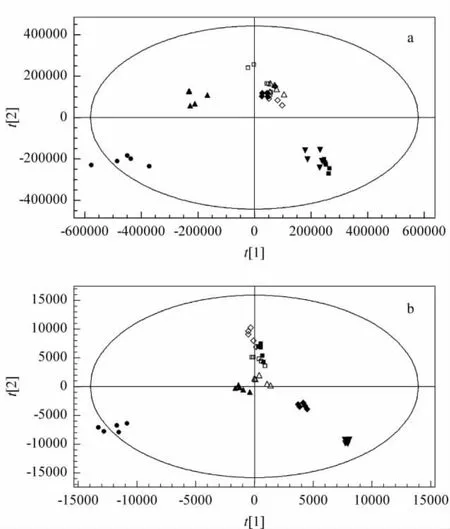
图 2 人肺癌细胞 H358、A549、HCC827、H1299、Calu-3、Calu-1、PC-9及人胚肺成纤维细胞MRC-5的(a)极性、(b)非极性代谢物的PLS-DA分类图Fig.2 PLS-DA results of(a)polar-metabolites and(b)non-polar metabolites of lung tumor cell lines H358,A549,HCC827,H1299,Calu-3,Calu-1,PC-9 and normal cell line MRC-5
L-肉碱主要参与脂肪酸代谢,其主要功能是将脂肪酸从细胞质转移到线粒体进行β-氧化,并以酰基肉碱的形式储备能量。与对照组细胞相比,肿瘤细胞的丁酰-L-肉碱与2-甲基丁酰基肉碱含量显著增加,这可能是由于肿瘤细胞快速复制导致脂肪酸的β-氧化下调造成的。
鞘氨醇是细胞生命活动中的重要信号分子,通过神经酰胺酶途径与鞘氨醇激酶途径直接参与细胞的增殖与凋亡调控。正常细胞内的神经酰胺、鞘氨醇、1-磷酸鞘氨醇水平通过动态平衡维持细胞的正常生理功能。与对照组细胞相比,肿瘤细胞的鞘氨醇含量显著增加,提示在肿瘤细胞中神经酰胺、鞘氨醇、1-磷酸鞘氨醇的动态平衡被打破,这可能是由于鞘氨醇激酶途径被异常激活。鞘氨醇激酶途径的异常激活与肿瘤的发生和发展具有密切关系[17]。
在肿瘤细胞的非极性代谢物层,多种卵磷脂和缩醛磷脂含量有不同程度的上调,Cer d42:2以及多种鞘磷脂水平明显下调,提示肿瘤细胞磷脂代谢通路发生紊乱。卵磷脂水平增高可能是由于肿瘤细胞能通过胞苷二磷酸胆碱途径合成高含量不饱和脂肪酸的卵磷脂。缩醛磷脂是存在于哺乳动物组织内含烯醚键的甘油磷脂,据文献[18]报道,在肿瘤组织中缩醛磷脂水平增高,其原因可能与多种参与合成或降解缩醛磷脂的酶活性改变相关,包括磷酸二羟丙酮脂酰转酶、磷脂酰胞苷转移酶、磷脂酶A2、磷脂酶C、磷脂酶D。鞘磷脂主要存在于细胞膜、脂蛋白和其他富含脂类的组织结构上,鞘磷脂在鞘磷脂酶的作用下水解生成神经酰胺。神经酰胺是细胞凋亡过程中常见的第二信使分子,据文献报道,神经酰胺能诱导多种肿瘤细胞的凋亡,如U937和JB6肿瘤细胞等[19,20]。

表1 肺癌细胞与正常细胞的极性代谢差异物鉴定结果Table 1 Summary of the differential polar metabolites between lung tumor cell lines and normal cell line
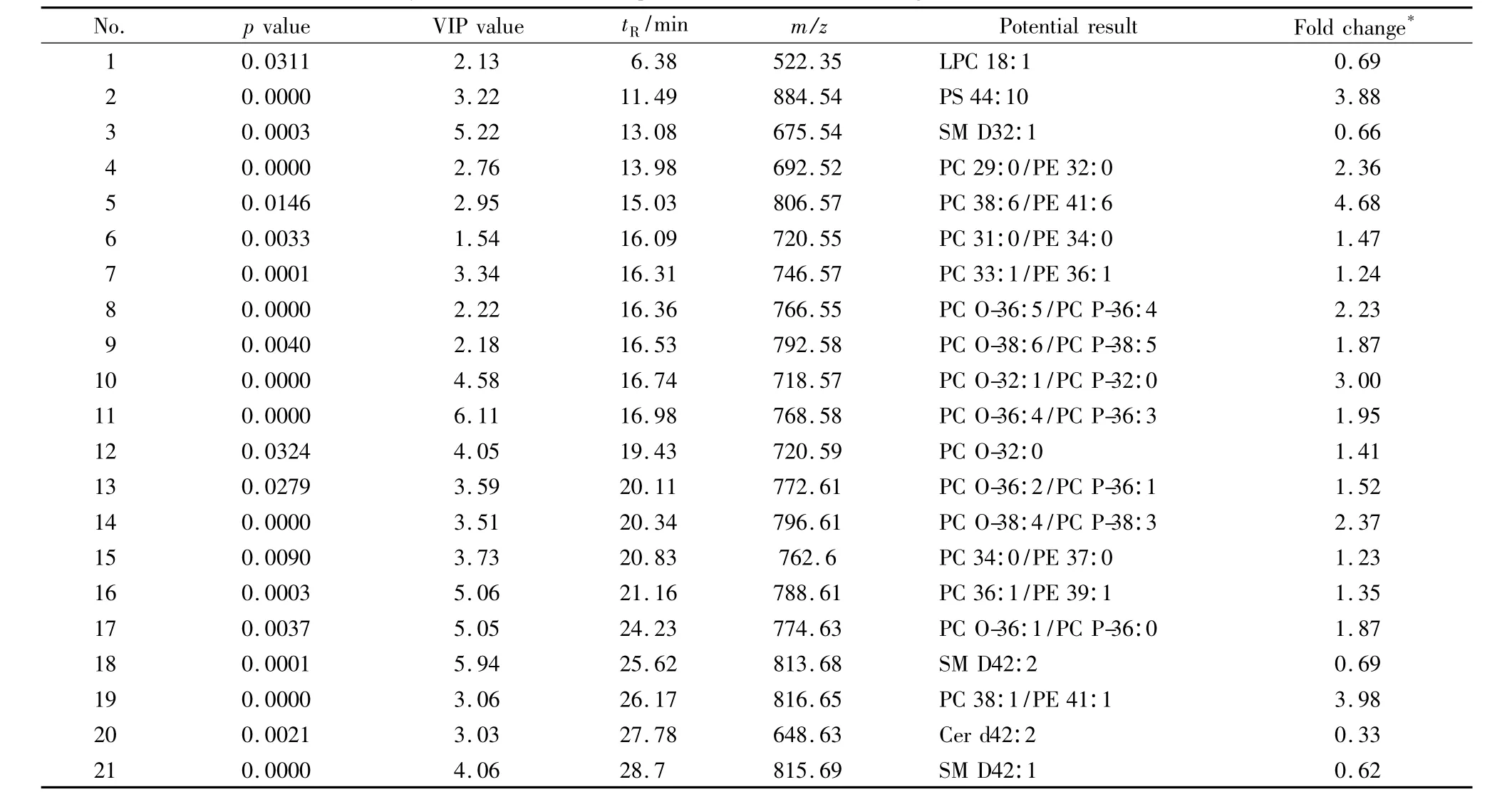
表2 肺癌细胞与正常细胞的非极性代谢差异物鉴定结果Table 2 Summary of the differential non-polar metabolites between lung tumor cell lines and normal cell line
实验中还发现,与对照组细胞相比,肿瘤细胞LPC 18:1含量下调,这与许多癌症代谢组学的文献[21-23]报道一致。LPC在血液中主要受溶血磷脂酰胆碱转移酶与磷脂酶调控,有研究表明,在直肠癌患者体内溶血磷脂酰胆碱转移酶被过度表达;另外,癌症患者磷脂酶活性增高均可能导致LPC降低。
3 结论
本文提出了一种同时提取细胞极性与非极性代谢产物的方法,并采用HPLC-MS技术对7种人肺癌细胞 H358、A549、HCC827、H1299、Calu-3、Calu-1、PC-9及人正常胚肺成纤维细胞MRC-5进行分析,获得了8种细胞的代谢物图谱,结合多元统计分析手段研究了肿瘤细胞与正常细胞的图谱变化情况,结果表明,肿瘤细胞与正常细胞的代谢物谱图有显著变化。通过对一些具有显著性差异的物质进行初步鉴定,得到了10种极性代谢差异物与21种非极性代谢差异物。与正常细胞相比,肿瘤细胞在蛋白质代谢、脂肪酸代谢、磷脂代谢方面发生不同程度的紊乱,与现有文献报道情况基本相符,证明通过细胞代谢物的差异表达来寻找潜在疾病标志物是一种极有前景的手段,与传统的以病人血液、尿液为样本的代谢组学研究相互佐证与补充。进一步还可以动物模型和组织为样本,采用本文的方法对极性代谢差异物和非极性代谢差异物进行分析和验证,以期为研究癌症疾病机制、筛查或治疗提供一种新的有效平台。
[1]Mulshine J L,Sullivan D C.N Engl J Med,2005,352:2714
[2]Yang D C,Yang S Y.Chin J Tuberc Respir Dis(杨德昌,杨拴盈.中华结核和呼吸杂志),2004,27(1):18
[3]Zhu J F,Sun Y W,Feng Y.Medical Recapitulate(祝晋芳,孙月雯,冯源.医学综述),2010,16(7):1015
[4]Huang Q,Yin P Y,Lu X,et al.Chinese Journal of Chromatography(黄强,尹沛源,路鑫,等.色谱),2009,27(5):566
[5]Griffin J L,Pole J C,Nicholson J K,et al.Biochim Biophys Acta,2003,1619(2):151
[6]Abate-Shen C,Shen M M.Nature,2009,457:799
[7]Sheikh K D,Khanna S,Byers S W,et al.J Biomolecular Techniques,2011,22:1
[8]Gao X,Zhang Q,Meng D,et al.Anal Bioanal Chem,2012,402:2923
[9]Hori S,Nishiumi S,Kobayashi K,et al.Lung Cancer,2011,74(2):284
[10]Sana T R,Waddell K,Fischer S M.J Chromatogr B,2008,871:314
[11]Lorenz M A,Burant C F,Kennedy R T.Anal Chem,2011,83:3406
[12]Li H,Yu Z G,Zu X Y,et al.Chinese Journal of Chromatography(栗晖,于治国,祖旭宇,等.色谱),2009,27(4):387
[13]Yang Q,Shi X Z,Wang Y A,et al.J Sep Sci,2010,33:1495
[14]An Z L,Chen Y H,Zhang R P,et al.J Proteome Res,2010,9:4071
[15]Yang J,Lu Y J,Tan H R.Journal of Clinical Pulmonary Medicine(杨进,陆友金,檀华容.临床肺科杂志),2007,12(5):429
[16]Hu S L,Wang W D,Xu W P,et al.Chinese Journal of Clinical Healthcare(胡世莲,王卫东,徐维平,等.中国临床保健杂志),2004,7(3):164
[17]Li Q F,Wu Z Z.Chinese Journal of Practical Internal Medicine(李庆芳,吴祖泽.中国实用内科杂志),2006,26(6):401
[18]Street J C,Koutcher J A.Lipids,1997,32(1):45
[19]Davis M A,Flaws J A,Young M,et al.Toxicol Sci,2000,53:48
[20]Sweeney E A,Sakakura C,Shirahama T,et al.Int J Cancer,1996,66:358
[21]Chen J,Wang W,Lv S,et al.Anal Chim Acta,2009,650(1):3
[22]Taylor L A,Arends J,Hodina A K,et al.Lipids Health Dis,2007,6:17
[23]Mansilla F,Costa K A,Wang S,et al.J Mol Med,2009,87:85
