梨采后病害拮抗菌的分离与筛选
2013-10-22张晓宇张则君韩巨才
张晓宇,张则君,韩巨才
(1.山西省农业科学院农产品贮藏保鲜研究所,山西太原030031;2.山西农业大学农学院,山西太谷030801)
梨采后贮藏期和货架期易被病害侵染,果肉易软化腐烂,对贮藏保鲜造成很大困难,给果农造成极大的经济损失。随着社会的发展,人们对果蔬质量的要求不断提高,环保意识不断加强,迫切需要新的安全有效的方法来控制果蔬的采后病害。由于生物抑菌剂防病效果明显、无毒,且成本低,成为果蔬保鲜的重要发展方向,也是减少化学药剂使用量的有效途径[1]。
对梨采后病害的拮抗菌研究始于20世纪80年代,Chand 等[2]和 Sugar等[3]分别发现了 Cryptococcus albidus和Cryptococcus infirmominiatus,用于抑制青霉菌(Penicillium expansum);Janisiewicz等[4]和 Lima等[5]分别发现了Pseudomonas syringae和Rhodotorula glutinis,用于抑制灰葡萄孢菌(Botrytis cinerea);谢莉[6]和齐冬梅等[7]分别发现了Streptomyces aureus和Bacillus subtilis,用于抑制链格孢菌(Alternaria alternata)。用于生物防治的拮抗菌涵盖了细菌、酵母菌和放线菌,充分说明生防菌具有巨大的发展潜力。
本试验从各种水果和叶片表面进行拮抗菌的分离,筛选出对梨采后致病菌有拮抗作用的细菌,旨在为探索新的梨采后病害防治途径提供一定理论指导。
1 材料和方法
1.1 供试材料
1.1.1 梨、杏、西梅、黑李、冬枣、葡萄、山楂、桃无病虫害及机械损伤的果实和叶片 梨采自山西省清徐县高花乡高花村,杏采自山西省大同市阳高县,西梅、黑李、桃均采自山西省太原市金滩村,山楂分别采自山西省太原市金滩村和山西省太谷县,冬枣采自山东省沾化县,葡萄采自山西省清徐县。试材于2011年8—9月采回,当天运回实验室,装袋后存放于冰箱。
1.1.2 供试病原菌 梨链格孢菌(Alternaria alternata)、梨镰刀菌(Fusarlum poae)、梨毛霉菌(Mucoraceae racemosus)均由山西省农业科学院农产品贮藏保鲜研究所采后病理研究室分离保存。将病原菌在PDA培养基上28℃培养7~14 d,用无菌水制成孢子悬浮液,血球计数板计配浓度为1×104个孢子/mL。
1.1.3 培养基 牛肉膏蛋白胨(NA)培养基:牛肉膏为 5 g,蛋白胨为10 g,NaCl为 5 g,琼脂粉为10 g,水1 000 mL,pH值7.2;酵母膏蛋白胨(LA)培养基:酵母膏 5 g,蛋白胨 10 g,NaCl 5 g,琼脂粉 10 g,水1 000 mL,pH 值 7.4;马铃薯(PDA)培养基:马铃薯(去皮)200 g,葡萄糖 20 g,琼脂 10 g,水 1 000 mL,pH值为6.5~7.0。
1.2 拮抗菌的分离
分别取梨、梨叶、杏、杏叶、西梅、黑李、冬枣、葡萄、葡萄叶、山楂、山楂叶、桃、桃叶放入烧杯中,使用0.05 mL/L的磷酸缓冲液(pH值为6.5)冲洗2次,第1次在摇床100 r/min旋转振荡器中洗涤10 min,保留洗液;第2次用超声冲洗10 min,保留洗液。
取无病无伤、大小和成熟度相似的梨果,用2%的次氯酸钠溶液表面消毒后,自然晾干。在梨果上用接种针挖3 mm×3 mm的孔,每个孔注入2次的洗液各20 μL,待晾干后再注入病原菌孢子悬浮液20 μL(1×104个孢子 /mL)。晾干后将梨果装入塑料筐内,套保鲜袋,扎口,保持湿度在95%左右,室温下7 d后检查。选取未发病,且伤口处长有拮抗菌菌落形态的梨果,用无菌接种针刮取菌落表层,在研钵中研碎。用0.05 mL/L的磷酸缓冲液(pH值为6.5)定容4 mL,分别稀释10倍和100倍。分别取此稀释后的悬浮液各100 mL,用涂布器分别涂在NA,LA培养基上。培养48 h后,把具有不同形态特征的单一菌落分别在NA,LA培养基平皿上划线,挑取纯化后的单菌落,用小试管斜面保存备用。
1.3 拮抗菌的筛选
采用平板对峙培养法[8],处理用直径1 cm的打孔器取病原菌菌块放于PDA平板中央,在距其2.5 cm的地方用无菌接种针各沾一环单菌落划一条线,同时以不划线直接病原菌菌块为对照,每个处理重复3次。培养4~6 d后,观察不同菌株是否对病原菌有抑制生长的作用及测量抑菌圈的大小。按照抑菌半径的大小,将拮抗菌的拮抗作用分为强、中、弱3类。
2 结果与分析
结果表明,从梨果表面共获得细菌分离物89株,再经过筛选试验得到以下结果。
2.1 拮抗细菌对植物病原真菌的抑制作用
以梨链格孢菌(Alternaria alternata)、梨镰刀菌(Fusarlum poae)、梨毛霉菌(Mucoraceae racemosus)为靶标菌,用平板对峙培养法测试了89株菌对病原真菌的拮抗作用,结果表明,有5株细菌菌株对3种病原真菌均具有较强的拮抗作用,占筛选到菌株总数的5.6%。
从表1可以看出,拮抗细菌菌株可以分为3类:HM3和XM2除菌落大小不同外,具有相似的菌落形态特征;XY1区别于其他菌株的最大特点是其呈黄绿色透明状;HJL6和L4具有相似的菌落形态特征。

表1 拮抗细菌菌落的形态特征
2.2 细菌对梨链格孢菌的抑制作用
通过对89株细菌菌株进行生长对峙试验,结果发现,有10株菌对梨链格孢菌的生长有抑制作用,占到菌株总数的11.2%;对梨链格孢菌有较强抑菌作用的菌株是 HM3,HM2,XM2,XY1,TYSZ6,PT4;对梨链格孢菌抑菌作用较弱的菌株是HJL6,HJL4,L4,DZ2;其余菌株对梨链格孢菌无拮抗作用。其中,HM3和HM2的抑菌效果最为明显,其抑菌率达到95%以上(表2)。

表2 细菌对梨链格孢菌的抑制效果
2.3 细菌对梨镰刀菌的抑制作用
通过对89株细菌菌株进行生长对峙试验,结果发现,有15个菌对梨镰刀菌的生长有抑制作用,占菌株总数的16.9%,其中,有较强抑菌作用的菌株 是 HJL6,L4,HM3,HM2,XY1,DZ2,TYSZ6,PT4,SL2,抑菌作用较弱的菌株是 XM2,HJL4,HJL5,XM1,HM4,DZ1,其余菌株无拮抗作用。其中,HJL6,HM2和XY1的抑菌效果最为明显,其抑菌率达到95%以上(表3)。
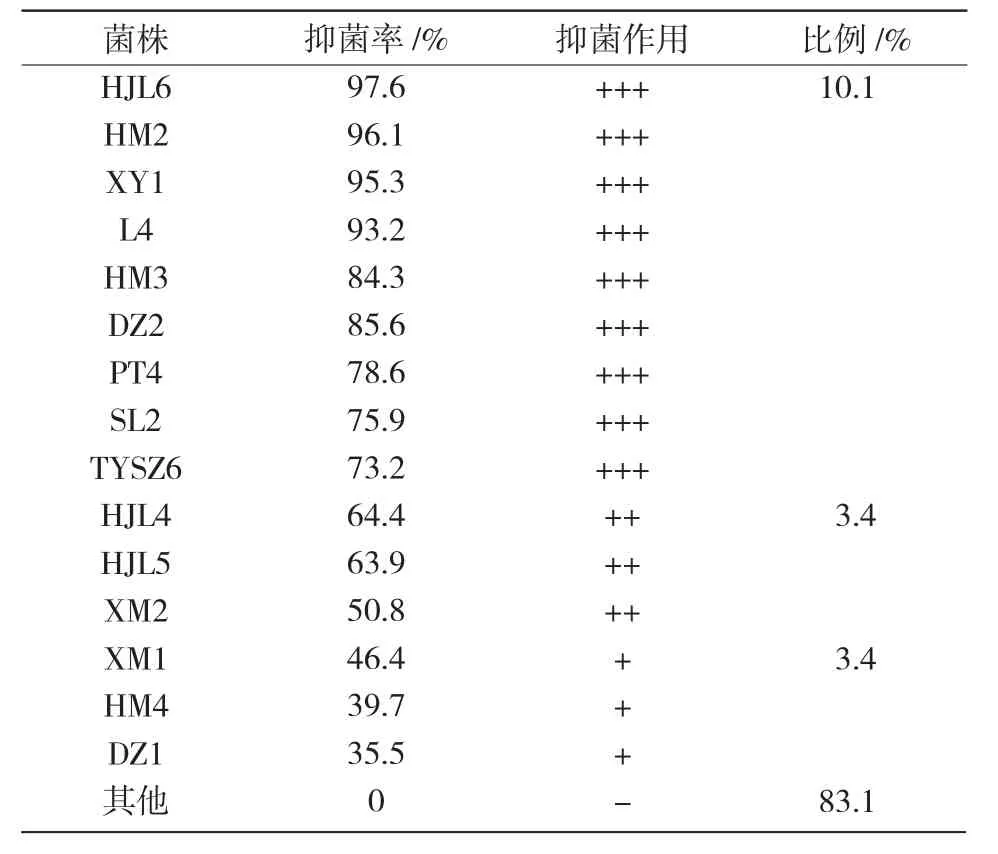
表3 细菌对梨镰刀菌的抑制效果
2.4 细菌对梨毛霉菌的抑制作用
通过对89株细菌菌株进行生长对峙试验,结果发现,有11个菌株对梨毛霉菌的生长有抑制作用,占菌株总数的12.4%,有较强抑菌作用的菌株是 HJL4,XM2,HM3,L4,XY1,TYSZ6,抑菌作用较弱的菌株是 XM1,SZY3,TYSZ7,TGSZ2,TY3,其余菌株无拮抗作用。其中,HJL4和XM2的抑菌效果最为明显,其抑菌率达到95%以上(表4)。

表4 细菌对梨毛霉菌的抑制效果
3 结论与讨论
根据本试验筛选的有拮抗作用的细菌形态特征初步推知,拮抗细菌的菌落形态各异,拮抗能力与菌落形态并不存在必然联系。另外,大量的研究表明[9-13],离体(in vitro)条件下和活体(in vivo)条件下的拮抗能力不一定一致,不存在相关性,不能根据一个方面的抗病能力就淘汰或肯定一株细菌。
本试验得到的HM3和XY1这2株细菌对梨链格孢菌(Alternaria alternata)、梨镰刀菌(Fusarlum poae)、梨毛霉菌(Mucoraceae racemosus)3 种致病菌均有显著抑菌效果,还有待于对其进行生理生化和分子生物学鉴定,并对其进行抑菌谱的测定,以便为梨采后病害生物防治提供理论依据。
[1]范青,田世平,徐勇,等.季也蒙假丝酵母对采后桃果实软腐病的抑制效果[J].植物学报,2000,42(10):1033-1038.
[2]Chand-Goyal T,Spotts R A.Control of postharvest pear diseases using natural saprophytic yeast colonists and their combination with a low dosage of thiabendazole[J].Postharvest Biol Technol,1996,7:51-64.
[3]Sugar D,Spotts R A.Control of postharvest decay in pear by four laboratory-grown yeasts and tworegistered biocontrol products[J].Plant Dis,1999,83:155-158.
[4]Janisiewicz W J,Marchi A.Control of storage rots on various pear cultivars with a saprophytic strain of Pseudomonas syringe[J].Plant Dis,1992,76:555-560.
[5]Lima G,De-Curtis F,Castoria R,et al.Activity of the yeast Cryptoccus laurentii and Rhodotorula glutinis against postharvest rots on different fruits[J].Biocontrol Science and Technology,1998,8:257-267.
[6]谢莉.梨黑斑病拮抗放线菌的选育及其抗菌物质研究[D].石家庄:河北师范大学,2008.
[7]齐东梅,惠明,梁启美,等.枯草芽孢杆菌H110对苹果梨采后青霉病和黑斑病的抑制效果[J].应用与环境生物学报,2005,11(2):171-174.
[8]李丽霞,夏明聪,孔景萍.拮抗菌对土传病害防治效果的初步研究[J].河南农业科学,2007(3):54-55.
[9]范青.果实采后病害生物防治及其机理研究[D].北京:中国科学院植物研究所,2001.
[10]Anisiewicz W J,Tworkoski T J,Sharer C.Characterizing the mechanism of biological control of postharvest diseases on fruits with a simple method to study competition for nutrients[J].Phytopathology,2000,90(11):1196-1200.
[11]高芬,马利平,乔雄梧.对番茄早疫病拮抗菌的筛选[J].山西农业科学,2001,29(3):64-66.
[12]程根武,王勇,杨秀荣,等.拮抗酵母菌用于产后病害生物防治的研究进展[J].天津农业科学,2002,8(1):44-46.
[13]马利平,乔雄梧,高芬,等.B96-11对3种枯萎病的防治效果及拮抗物质初步分析[J].华北农学报,2006,21(4):99-102.
