高尿酸血症/痛风与非酒精性脂肪肝严重程度的相关研究
2013-10-22郭彩云聂秀玲孙丽荣
郭彩云,聂秀玲,孙丽荣,杨 洋
(天津医科大学代谢病医院糖尿病痛风科,天津300070)
非酒精性脂肪性肝病(NAFLD)是指除外过量饮酒和其他明确的损肝因素所指的肝细胞内脂肪沉积,包括从单纯的肝脂肪变性到非酒精性脂肪性肝炎(NASH),以致一部分最终发展为肝硬化,甚至演变为肝细胞癌[1]。在发达国家中,NAFLD的患病率已达20%~30%,并且有数据显示,其患病率呈逐渐增加趋势[2]。近年来,越来越多证据表明尿酸在肝脏脂肪变性中起到一定作用。无论在横向还是纵向研究中,血尿酸(SUA)的升高会引起NAFLD的患病率增加[3]。本研究旨在探讨高尿酸血症及痛风患者NAFLD的患病率及其严重程度,为将来干预治疗提供一种潜在的新治疗依据。
1 对象与方法
1.1 对象 从2012-2013年天津医科大学代谢病医院住院及门诊病人中随机选取无症状高尿酸血症患者77例(3组),痛风患者86例(2组),对照组86例为同期健康体检者(1组)。NAFLD诊断符合2010年中华医学会内分泌学分会“非酒精性脂肪性肝病与相关代谢紊乱诊疗共识”诊断标准[1]。高尿酸血症:男性及绝经后女性>420μmol/L,绝经前女性>350μmol/L。
1.2 方法 有专门的医师询问病史,测定身高、体质量、腰围、臀围、血压,空腹采血测空腹血糖(FPG)、空腹胰岛素(FINS)、糖化血红蛋白(HbA1c)、血脂和肝肾功能相关检查,同时进行腹部B超检查。体质指数(BMI)=体质量(kg)/身高平方(m2);胰岛素抵抗指数(HOMA-IR)=FPG×FINS/22.5;肾小球滤过率(eGFR)=186.3×(S Cr/88.4)-1.154×年龄-0.203×1.233×0.742(女性);MAP=(收缩压+2×舒张压)/3。
1.3 统计学分析 应用SPSS17.0统计软件进行统计学处理,计量资料以x±s表示,计量资料比较采用单因素方差分析,两两比较采用LSD法,计数资料组间率比较采用χ2检验,NAFLD主要危险因素筛查采用二分类非条件Logistic回归分析;P<0.05有统计学意义。
2 结果
2.1 3组的一般临床资料比较 痛风及高尿酸血症 组 SUA、ALT、Scr、TG、LDL、BMI、 腰 围 、MAP、FPG、FINS、HOMA-IR、HbA1c 显著高于正常组,而HDL、eGFR显著低于正常组;痛风组GGT、BUN显著高于正常组,差异有统计学意义(P<0.05)。结果见表1。
2.2 3组间NAFLD严重程度比较 对照组NAFLD总检出率及轻、中、重度脂肪肝检出率分别为23.3%、17.4%、4.7%、1.2%;痛风组NAFLD总检出率及轻、中、重度脂肪肝检出率分别为45.3%、26.7%、17.4%、1.2%;高尿酸血症组NAFLD总检出率及轻、中、重度脂肪肝检出率分别为35.1%、27.3%、6.5%、1.3%。痛风组及高尿酸血症组NAFLD总检出率及轻、中度脂肪肝检出率均显著高于对照组,差异有统计学意义(P<0.05)。见表2
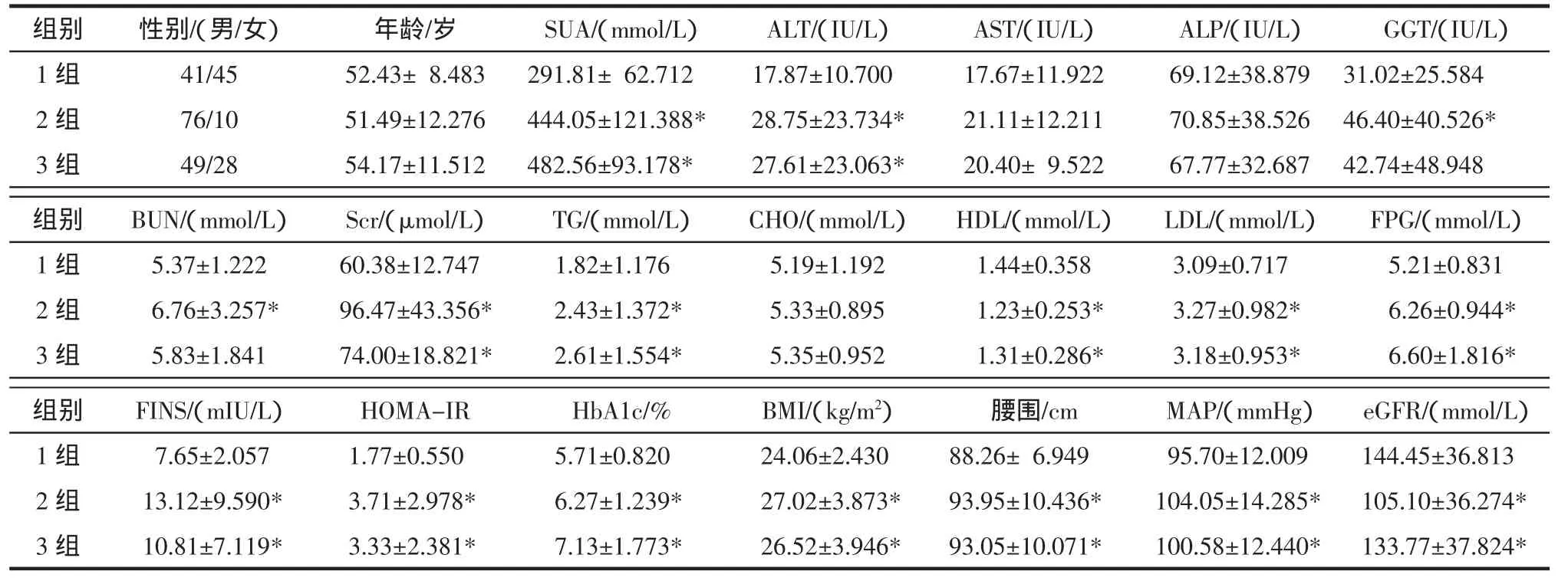
表1 3组间的一般临床资料比较Tab1 Characteristicsof the threegroups
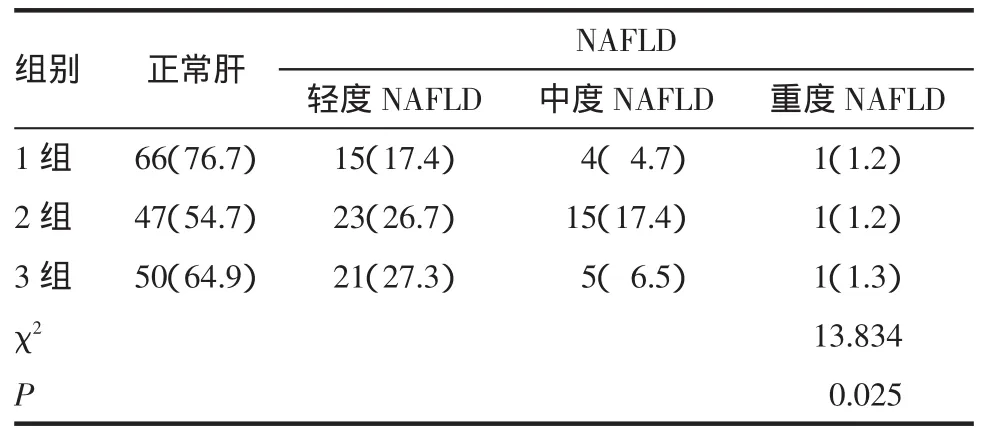
表2 3组间NAFLD严重程度构成比[n(%)]Tab2 TheproportionofNAFLD severity in thethreegroups[n(%)]
2.3 NAFLD危险因素的分析 以是否患有NAFLD为因变量,其他变量为自变量,进行Logistic回归分析,变量入选水准0.05,进入方程的依次为SUA、TG、BMI(OR值分别为1.004、1.394和1.213)。
3 讨论
目前已有不少研究证实血尿酸水平与NAFLD之间存在密切关系[4]。众所周知,有多种途径可影响血尿酸水平,例如饮食、肾功能、甚至胰岛素抵抗本身[5]。调查显示非酒精性脂肪肝患者一般有果糖摄入过量史,或者是有血尿酸升高的历史[6]。受生活方式和饮食因素影响,如肉类与果糖的摄入情况可以影响血尿酸水平[7],也与NAFLD的发病机制相关[8]。
本研究显示,痛风组及高尿酸血症组具有以下特点:肥胖、TG增高、血压增高、糖代谢紊乱、高胰岛素血症。这与既往研究结果相一致,即血尿酸水平与NAFLD之间存在密切关系,与胰岛素抵抗及代谢综合征的其他组分独立相关[9]。在代谢综合征中,氧化应激可以导致高尿酸血症[10]。在胞外环境中,血尿酸有抗氧化和抗辐射作用,这样,就使它对抗疾病的保护作用提高了[11]。然而,许多研究表明,当血尿酸通过特殊载体进入细胞后,起到了促进炎症的作用。在细胞内,血尿酸促进氧化作用导致了炎症因子和生长因子的释放[12]。在脂肪细胞内,尿酸通过增加单核细胞趋化蛋白1和降低脂联素放大了氧化应激作用。在平滑肌细胞内,尿酸通过促蛋白激酶和cox-2可刺激MCP-1的产生。除此之外,血尿酸可导致脂蛋白氧化和炎症[13],二者在NAFLD的发生和发展中起了重要作用。有初步证据表明了在NAFLD的动物模型中,降尿酸治疗能够改善肝脏脂肪变性的程度[14]。本研究应用Logistic回归进一步分析发现,SUA、BMI、TG是NAFLD的危险因素,OR 值分别为 1.004、1.213 和 1.394。提示 SUA、BMI、TG可能是NAFLD病情进展的独立危险因素。
本研究结果显示痛风组及高尿酸血症组NAFLD总检出率及轻、中度脂肪肝检出率均显著高于对照组,ALT水平亦明显升高,差异有统计学意义,提示痛风及高尿酸血症组肝脏损伤明显高于正常对照组。据报道高尿酸血症可以预测NAFLD组织病变的严重程度(主要是肝脏脂肪变性与炎症反应)[15]。从Polistena项目(涉及61名非酒精性脂肪肝活检患者)的初步数据可以得知重度肝纤维化患者血尿酸水平较轻度肝纤维化患者血尿酸水平明显升高[16]。血尿酸的升高会引起非酒精性脂肪肝的患病率增加,且与非酒精性脂肪肝患者的组织性肝损伤有关[15]。NAFLD组织学严重程度已经证实与超声诊断的NAFLD的严重程度相关,有关NAFLD的定量评估的一些生化指标与NAFLD严重程度相关[17]。
总之,本研究结果显示痛风组及高尿酸血症组NAFLD患病率明显升高,程度亦明显加重,与SUA、TG、BMI独立相关。未来需要进一步地研究以探讨血尿酸与NAFLD之间的联系机制,评估通过特定的饮食及药理作用降低血尿酸水平是否对NAFLD患者获益。
[1]中华医学会内分泌学分会肝病与代谢学组.中华医学会内分泌学分会“非酒精性脂肪性肝病与相关代谢紊乱诊疗共识”[J].中华内分泌代谢杂志,2010,26(7):531
[2]Neuschwander-TetriBA,CaldwellSH.Nonalcoholic steatohepatitis:summary ofan AASLDSingle Topic Conference[J].Hepatology,2003,37(5):1202
[3]K uoCF,Yu KH,Luo SF,etal.Goutand risk ofnonalcoholic fatty liver disease[J].Scand JRheumatol,2010,39(6):466
[4]Lee Y J,Lee H R,Lee JH,etal.Association between serum uric acid and non-alcoholic fatty liver disease in Korean adults[J].Clin Chem Lab Med,2010,48(2):175
[5]J ohnson R J,Kang D H,Feig D,etal.Is there a pathogenetic role for uric acid in hypertension and cardiovascular and renal disease[J].Hypertension,2003,41(6):1183
[6]A bdelmalek M F,Lazo M,Horska A,etal.Higher dietary fructose is associated with impaired hepatic adenosine triphosphate homeostasis in obese individuals with type 2 diabetes[J].Hepatology,2012,56(3):952
[7]L anaspaM A,Tapia E,Soto V,etal.Uric acid and fructose:potentialbiologicalmechanisms[J].Semin Nephrol,2011,31(5):426
[8]L im JS,Mietus-SnyderM,Valente A,etal.The role of fructose in the pathogenesis of NAFLD and the metabolic syndrome[J].Nat RevGastroenterolHepatol,2010,7(5):251
[9]Marangella M.Uric acid elimination in the urine.Pathophysiological implications[J].Contrib Nephrol,2005,147:132
[10]W aringW S,Webb D J,Maxwell SR.Systemic uric acid administration increases serum antioxidant capacity in healthy volunteers[J].JCardiovasc Pharmacol,2001,38(3):365
[11]Am es BN,CathcartR,Schwiers E,etal.Uric acid providesan antioxidant defense in humansagainstoxidant-and radical-caused agingand cancer:ahypothesis[J].Proc Natl Acad SciU SA,1981,78(11):6858
[12]Ka ng D H,Han L,Ouyang X,etal.Uric acid causes vascular smoothmuscle cell proliferation by entering cells via a functional urate transporter[J].Am JNephrol,2005,25(5):425
[13]B aldwinW,McRae S,Marek G,etal.Hyperuricemiaasamediator of the proinflammatory endocrine imbalance in the adipose tissue in amurinemodel of themetabolic syndrome[J].Diabetes,2011,60(4):1258
[14]X u CF,Yu CH,Xu L,etal.Hypouricemic therapy:a novel potential therapeutic option for nonalcoholic fatty liver disease[J].Hepatology,2010,52(5):1865
[15]P etta S,Camma C,Cabibi D,etal.Hyperuricemia is associated with histological liver damage in patientswith non-alcoholic fatty liver disease[J].AlimentPharmacol Ther,2011,34(7):757
[16]L oria P,Lonardo A,CarulliN.Relative contribution of iron burden,HFEmutations,and insulin resistance to fibrosis in nonalcoholic fatty liver[J].Hepatology,2004,39(6):1748
[17]H amaguchiM,Kojima T,Itoh Y,etal.The severity of ultrasonographic findings in nonalcoholic fatty liver disease reflects the metabolic syndromeand visceral fataccumulation[J].Am JGastroenterol,2007,102(12):2708
