氯系消毒剂杀灭饮用水中隐孢子虫试验研究
2013-10-21刘丽娜崔崇威孙兴滨
刘丽娜,张 鑫,崔崇威,孙兴滨
(1.黑龙江工程学院 土木与建筑工程学院,哈尔滨 150050;2.哈尔滨工业大学 市政环境工程学院,哈尔滨 150090;3.东北林业大学 环境科学系,哈尔滨 150040)
隐孢子虫是一种寄生性致病原生动物,具有广泛的脊椎动物宿主,目前已从哺乳类、鸟类、爬行类和鱼类等多种脊椎动物体内分离出20 多种隐孢子虫,其中至少有5个种的隐孢子虫被鉴定可以感染人类[1].隐孢子虫宿主可排放出大量具有感染性的卵囊,污染废水、地表水和地下水[2-3].如果饮用水处理不充分或者饮用水供水系统被隐孢子虫污染,饮用水中的隐孢子虫就会对人类造成严重威胁,特别是对于免疫功能缺陷者如婴儿、老人及艾滋病患者等,被感染后会引起腹泻,甚至危及生命[4].近年来,水源性隐孢子虫病不断爆发,水中隐孢子虫的污染及其灭活问题备受关注[5-6].据美国疾病控制预防中心估计,每年约有250 万人感染隐孢子虫病[7].我国于1987年在南京首次发现了人隐孢子虫病病例,随后在江苏、安徽、重庆、内蒙古、福建、山东和湖南等省市都有相关病例报道[8].2006年,我国颁布了新的《生活饮用水卫生标准》(GB5749-2006),在非常规检测项目中增加了隐孢子虫等4 项微生物学指标.本实验研究使用氯系消毒剂(Cl2,ClO2)对饮用水中隐孢子虫进行灭活,探讨氯系消毒剂的投加量、反应时间、浊度、pH值和温度等影响因素对隐孢子虫灭活效果的影响.
1 实验方法
1.1 材料
Cl2:启普发生器制备,多参数水质分析仪(Merck NOVE 60)测定质量浓度.
ClO2:自制,纯度在99.5%以上.棕色瓶低温密封,避光保存.实验时准确标定并稀释至所需质量浓度.
隐孢子虫:采于患病猴,经过筛、硫酸锌漂浮和蔗糖梯度离心等步骤,得到浓度为1.0×107个/mL 隐孢子虫样品.
试剂:4,6-二脒基-2-苯基-吲哚(DAPI,Sigma),普匹碘胺(PI,Sigma USA),HBSS 平衡盐溶液(Sigma USA).
1.2 荧光活体染色
取0.5 mL PBS(磷酸缓冲溶液)保存样品,加入1 mL HBSS 平衡盐溶液漂洗2 次;沉淀于160 μL HBSS 平衡盐溶液中,加入20 μL DAPI,20 μL PI 储备液,37 ℃温浴1 h;温浴后加入1 mL HBSS清洗3 次,洗去未染上颜色的DAPI和PI;涂片,荧光显微镜下镜检,各样品分别取200个孢囊镜检.
1.3 实验方法
将氯系消毒剂(Cl2,ClO2)分别通入棕色瓶,内装有1 L 0.01 mol/L 的磷酸钠缓冲液.调节pH值.取若干支10 mL 比色管,分别加入稀释后不同质量浓度的消毒剂缓冲溶液,迅速投加3×105个/mL隐孢子虫悬浮液,摇床转速为100 r/min,避光反应.检测消毒剂对隐孢子虫的灭活效果,找出最佳投量和作用时间.并探讨消毒剂在最佳灭活条件下不同浊度、pH值和温度对灭活效果的影响.
2 Cl2灭活隐孢子虫的实验研究
2.1 Cl2投量和反应时间对隐孢子虫灭活率的影响
在Cl2质量浓度为10.4、8.4、6.5、3.0、1.6、0.8 mg/L 溶液中,各加入1×106个/mL 隐孢子虫悬浮液,反应温度为20 ℃,pH 7.0,ntu 1.0,避光反应.检测在不同质量浓度、不同反应时间条件下,Cl2对隐孢子虫的灭活效果.如图1所示.为使饮用水中余氯达到小于0.3 mg/L 的《生活饮用水卫生标准》(GB5749-2006),当反应时间超过360 min 时,6.5 mg/L 溶液中隐孢子虫灭活率超过99%,灭活效果明显.如果降低Cl2质量浓度,作用时间必须相应增加,方可达到预期灭活效果.
Cl2通入水中,可立即分解成HCl和HOCl,HOCl 体积小,穿透力强,可快速穿透微生物的细胞而进入生物体内,破坏生物体的酶系统,使其丧失活力而死亡.另外,HOCl 不稳定,可释放出新生态氧,新生态氧可氧化水中的有机物质和某些无机物质,从而抑制了微生物的生长.

图1 Cl2投量和反应时间对灭活率的影响
2.2 浊度对Cl2灭活隐孢子虫效果的影响
由于天然水体中存在着各种悬浮物及胶体物质,增加了水体的浑浊程度,Falabi 等研究表明[9],隐孢子虫的去除与水体的浑浊程度有显著关系.
在pH值为7.0,Cl2投量为6.5mg/L,反应时间分别为240、360 及540 min 时,控制浊度分别为0.2、0.5、1.0、5.0 及10.0 ntu,检测Cl2对隐孢子虫的灭活效果.如图2所示.反应时间为240 min,浊度为10.0 ntu,对应的灭活率为89.1%,浊度越高,Cl2对隐孢子虫灭活率越低,时间超过540 min时,灭活率均大于99%.
浊度可增加对隐孢子虫的吸附作用,从而阻碍消毒剂的消毒效果,影响灭活率[10].由于《生活饮用水卫生标准》(GB5479-2006)要求,出厂水浊度不超过1.0 ntu,所以实际工程中,为保证隐孢子虫的灭活,Cl2投量为6.5 mg/L,作用时间大于540 min.
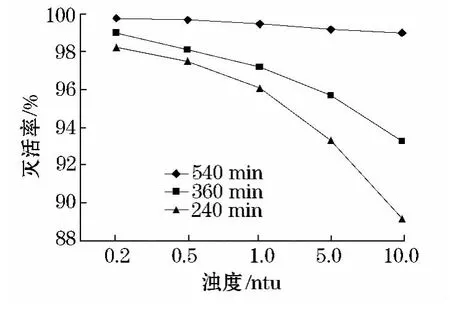
图2 浊度对灭活率的影响
2.3 pH值对Cl2灭活隐孢子虫效果的影响
在pH值分别为6.0、6.5、7.0、8.0、9.0,Cl2投量为6.5 mg/L,作用时间240、360、540 min,浊度为1.0 ntu 时,检测Cl2对隐孢子虫的灭活效果.如图3所示pH值波动对灭活率影响不大,作用时间大于540 min 后,实验中隐孢子虫灭活率均大于99%,灭活效果理想.
在酸性条件下,Cl2对隐孢子虫的灭活效果好于碱性条件.分析原因,Cl2通入水中,可立即分解成HCl和HOCl,酸性条件下,HOCl 不再分解,对消毒杀菌起着主要作用.而碱性条件下,大部分HOCl电离成H+和OCl-,OCl-的杀菌能力远低于HOCl.

图3 pH值对灭活率的影响
2.4 温度对Cl2灭活隐孢子虫效果的影响
在pH值为7.0,浊度为1.0 ntu,氯气投量为6.5 mg/L,温度分别为10、15、20、25、30 ℃时,检测Cl2对隐孢子虫的灭活效果.如图4所示.当作用时间为360 min 时,反应温度范围内,灭活率从95.6%上升为99.2%,灭活率与温度正相关,当时间超过480 min 后,灭活率均大于99%.
隐孢子虫在低温时,处于休眠状态,Cl2不易对其灭活,然而在较高温度时(大于20 ℃),隐孢子虫的活性增强,Cl2对其有一定的灭活作用,从而提高了灭活效果.

图4 温度对灭活率的影响
3 ClO2灭活隐孢子虫的实验研究
3.1 ClO2投量和反应时间对隐孢子虫灭活率的影响
在ClO2质量浓度为0.5、1.5、3.0、5.5、7.0、9.0 mg/L 溶液中,各加入1×106个/mL 隐孢子虫悬浮液,反应温度为20 ℃,pH值为7.0,浊度为1.0 ntu,避光反应,检测在不同质量浓度、不同反应时间条件下,ClO2对隐孢子虫的灭活效果.如图5所示当反应时间超过120 min 时,3.0 mg/L 溶液中隐孢子虫的灭活率超过99%.
ClO2通入水中,释放出新生态氧和次氯酸分子,新生态氧和次氯酸分子具有强氧化作用,可以使微生物中的氨基酸被氧化分解而抑制其生长并将其杀灭[11-12].

图5 ClO2投量和反应时间对隐孢子虫灭活率的影响
3.2 浊度对ClO2灭活隐孢子虫效果的影响
在pH值为7.0,ClO2投量为3.0 mg/L,浊度分为0.1、0.5、1.0、5.0、10.0 ntu 时,检测ClO2对隐孢子虫的灭活效果.如图6所示.ClO2对隐孢子虫的灭活效果是随着浊度的增加而降低的,浊度越高,灭活效果越差.当浊度为1.0 ntu,作用时间为120 min 时,灭活率为91.8%.
天然水体中存在着的各种悬浮物及胶体物质为隐孢子虫的卵囊提供了防护层,从而降低了ClO2对其灭活效果.

图6 浊度对灭活率的影响
3.3 pH值对ClO2灭活隐孢子虫效果的影响
在pH值分别为6.0、7.0、7.5、8.0、9.0,ClO2投量为3.0 mg/L,浊度为1.0 ntu 时,检测ClO2对隐孢子虫的灭活效果.如图7所示pH值为6~7范围内灭活效果最佳,反应时间超过30 min,平均灭活率达86.85%,pH值在8~9 范围平均灭活率可达83.6%,作用时间大于240 min 后,酸性条件的灭活率大于99.2%.
从图7 可以看出,pH值不是ClO2灭活隐孢子虫的主要影响因素.
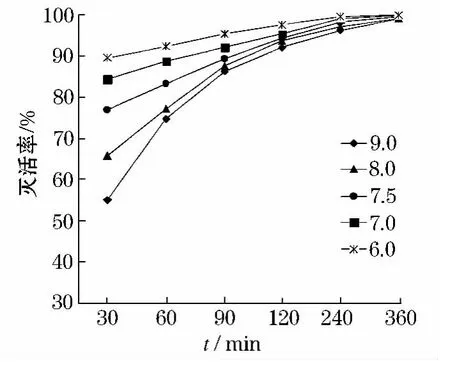
图7 pH值对灭活率的影响
3.4 温度对ClO2灭活隐孢子虫效果的影响
在pH值为7.0,浊度为1.0 ntu,ClO2投量为3.0 mg/L,温度分别为5、15、25、35 ℃时,检测ClO2对隐孢子虫的灭活效果.如图8所示.当反应时间达到120 min 后,从5~35 ℃的灭活率分别为91.8%、93.6%、95.9%和98.1%.较低温度时,灭活效果最差,随着水温的增加,ClO2灭活效果逐渐增强.
隐孢子虫在低温时,处于休眠状态,ClO2不易对其灭活;然而在较高温度时(大于20 ℃),隐孢子虫的活性增强,ClO2对其有一定的灭活作用,从而提高了灭活效果.
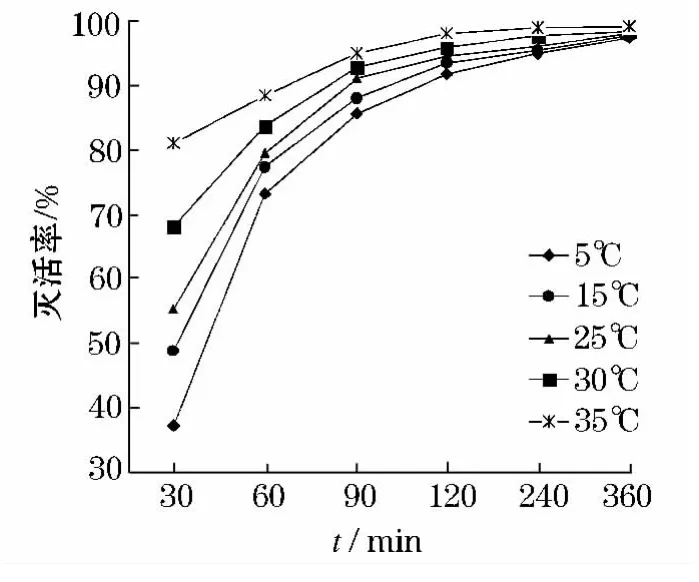
图8 温度对灭活率的影响
4 结语
氯系消毒剂投加量和作用时间分别为:Cl2投量大于6.5 mg/L,反应时间超过360 min;ClO2投加大于3.0 mg/L,反应时间超过120 min.浊度越高,Cl2对隐孢子虫灭活率越低,时间超过540 min时,灭活率均大于99%;ClO2对隐孢子虫灭活率当浊度升高到5.0和10.0 ntu 时,影响基本稳定.pH值波动对氯气灭活隐孢子虫影响不大,作用时间大于540 min 后,灭活率均大于99%,ClO2对隐孢子虫在pH值6~7 范围内灭活效果最佳.温度范围5~35 ℃,随着水温增加,Cl2及ClO2灭活隐孢子虫的效果逐渐增强.
[1]SMITH H V,NICHOLS R.Cryptosporidium:Detection in water and food[J].Expermental Parasitology,2009,123(4):1-19.
[2]REINOSO R,BECARES E,SMITH H V.Effect of various environmental factors on the viability of Cryptosporidium parvum oocysts[J].Journal of Applied Microbiology,2008,104(4):980-986.
[3]LOBO M L,XIAO L,ANTUNES F,et al.Occurrence of Cryptosporidium and Giardia genotypes and subtypes in raw and treadted water in Portugal[J].Letterin Applied Microbiology,2009,48:732-737.
[4]XIAO L,FENG Y.Zoonotic Cryptosp-oridiosis[J].FEMS Immunol.Med.Microbiol,2008,52:309-323.
[5]MONTEMAYOR M,GALOFR B,RIBAS F,et al.Comparative study between two laser scanning cytometers and epifluorescence microscopy for the detection of Cryptosporidium oocysts in water[J].Cytometry Part A,2007,71(3):163-169.
[6]KEVIN R J,PETER M.Neural network models of Cryptosporidium parvum inactivation by chlorine dioxide and ozone[J].Environmental.Engineering.Science,2007,6:477-482.
[7]FURNESS B W,BEACH M J,ROBERTS J M.Giardiasis surveillance-United States,1992-1997[J].Morbidity and Mortality Weekly Report CDC Surveillance Summary,2000,49(7):1-13.
[8]金云霄,张立成,傅金祥.介水隐孢子虫病的防治措施与方法[J].给水排水,2005,31(4):42-45.
[9]FALABI J A,GERBA C P,KARPISCAK M M.Giardia and Cryptosporidium removal from waste-water by a duckweed(Lemna gibbal)covered pond[J].Letters in Applied Microbiology,2002,34(5):384-387.
[10]FERNANDO M H,ELVIRA A M,MCGUIGAN K.G,et al.Disinfection of drinking water contaminated with Cryptosporidium parvum oocysts under natural sunlight and using the photocatalyst TiO2[J].Journal of Photochemistry and Photobiology B:Biology,2007,88(2-3):105-111.
[11]张清文,蒋 励.二氧化氯的性质及用于对水消毒的优点[J].中国消毒学杂志,2000,17(4):220-221.
[12]李春敏,李 星,杨艳玲,等.氯和二氧化氯联合消毒灭菌作用的研究[J].哈尔滨商业大学学报:自然科学版,2012,28(4):415-419.
