慢性肾功能衰竭患者椎体骨质变化的磁共振波谱初步分析
2013-10-20高才良曾南林董国礼余灵安夏成云郭永榜
高才良,曾南林,董国礼,余灵安,夏成云,郭永榜,刘 念,刘 斌,王 飞
(川北医学院附属医院,四川 南充 637000)
慢性肾功能衰竭(CRF)简称慢性肾衰,又称慢性肾功能不全。近年来随着血液净化技术的发展,CRF患者的生存期逐渐延长,但因肾脏疾病导致的电解质紊乱、酸碱平衡失调和内分泌紊乱而引起的骨质变化(如骨钙减少、骨质疏松、肾性骨病)也与日俱增,成为目前影响CRF患者生存质量的突出问题之一。虽然骨组织学检查是诊断骨质变化的金标准,但为有创检查,临床应用受到一定限制。磁共振波谱(MRS)作为目前一种无创的检测活体内器官、组织细胞代谢、生化变化及化合物定量分析的方法[1],广泛地用于中枢神经系统[2],或通过测量椎体内脂肪含量(FF%)及脂水比(LWR)来间接的评估骨质疏松的变化情况,但CRF患者椎体骨质变化的MRS特征,笔者尚未见国内外文献报道。
1 材料与方法
1.1 临床资料
1.1.1 病变组(CRF组)
搜集川北医学院附属医院2011年9月—2012年2月初次就诊且经临床确诊的CRF患者64例,均知情同意,男42例,女 22例,年龄18~62岁,平均(44.8±10.8)岁。纳入标准:临床确诊 CRF(参照美国肾脏病基金会(NKF)制定的CRF临床实践指南(K/DOQI)提出的诊断标准:肾小球滤过率(GFR)<60 mL/(min·1.73m2),时间≥3 月)且排除慢性肾脏病以外的各种代谢骨病及其它相关疾病的患者。
1.1.2 对照组
同期选取来我院体检的34名志愿者,年龄相仿,且经体检身体各项指标正常,无各种代谢骨病及其它相关疾病,均知情同意,其中男22例,女12例,年龄 22~72 岁,平均(42.6±12.9)岁。
1.2 研究方法
1.2.1 设备
MR设备使用GE Signa Excite 1.5T超导全身磁共振扫描仪(GE Medical System,Milwaukee,WI,USA),梯度场强 38 mT/m,切换率 120 T(m·s)。脊柱MR常规序列成像使用脊柱相控阵线圈,脊柱MRS使用体线圈。
1.2.2 检查方法
常规序列:均对病变组和对照组腰椎行矢状面SE T1WI、快速 SE(FSE)T2WI及 STIR,横断面 FSE T2WI及冠状面FSE T2WI常规序列成像。腰椎MRI常规序列成像参数见表1。腰椎常规扫描时,病变组与对照组均要求在椎体形态、骨质信号未见异常的情况下方可进行下一步扫描,若发现异常则放弃本次扫描。②常规腰椎扫描结束后行L2椎体1H-MRS采集。1H-MRS采用单体素点解析波谱(PRESS)序列进行波谱采集,定位以矢状面T2WI,同时辅以横断面T2WI及冠状面T2WI,整个感兴趣区(ROI)位于L2椎体松质骨的中心位置(图1~3)。1H-MRS的扫描参数:TR=1 500 ms,TE=35 ms, 激励次数为 8,感兴趣区容积(VOI)2.0 cm×2.0 cm×2.0 cm。然后对1HMRS感兴趣区进行自动匀场并完成波谱的采集,扫描时间为84 s。波谱分析采用Saker软件。
椎体1H-MRS主要显示2个明显的波峰:水峰和脂峰。水峰位移于4.65 ppm(×10-6)左右;脂峰至少由8个部分组成,主要为亚甲基组位移于1.3 ppm左右。测量脂峰及水峰的峰下面积(Sfat和Swat),并用两者计算每个ROI的FF%和LWR。FF计算公式为:FF=Sfat/(Sfat+Swat),FF%=FF×100%。LWR 计算公式为:LWR=Sfat/Swat。
1.2.3 统计学处理方法
使用SPSS 16.0统计学软件对所得数据进行分析处理,实验组与对照组间采用独立样本t检验,检验组间FF%和LWR有无差异,若P<0.05则认为差异具有统计学意义。FF%和LWR与GFR的相关性采用Spearman秩相关性分析,若P<0.05则认为两者间具有相关性。相关变量对CRF患者的骨质变化的诊断价值及临界值采用受试者工作特征(ROC)曲线来判断。
2 结果
2.1 CRF组L2椎体1H-MRS波谱特点
CRF组L2椎体1H-MRS显示水峰在左,位移于4.65 ppm左右;主要为亚甲基组的脂峰在右,位移于 1.3 ppm左右(图4)。CRF组 64例,FF%为32.50%~77.72%, 平均值±标 准差 为(52.56±10.74)%;LWR 为 0.48~3.49, 平均值±标准差为1.25±0.68。

图1~3 L2椎体1H-MRS采集定位参考常规扫描的矢状面(图1),并辅以横断面(图2)及冠状面(图3)。Figure 1~3. L2 vertebral1H-MRS acquisition position reference scan in the sagittal plane(Figure 1),supplemented by axial plane(Figure 2)and coronal plane(Figure 3).
2.2 对照组L2椎体1H-MRS波谱特点
对照组L2椎体1H-MRS显示水峰在左,位移于4.65 ppm左右;主要为亚甲基组的脂峰在右,位移于1.3 ppm左右(图5)。对照组34例,FF%为16.98%~67.23%,平均值±标准差为(43.24±12.19)%;LWR为 0.20~2.05,平均值±标准差为 0.85±0.44。
2.3 CRF组FF%、LWR均值明显高于对照组
CRF组与对照组间FF%、LWR均值相比较,CRF组明显高于正常对照组(图6,7),两者间差异具有显著统计学意义(FF%:t=-3.752,P=0.000;LWR:t=-3.512,P=0.001)。
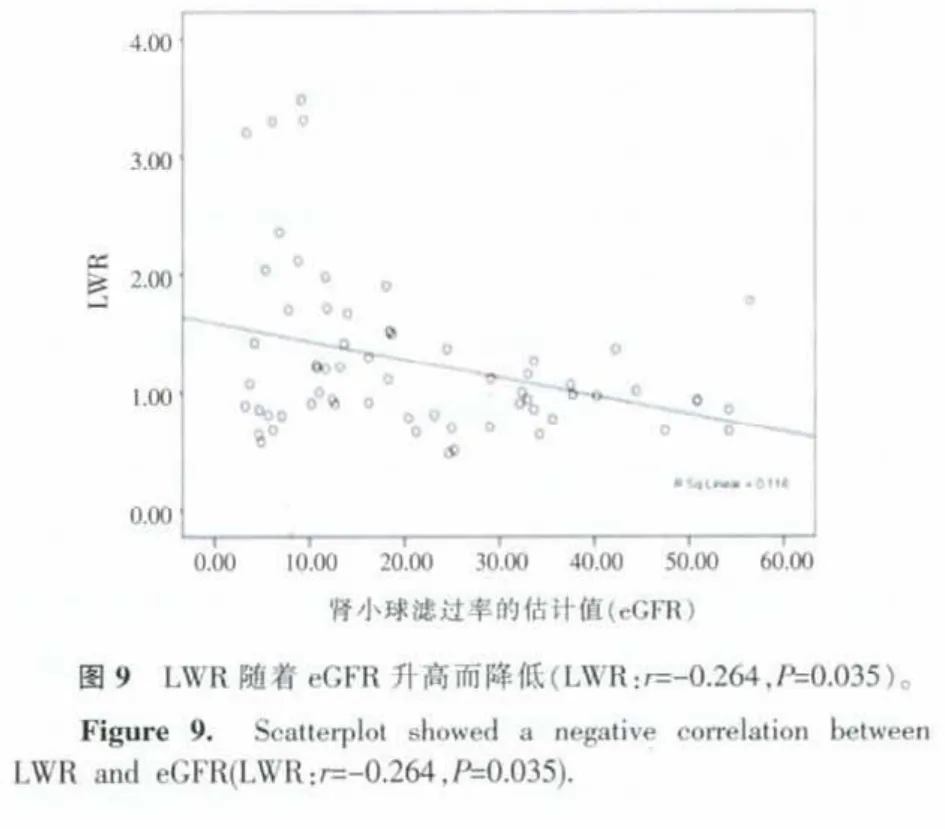
2.4 CRF组FF%、LWR与GFR的估计值(eGFR)的关系
CRF组FF%、LWR与eGFR间呈负相关关系。FF%、LWR随着eGFR升高而降低(FF%:r=-0.264,P=0.035;LWR:r=-0.264,P=0.035)(图 8,9)。
2.5 FF%、LWR对CRF患者的骨质变化评估的ROC曲线
FF%判断CRF患者骨质变化的ROC曲线下面积为 0.706,95%可信区间(CI)为0.591~0.821,诊断临界值为33.29%,灵敏度为0.984,特异度为0.296(图10)。LWR判断CRF患者骨质变化的ROC曲线下面积为0.706,95%CI为0.591~0.821,诊断临界值为50.00%,灵敏度为0.984,特异度为0.296(图11)。
3 讨论
MRS技术应用的日趋广泛,扫描技术也较成熟。笔者前瞻性的研究了64例CRF患者和年龄相仿的34例健康志愿者L2椎体FF%及LWR,观察、分析两组间的差异,并分析FF%及LWR与eGFR的相关性,间接的评估CRF患者的骨质变化情况。
3.1 选择L2椎体的松质骨进行FF%、LWR测定的意义







本组选择L2椎体的松质骨进行FF%、LWR测定,是因为:①脊柱椎体为松质骨,Gerakis等[3]研究表明松质骨的代谢转换率是皮质骨的8倍,故其骨质变化较皮质骨快得多,且MRI为目前观察骨髓变化和测定骨髓信号改变最敏感的方法。MRI成像清晰的显示松质骨,便于1H-MRS波谱采集时ROI的选取及定位。②L2椎体退变相对于下腰椎不明显,尽量避免了椎体退变的影响。③CRF骨质丢失常发生于下半身持重部位(如腰、背、髋、膝关节等),且L2椎体为CRF时国际推荐检测部位L2~L4之一。
3.2 FF%、LWR的意义及临床价值
MRS在脊柱常规MRI成像基础上,可利用FF%、LWR间接的评估骨髓的变化对骨质含量所带来的影响[4]。其主要理论基础为:体内红骨髓与黄骨髓两者所含脂肪和水成分不同,而MRS谱线中的水峰信号主要由红骨髓产生,而脂峰信号主要来源于黄骨髓。就FF%、LWR与骨质含量的相关性而言,国内外文献[4-7]表明呈负相关关系。笔者对34例健康志愿者行1H-MRS采集,测得椎体FF%平均值±标准差为(43.24±12.19)%,这与虞志康等[8]对 30 例不同年龄健康志愿者测得的椎体FF%平均值±标准差为(45.0±20.2)%和 Tang等[9]对 24 例正常患者测得的椎体FF%平均值±标准差为(48.79±7.1)%相接近。而LWR平均值±标准差为0.85±0.44,与虞志康等[8]对30例不同年龄健康志愿者测得的LWR平均值为0.76亦相接近。虽有一定出入,笔者认为这可能与对照组内的性别比例、年龄段分布情况及MRI机型等因素相关。
对64例CRF患者进行1H-MRS采集,测得L2椎体的平均FF%和平均LWR均高于正常对照组。这可能是因为CRF时钙吸收减少、钙磷代谢异常、慢性酸中毒、营养不良、继发甲状旁腺功能亢进导致的骨吸收增强和骨矿化缺陷等常见原因[10],最终引起骨质含量减少。而且进入CRF终末期时,几乎100%患者出现肾性骨病[11]。随着骨质的流失,骨小梁的萎缩,同时伴有脂肪含量代偿性的增加,并因骨质减少、骨小梁萎缩而留下的空间将由脂肪细胞来填充[12-13],从而使得椎体FF%增加。而1H-MRS谱线脂峰下面积与椎体的脂肪含量呈正比关系,即椎体脂肪含量越高1H-MRS谱线的脂峰下面积越大,进而使LWR增大。但并不是所有的CRF患者的FF%和LWR均高于对照组,笔者认为可能与病程的长短、病程中是否有补钙史、年龄、性别、身体指数及个体差异等因素有关。
3.3 CRF患者的骨质变化与肾功能的相关性
骨质含量和肾功能之间是否具有相关性,目前尚有较大争议。有文献研究表明CRF患者骨钙减少、骨质疏松、肾性骨病的患病率很高。一般GFR低于60 mL/min时开始出现较明显的并发症,且随着肾衰竭程度的加重,骨质疏松程度加重[14]。然而Hsu等[15]的研究结果认为肾功能的下降程度与骨质含量之间不存在相关性。
虽然核素GFR是判断肾脏功能的金标准,但临床上完成GFR核医学检查的病例数均较少,故本实验采用临床普遍使用的eGFR来估计肾脏的功能。eGFR是指通过建立数学模型,用血清肌酐推算GFR的方法,本方法具有快速、简单和经济的特点。CRF组患者均按照肾脏疾病饮食修正(MDRD)公式计算eGFR。本实验通过FF%、LWR与eGFR相关性分析发现,CRF患者的FF%、LWR与eGFR呈负相关关系(r=-0.264,P=0.035 和 r=-0.264,P=0.035),从而间接证明了CRF患者的骨质变化与肾功能具有一定相关性,但相关性不是很密切。笔者认为这可能与我们利用的是FF%及LWR间接的来评估肾功能减退引起的椎体骨质变化有关,而患者椎体的FF%及LWR还受年龄、性别等因素的影响。
3.4 利用FF%及LWR间接评估CRF患者骨质变化的灵敏度及特异度分析
笔者通过ROC曲线来量化FF%、LWR对CRF患者骨质变化的评估价值,确定出临界值,并有相应的灵敏度及特异度。得出FF%与LWR对CRF患者骨质变化的评估价值基本一致,即灵敏度(0.984)较好,特异度(0.296)较差,整个方法具有一定的诊断价值(Az=0.706)。这与MRS对脂水信号敏感性高的理论基础相符合,即MRS谱线中信号主要反应的是椎体内红骨髓与黄骨髓两者所含脂肪和水的成分。
3.5 本研究的意义及不足
人体任何部位骨质的丢失都会增加患疾病的风险,而CRF患者骨质的丢失临床上则以骨痛、骨折、骨变形为主要表现形式,关注CRF患者骨质变化问题具有重要的临床意义。本研究采用的1H-MRS是一种分析骨髓疾病有效、无创性的方法[15-16],并可对相关化合物进行定量分析的MR技术[2]。且相对于其他原子核,氢质子在人体中含量丰富并具有磁化率,是临床最常应用的波谱,所以利用1H-MRS测定椎体FF%、LWR也具有很好的可行性。
本研究样本量较小,使结果存有一定的偏差。且CRF的发生机制十分复杂,临床分期也较多,故应增大样本量进一步观察、研究。
总之,1H-MRS可以无创地测定椎体 FF%、LWR。CRF组患者L2椎体的平均FF%、平均LWR高于对照组,且FF%、LWR与eGFR呈负相关关系,进而可以用FF%及LWR来间接的评估CRF患者的骨质变化情况,且为一种无创的影像学检测方法。
[1]曹开明,郝南馨,王葳,等.肾脏3.0T单体素1H-MRS定量观察[J].中国医学影像技术,2009,25(7):1248-1250.
[2]尚伟,余卫,林强,等.椎体骨髓状况的磁共振波谱评估[J].实用放射学杂志,2010,26(1):63-66.
[3]Gerakis A,Hadjidakis D,Kokkinakis E,et al.Correlation of bone mineral density with the histological findings of renal osteodystrophy[J].J Nephrol,2000,13(6):437-443.
[4]刘勇,汤光宇,汤榕彪,等.1H-MRS对椎体骨髓研究初步应用[J].实用放射学杂志,2010,26(2):219-223.
[5]Schellinger D,Lin CS,Lim J,et al.Bone marrow fat and bone mineral density on proton MR spectroscopy and dual-energy X-ray absorptiometry:their ratio as a new indicator of bone weakening[J].AJR,2004,183(6):1761-1765.
[6]Yeung DK,Gfiffith JF,Antonio GE,et al.Osteoporosis is associated with increased marrow fat content and decreased marrow fat unsaturation:a proton MR spectroscopy study[J].J Magn Reson Imaging,2005,22(2):279-285.
[7]Griffith JF,Yeung DK,Antonio GE,et al.Vetebral bone mineral density,marrow perfusion,and fat content in healthy men and men with osteoporosis:dynamic contrast-enhanced MR imaging and MR spectroscopy[J].Radiology,2005,236(3):945-951.
[8]虞志康,严志汉,周云新,等.脊柱良恶性压缩骨折的MR波谱分析[J]. 中华放射学杂志,2006,40(4):410-414.
[9]Tang GY,Lv ZW,Tang RB,et al.Evaluation of MR spectroscopy and diffusion-weighted MRI in detecting bone marrow changes in postmenopausal women with osteoporosis[J].Clin Radiol,2010,65(5):377-381.
[10]Hass M,Leko-Mohr Z,Roschger P,et al.Oateoprotegerin and parathyroid hormone as markers of high-turnover osteodystrophy and decreased bone mineralization in hemodialysis patients[J].Am J Kidney Dis,2002,39(3):580-586.
[11]Torres A,Lorenzo V,Hernandez D,et al.Bone disease in predialysis,hemodialysis,and CAPD patients:evidence of a better bone response to PTH[J].Kidney Int,1995,47(5):1434-1442.
[12]Verma S,Rajaratnam JH,Denton J,et al.Adipocytic proportion of bone marrow is inversely related to bone formation in osteoporosis[J].J Clin Pathol,2002,55(9):693-698.
[13]Justesen J,Stenderup K,Ebbesen EN,et al.Adipocyte tissue volume in bone marrow is increased with aging and in patients with osteoporosis[J].Biogerontology,2001,2(3):165-171.
[14]李桂英,肖太玲,秦燕.慢性肾衰竭与骨质疏松的相关因素分析[J]. 中国骨质疏松杂志,2011,17(5):405-407.
[15]Hsu CY,Cummings SR,McCulloch CE,et al.Bone mineral density is not diminished by mild to moderate chronic renal insufficiency[J].Kidney Int,2002,61(5):1814-1820.
[16]Line y GP,Bernard CP,Manton DJ,et al.Age,gender and skeletal variation in bone marrow composition:apreliminary study at 3.0 Tesla[J].J Magn Reson Imaging,2007,26(3):787-793.
