腹腔镜胰体尾切除术后认知功能障碍机制探讨
2013-10-19李希明刘中凯李光
李希明 刘中凯 李光
·短篇论著·
腹腔镜胰体尾切除术后认知功能障碍机制探讨
李希明 刘中凯 李光
腹腔镜胰体尾切除术虽已获得广泛赞誉,但是手术操作较繁锁,平均手术时间238 min,术后平均住院3周,并发症30%以上。腹腔镜胰体尾切除术后认知功能障碍(postoperative cognitive dysfunction,POCD)的发生率较其他腹部手术发生率高[1]。本研究检测腹腔镜胰体尾切除患者局部脑氧饱和度及血浆β-淀粉样蛋白(β-amyloid protein,β-AP)水平,探讨POCD的发病机制,为预防和治疗POCD提供依据。
一、资料与方法
1.临床资料: 我院2009年12月至2012年5月间择期行腹腔镜胰体尾切除术患者共29例,其中男18 例,女11例,年龄40~80岁。依据美国麻醉协会(American Society of Anesthesiologists,ASA)的标准麻醉分级为Ⅰ~Ⅲ级。术前影像检查提示胰体癌9例,胰体尾癌20例。术前评估均能在腹腔镜下手术切除。排除标准:术前合并严重高血压、心脏病者;术前经检查证实已经存在认知功能障碍者;患有焦虑症及其他精神病、精神障碍者;老年性痴呆、中风后遗症、脑出血以及其他重要脏器功能衰竭患者; 患有某些疾病能干扰认知功能评价,包括吸毒或其他精神性药物滥用者;伴有严重的神经功能缺损的患者,如失语、失认、严重偏瘫、视听障碍等。
2.手术麻醉及观察指标:患者入室后使用迈瑞T8多参数监护仪建立心电图(ECG)、心率(HR)、氧饱和度(SpO2)、呼气末二氧化碳浓度(EtCO2)等常规监测,桡动脉置管测有创血压。用酒精棉球清洁患者额部皮肤进行脱脂处理后,Narcotrend电极置于患者前额,并且能够稳定记录数据。
静脉注射咪唑安定0.08~0.1 mg/kg、丙泊酚1 mg/kg、舒芬太尼0.8~1 μg/kg、顺式阿曲库胺0.1~0.15 mg/kg全麻诱导。去氮给氧3~5 min后行气管插管,接麻醉机行机控呼吸,纯氧1~5 L/ min。行颈内静脉穿刺,术中输液、采血及监测中心静脉压(CVP)用。采用1%~3%七氟醚吸入,丙泊酚2~5 μg·kg-1·h-1、瑞芬太尼0.5~1 μg·kg-1·min-1和顺式阿曲库胺0.002~0.004 mg·kg-1·min-1静脉持续泵注维持麻醉。维持术中患者血压、心率波动在基础值的30%以内。腹腔镜胰体尾切除术由同一组医师完成。手术缝合皮下时停吸入麻醉药,以丙泊酚泵注维持麻醉直至缝皮结束。麻醉期间均采取容量控制通气,通过调节呼吸频率及潮气量维持呼气末二氧化碳分压(PetCO2) 60 mm Hg(1 mm Hg=0.133 kPa)以下。所有患者的吸入氧浓度为100%,吸呼比为1∶1~1.5。于麻醉诱导前(T0)、气腹开始前(T1)及气腹开始后30 min(T2)、60 min(T3)、120 min(T4)、气腹结束(T5)6个时点使用Radiometer ABL800 全自动血气分析仪进行血气分析,并标记此刻的局部脑氧饱和度数据(%)。记录术中出血量、尿量、液体输注量。
3.局部脑氧饱和度(regional cerebral oxygen saturation,rSO2)监测:利用近红外光谱仪技术(near infrared spectroscopy,NIRS)进行rSO2监测[2]。近红外光频谱仪INVOS4100、INVOS5100为美国Somaneti公司产品, rSO2探头置于患者右前额。仪器可连续监测、自动记录并保存脑氧数据,每分钟记录2次脑氧数据,术后将数据传输至计算机进行处理。
4.血浆β-AP 检测:于T0、T1、T2、T3、T4、T5及术毕24 h抽取颈内静脉血5 ml置PVC管, 4℃ 3000 r/min离心10 min,取血清置-20℃保存。由上海志立生物科技有限公司采用ELISA法检测β-AP蛋白含量。
5.认知功能评估:由同一组人对患者在术前1 d和术后7 d行2次神经心理测试,内容包括:(1)简明精神状态量表(MMSE);(2)数字广度测试(test digit span subtest);(3)数字符号测试(digit-symbol substitution test);(4)循迹连线试验A(trail making test A);(5)词汇流畅性测验(verbal fluency test);(6)单词辨认任务(word recognition memory test)。术前、术后两套试题难易度相近,采用 Z计分的方法。另以10名健康者作为对照组,对照组测试者术前、术后平均变化定义为该项测试的学习效应。术后测试得分减去术前测试得分,再减去对照组的学习效应,其差值除以正常人群术前得分的标准差,即为Z计分。两个或两个以上测试的Z计分≥1.96时为阳性,则认为该患者出现了术后认知功能障碍[1,3-4]。
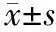
二、结果
1.POCD发生率:12例患者Z计分为阳性,17例阴性, POCD发生率为41.4%。
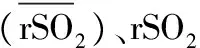

表1 两组患者术中rSO2的比较(%)
注:与组内T0时比较,aP<0.05;与非POCD组比较,bP<0.01
3.POCD及非POCD患者血清β-AP水平变化:POCD组患者T3、T4、T5及术后24 h的血清β-AP水平较同时间点非POCD组患者显著升高,亦较自身T0时的水平显著升高(P<0.05),非POCD组各时间点血清β-AP水平没有明显变化(表2)。
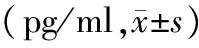
表2 两组患者血清β-AP水平变化
注:与非POCD组比较,aP<0.05;与组内T0时比较,bP<0.05
讨论POCD是指手术麻醉后常出现的神经系统并发症,表现为精神错乱、焦虑、人格的改变及记忆受损。多数研究认为,POCD与年龄、手术、麻醉、心理因素、睡眠紊乱、疼痛有关。1998年国际术后认知功能障碍研究协作组报道的1218名择期手术的老年患者术后1周POCD的发生率为25.8%,术后3个月的发生率为9.9%[1]。2011年Evered等[5]报道644名患者冠脉搭桥术(CABG)组或全髋关节置换术(THJR)组术后7 d POCD发生率分别为43%和17%。Rasmussen等[6]报道35例老年患者(≥60岁)全身麻醉下腹部手术后1周POCD的发生率高达48.6%。本组术后POCD的发生率为41.4%。这可能与研究所选择的手术、麻醉类型以及评价POCD的方法和诊断标准有关,此外样本量小也可能导致发生率有偏差。
腹腔镜胰腺切除术手术时间平均长达238 min。长时间的气腹,通气效能下降,CO2经腹膜吸收等产生高碳酸血症,引起rSO2的降低。此外,CO2是脑血管的强力调节剂,PaCO2每上升或下降0.133 kPa,脑血流相应增减2 ml·100 g-1·min-1。在吸入麻醉脑血管已经扩张的基础上,CO2增高可引起颅内压升高和脑血流下降,并由此导致rSO2降低[7]。
rSO2主要代表脑部静脉氧饱和度,较好地反映脑部氧供和氧耗的平衡变化。单闯等[8]使30例行腹腔镜胆囊切除术患者术中保持呼气末PaCO2<40 mmHg,结果PaCO2及颈静脉血氧饱和度均显著增加,认为存在脑过度灌注,其实质是脑组织细胞水平的氧合不足,是脑缺氧的另一种形式。有报道称rSO2低于50%或者较基础值下降20%以上者预示存在脑缺血的可能, 而该结论已通过听觉诱发电位测试得到证实[9]。据Monk等[10]所做的一项大型前瞻性调查研究显示,在老年患者POCD的发生与术中频繁出现低rSO2密切相关,且这些患者的住院时间也相对更长。Slater等[11]也得出类似的结论,CABG术中rSO2下降评分≥3000%·S的患者术后更易出现认知功能减退(P=0.024),住院天数延长的危险性增加近3倍(P=0.007)。
β-AP是阿尔茨海默病(alzheimer disease,AD)老年斑形成的始动因子,也是老年斑核中的重要成分。脑内β-AP增多与认知功能障碍关系密切[12]。脑内β-AP增多主要与β-淀粉样前体蛋白(β-amyloid precursor protein,β-APP)含量增多有关,APP是一种急性反应蛋白,其转录过程受中枢炎性细胞因子的调节[13]。β-AP生成和积淀增加进一步触发了神经元凋亡,导致N-甲基-D-天冬氨酸受体(NMDA)受体内释化,神经元间信息传递受阻,从而导致了学习和记忆功能损害。Lu等[14]研究发现,七氟烷可改变APP的产生,提高β-AP的水平,以致神经毒性,而且此研究还发现阿尔茨海默病转基因大鼠吸入七氟烷更容易出现神经损伤。
本研究结果显示,POCD组rSO2%max显著高于非POCD组;POCD组T1的rSO2值明显高于T0,T5较T0明显下降,术后24 h血清β-AP水平较麻醉诱导前明显增高且较非POCD组也明显增高,而非POCD组各时间点血清β-AP水平没有明显变化。这一结果提示POCD可能与rSO2及血清β-AP水平有关。
但本研究样本量较小,统计效力不够,因此所得到的POCD发生率要高于相关文献报道,一些与POCD相关的危险因素可能也并没有在多因素回归分析中被发现,因此还有待于今后大样本量的调查研究。
[1] Moiler JT, Cluitmans P, Rasmussen LS, et al. Long-term postoperative congnitive dysfunction in the elderly ISPOCDI study ISPOCD investigators. International Stydy of Post-Operative Cognitive Dysfunction. Lancet, 1998, 351: 857-861.
[2] Brawanski A, Fahermeier R, Rothoerl RD, et al. Comparison of near infrared spectroscopy and tissue (O2) time series in patients after severe head injury and an eurysmal subarachnoid hemorrhage. J Cereb Blood Flow Metab, 2002, 22:605-611.
[3] Canet J, Raeder J, Rasmussen LS, et al. Cognitive dysfunction after minor surgery in the elderly. Acta Anaesthesiol Scand, 2003, 47: 1204-1210.
[4] Johnson T, Monk T, Rasmussen LS, et al. Postoperative cognitive dysfunction in middle-aged patients. Anesthesiology, 2002, 96: 1351-1357.
[5] Evered L,Scott DA,Silbert B,et al. Postoperative cognitive dysfunction is independent of type of surgery and anesthetic.Anesth Analg, 2011,112:1179-1185.
[6] Rasmussen LS,Steentoft A,Rasmussen H,et al.Benzodiazepines and postoperative cognitive dysfunction in the elderly ISPOCD Group. International Study of Postperative Cognitive Pysfunction.Br J Anaesth,1999,83:585-589.
[7] 沈茂华,徐美英,于布为.腹腔镜手术对脑氧饱和度的影响.临床麻醉学杂志,1996,12:257-258.
[8] 单闯,吴国荣,楼尉,等. 腹膜后二氧化碳气腹对脑血流的影响.现代实用医学,2003,15:25-26.
[9] Blas M, Sulek C, Martin T, et al. Use of near infrared spectroscopy to monitor cerebral oxygenation during coronary artery bypass surgery in a patient with bilateral internal carotid artery occlusion. J Cardiothorac Vasc Anesth, 1999, 13: 732-735.
[10] Monk TG, Weldon BC, Weldon JE, et al. Cerebral oxygen desaturations are associated with postoperative cognitive dysfunction in elderly patients. Anesthesiology, 2002, 97: A40.
[11] Slater JP, Guarino T, Stack J, et al. Cerebral oxygen desaturation predicts cognitive decline and longer hospital stay after cardiac surgery. Ann Thorac Surg, 2009, 87: 36-44.
[12] Townsend KP, Obregon D, Quadros A, et al. Proinflammatory and vasoactive effects of Abeta in the cerebrovasculature. Ann N Y Acad Sci,2002,977:65-76.
[13] Grilli M,Goffi F,Memo M,et al.Interleukin-1 beta and glutamate activate the NF-kappaB/Rel binding site from the regulatory region of the amyloid precursor protein gene in primary neuronal cultures. J Biol Chem,1996,271:15002-15007.
[14] Lu Y, Wu X, Dong Y, et al. Anesthetic sevoflurane causes neurotoxicity differently in neonatal naive and Alzheimer disease transgenic mice. Anesthesiology, 2010, 112: 1404-1416.
(本文编辑:屠振兴)
10.3760/cma.j.issn.1674-1935.2013.01.011
山东省2011年科学技术发展计划(政策引导类)项目(2011YD18070)
276003 山东临沂,临沂市人民医院麻醉科(李希明、刘中凯),普外二科(李光)
刘中凯,Email:lzk6@163.com
2012-07-30)
