胰源性糖尿病的治疗进展
2013-10-19邓尚新汪泳贾红梅张方信
邓尚新 汪泳 贾红梅 张方信
·综述与讲座·
胰源性糖尿病的治疗进展
邓尚新 汪泳 贾红梅 张方信
胰源性糖尿病是指既往无糖尿病史,由于胰腺良恶性疾病引起血糖升高、糖耐量降低的一种特殊类型糖尿病(T3cDM)。研究发现,75% T3cDM系由慢性胰腺炎(chronic pancreatitis, CP)引起,而各国T3cDM的总体发病率呈增加趋势[1]。众所周知,CP和新发糖尿病(new onset diabetes)是胰腺癌发生、发展的两个重要因素[2]。由此可推测T3cDM应是早期防治胰腺癌的重点对象[3]。本研究主要针对CP导致的T3cDM血糖控制、减少并发症和癌症发生3方面进行治疗证据检索,并文献综述如下。
一、T3cDM的诊断标准
正确诊断是展开治疗的前提。虽然美国糖尿病协会(ADA)[4]和中华医学会糖尿病分会(CDS)[5]均将胰源性糖尿病归类为第三类糖尿病的亚型(T3cDM),但其诊断标准与1型(T1DM)和2型(T2DM)糖尿病一致,即出现糖尿病症状(“三多一少”症状)加上随机血糖≥11.1 mmol/L,或空腹血糖>7.0 mmol/L,或口服葡萄糖耐量试验餐后2 h血糖≥11.1 mmol/L。
T3cDM以CP引起者居多(约占75%),其他导致其发生的胰腺外分泌病变包括创伤、感染、胰腺切除、胰腺肿瘤等。由于CP本身起病隐匿,且慢性腹痛、胰腺外分泌不全所致的脂肪泻和吸收不良等症状常缺乏特异性,因此早期诊断CP已较为困难,其所导致的T3cDM早期诊断则更为困难。此外T1DM和T2DM可出现胰腺分泌功能不全的现象[6],与在胰腺外分泌病变基础上引起的T3cDM有着截然不同的因果关系,但当临床上CP无法早期诊断时,常使二者的因果关系无法确定,致使后期治疗带来不少麻烦[7]。在诊断CP后建立患者随访数据库是早期发现T3cDM的重要办法,国内大规模的CP随访数据提示,21.6%的CP患者可在随访中获得T3cDM诊断的线索[8]。
二、T3cDM治疗目标
CP的治疗以控制疼痛、糖尿病和脂肪泻为主。而发生T3cDM时,其治疗目的则更为具体,即控制高血糖症状、避免并发症和减少胰腺肿瘤发生[3]。血糖控制是使糖化血红蛋白(HbA1c)水平尽可能接近于正常,但须避免威胁生命的低血糖状态。与T1DM和T2DM一致,ADA建议T3cDM的HbA1c水平应小于7%[9-10],但由于T3cDM患者的治疗依从性、酗酒(CP的重要诱因)、不规则饮食及吸收不良(CP本身的并发症)等问题的影响,该治疗目标常难以达到。此外T3cDM与T1DM和T2DM不同,血糖脆性是其明显特点[11],且医护人员及患者低血糖的防护意识较低,因此控制血糖的治疗需个体化进行,宁可保持相对高血糖状态[12-13]。
三、T3cDM治疗方法与利弊
目前国内外尚无T3cDM的治疗指南,通过对国内外数据库的检索,可获以下治疗证据和建议(表1)。T3cDM治疗方法可分为营养控制和血糖治疗。
1.营养控制:每日碳水化合物和能量摄入需依据患者体重和活动量决定。采取少量多餐的方式进食,每日至少进食6餐,饮食中需富含纤维素,减少脂肪、饱和脂肪酸、植物油摄入。由于CP的外分泌功能受损,营养吸收不良,限制能量摄入需采取谨慎的态度。辅以胰酶替代治疗可减少代谢的不稳定性,戒酒可增进胰腺内分泌功能,有助于血糖控制治疗。
2.血糖药物控制:T3cDM药物治疗借鉴于T1DM和T2DM。与T2DM相似,包括胰岛素促分泌剂(磺脲类和格列奈类)、胰岛素增敏剂(格列酮类和双胍类)、影响糖吸收的药物(α糖苷酶抑制剂)和胰岛素的治疗[1]。有关如何选择药物方面,目前尚无统一共识和标准。部分研究认为[12,14,19],大部分T3cDM可通过饮食、生活相关控制及口服降糖药物获得良好的血糖控制。口服降糖药物主要运用对象是轻型、早期病程和一般状态良好的T3cDM患者[9]。然而胰岛素增敏剂和碳水化合物吸收抑制剂应避免在T3cDM患者应用[14,23],因为T3cDM的发病机制是胰岛素分泌缺乏为基础,同时并存明显的消化不良。磺脲类促胰岛素分泌药物也不推荐用于T3cDM患者[14,21,23],因为它可促进胰岛β细胞的过早耗竭。也有研究认为,由于二甲双胍价格便宜、低血糖发生率低、降低胰岛素在糖代谢中的作用和特殊抗肿瘤作用,应作为T3cDM的一线治疗药物,即便后期需胰岛素辅助控制血糖时,二甲双胍仍可继续服用[1]。国内研究者则进一步提出[13],因CP中酒精嗜好者居多,所以T3cDM患者尽量不选用双胍类药物,以减少乳酸酸中毒的危险。
3.胰岛素应用:针对控制饮食而无法稳定血糖的患者,胰岛素注射仍是治疗的首选[9,13,23]。方法是胰岛素的多重应用,即短效胰岛素每天3次和中效胰岛素睡前注射。睡前胰岛素用量通常比T1DM少得多,而每天两次的长效胰岛素注射方法并不推荐使用。需要指出的是,鉴于T3cDM患者血糖具有明显的脆性,胰岛素强化需相对保守,使血糖控制于偏高的水平。
强化胰岛素的对象是以依从性良好的患者为主,并需经常监测血糖。Cui等[1]建议采取以“改变生活方式+二甲双胍+胰酶替代”为基础的递增式T3cDM治疗方案,若基础治疗后HbA1c>7%,则逐步选用递增方案(表2)。
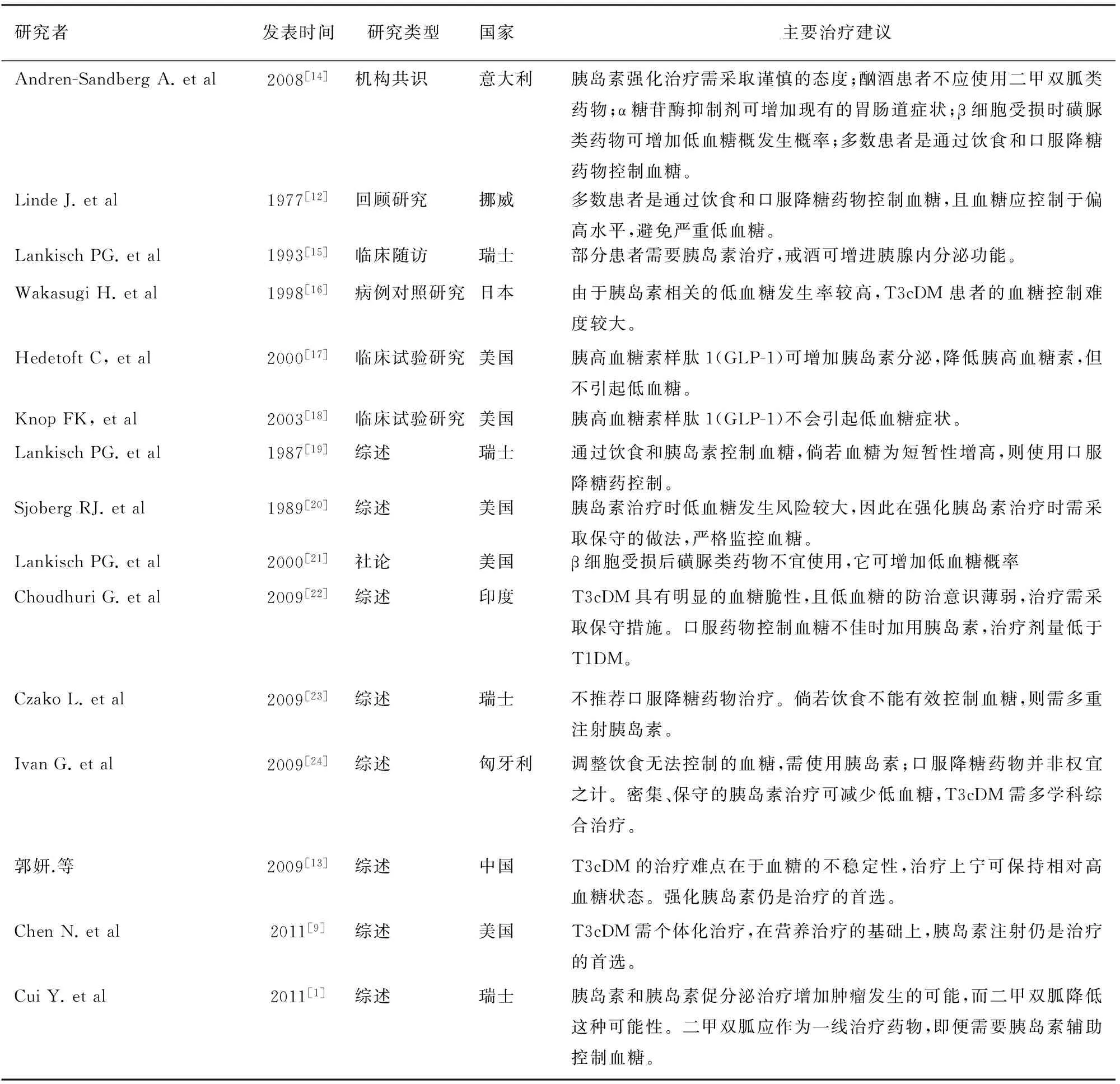
表1 治疗证据检索结果

表2 T3cDM递增治疗方案
注:基础方案治疗后仍HbA1c>7%,逐步选用1至4方案治疗
4.探索中的治疗方法:T3cDM的脆性血糖特点促发了新型控制方案的产生。胰高血糖素样肽1(glucagon-like peptide 1,GLP-1)被视为新的T3cDM治疗方法。部分研究认为其可增加胰岛素分泌,降低胰高血糖素,但却不引起低血糖症状[17-18]。有学者提出,此类药物除能够良好地控制血糖外,还能够减轻患者的体重,甚至在一定程度上改善胰岛β细胞的功能[25]。但是内源性GLP-1易被体内二肽基肽酶4(DPP-4)分解的缺点,限制了其作用时间,不适于直接用于临床。因此,目前以GLP-1为主改善血糖控制的方法包括外源性模拟GLP-1作用及延长内源性GLP-1活性的药物。
有研究认为[26],人GLP-1类似物在T2DM患者早期应用可有效控制血糖,同时保护β细胞、减低体重,并降低肥胖患者糖尿病前期的患病率,带来多重获益,同时避免了内源性GLP-1易被体内二肽基肽酶4(DPP-4)分解的缺点。DPP-4抑制剂可选择性抑制DPP-4的活性,减少内源性GLP-1的降解,可作为治疗T2DM的一类新型药物[27]。然而,有实验研究提示[28],GLP-1和其类似物(exendin-4)有促进胰腺肿瘤或癌前病变发展的作用。GLP-1及其类似物能增加胰十二指肠同源转录因子-1(PDX-1)的表达,而PDX-1却是一个标准的致癌基因[29]。因此,GLP-1及其类似物可能具有致癌作用。Elashoff等[30]报道,与其他控糖药物治疗相比,GLP-1及其类似物可增加20%~30%胰腺癌的发病率。据此,T3cDM患者从GLP-1、GLP-1类似物或DPP-4抑制剂获取的利益多寡目前尚无定论。此外也有学者认为,胰多肽(pancreatic polypeptide)注射可增强胰岛素的敏感性,降低T3cDM的胰岛素需要量,辅助T3cDM的治疗[31]。
四、T3cDM癌变防范
CP有较高的癌变概率,而新发糖尿病则可能是胰腺癌发生的预警信号或早期症状之一[32]。目前有关T3cDM癌变预防尚无研究共识。但最近的流行病学研究仍提示,胰岛素和胰岛素促分泌的治疗可增加胰腺肿瘤发生的风险[33]。部分学者认为[1,34],二甲双胍可降低这种癌变的可能。相关抗癌机制是与其激活肝激酶B1-腺苷酸磷酸蛋白激酶信号通路有关[35]。因此有学者建议[1],在达成T3cDM治疗共识之前,二甲双胍应作为T3cDM高血糖的一线治疗药物,即便后期需叠加胰岛素辅助控制血糖。
五、总结
T3cDM是在胰腺外分泌功能受损的基础上发生,与T1DM和T2DM有着不同的发病因果关系。临床医师在碰到疑似T3cDM患者或是新发糖尿病患者时,需格外小心甄别病因,恰当治疗。T3cDM具有明显的血糖脆性,正常计量的控糖治疗也易导致患者低血糖状态的发生;此外T3cDM治疗不仅局限于血糖和并发症控制,更为重要的是减少肿瘤发生的概率,及早诊治致死率非常高的胰腺肿瘤的发生。
[1] Cui Y, Andersen DK. Pancreatogenic diabetes: special considerations for management. Pancreatology, 2011,11: 279-294.
[2] 贲其稳, 李兆申. 胰腺癌早期诊断研究进展. 中华胰腺病杂志, 2011,11: 151-154.
[3] Andersen DK. The practical importance of recognizing pancreatogenic or type 3c diabetes. Diabetes Metab Res Rev, 2012,28: 326-328.
[4] American Diabetes Association.Diagnosis and classification of diabetes mellitus. Diabetes Care, 2010,33: S62-S69.
[5] 中华医学会糖尿病学分会. 中国2 型糖尿病防治指南. 北京: 北京大学医学出版社, 2010.
[6] Hardt PD, Hauenschild A, Nalop J, et al. High prevalence of exocrine pancreatic insufficiency in diabetes mellitus. A multicenter study screening fecal elastase 1 concentrations in 1,021 diabetic patients. Pancreatology, 2003,3: 395-402.
[7] Ewald N, Kaufmann C, Raspe A, et al. Prevalence of diabetes mellitus secondary to pancreatic diseases (type 3c). Diabetes Metab Res Rev, 2012,28: 338-342.
[8] 王洛伟, 李兆申, 李淑德, 等. 慢性胰腺炎全国多中心流行病学调查. 胰腺病学, 2007,7: 1-5.
[9] Chen N, Unnikrishnan IR, Anjana RM, et al. The complex exocrine-endocrine relationship and secondary diabetes in exocrine pancreatic disorders. J Clin Gastroenterol, 2011,45: 850-861.
[10] Nathan DM, Buse JB, Davidson MB, et al. Medical management of hyperglycemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy: a consensus statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care, 2009,32: 193-203.
[11] Hardt PD, Brendel MD, Kloer HU, et al. Is pancreatic diabetes (type 3c diabetes) underdiagnosed and misdiagnosed? Diabetes Care, 2008,31 Suppl 2: S165-S169.
[12] Linde J, Nilsson LH, Barany FR. Diabetes and hypoglycemia in chronic pancreatitis. Scand J Gastroenterol, 1977,12: 369-373.
[13] 郭妍, 廖专, 李兆申. 慢性胰腺炎内分泌功能不全的研究进展. 中华胰腺病杂志, 2008,9: 427-429.
[14] Andren-Sandberg A, Hardt PD. Second Giessen International Workshop on Interactions of Exocrine and Endocrine Pancreatic Diseases. Castle of Rauischholzhausen of the Justus-Liebig-university, Giessen (Rauischholzhausen), Germany. March 7-8, 2008. JOP, 2008,9: 541-575.
[15] Lankisch PG, Löhr-Happe A, Otto J, et al. Natural course in chronic pancreatitis. Pain, exocrine and endocrine pancreatic insufficiency and prognosis of the disease. Digestion, 1993,54: 148-155.
[16] Wakasugi H, Funakoshi A, Iguchi H. Clinical assessment of pancreatic diabetes caused by chronic pancreatitis. J Gastroenterol, 1998,33: 254-259.
[17] Hedetoft C, Sheikh SP, Larsen S, et al. Effect of glucagon-like peptide 1(7-36)amide in insulin-treated patients with diabetes mellitus secondary to chronic pancreatitis. Pancreas, 2000,20: 25-31.
[18] Knop FK, Vilsboll T, Larsen S, et al. No hypoglycemia after subcutaneous administration of glucagon-like peptide-1 in lean type 2 diabetic patients and in patients with diabetes secondary to chronic pancreatitis. Diabetes Care, 2003,26: 2581-2587.
[19] Lankisch PG. Conservative treatment of chronic pancreatitis. Digestion, 1987,37: 47-55.
[20] Sjoberg RJ, Kidd GS. Pancreatic diabetes mellitus. Diabetes Care, 1989,12: 715-724.
[21] Lankisch PG, Nauck M. Diabetes und chronische Pankreatitis: Wann, wie oft und wie zu therapieren? Dtsch Arztebl, 2000,97: A-1894/B-1627/C-1511.
[22] Choudhuri G, Lakshmi CP, Goel A. Pancreatic diabetes. Trop Gastroenterol, 2009,30: 71-75.
[23] Czakó L, Hegyi P, Rakonczay Z Jr, et al. Interactions between the endocrine and exocrine pancreas and their clinical relevance. Pancreatology, 2009,9: 351-359.
[24] Iván G. The principles of the treatment of pancreatic diabetes. Orv Hetil, 2009,150: 273-276.
[25] 唐欣, 徐路. 胰高血糖素样肽1研究进展. 医学临床研究, 2012,29: 139-142.
[26] 潘长玉. 2型糖尿病早期应用利拉鲁肽的益处. 中华内分泌代谢杂志, 2012,28: 4a-1-4a-3.
[27] 洪天配.新型口服降糖药DPP-4抑制剂:从胰岛α细胞看2型糖尿病治疗的新进展.中国糖尿病杂志,2012,20:558-560.
[28] Gier B, Matveyenko AV, Kirakossian D, et al. Chronic GLP-1 receptor activation by exendin-4 induces expansion of pancreatic duct glands in rats and accelerates formation of dysplastic lesions and chronic pancreatitis in the Kras(G12D) mouse model. Diabetes, 2012,61: 1250-1262.
[29] Liu SH, Patel S, Gingras MC, et al. PDX-1: demonstration of oncogenic properties in pancreatic cancer. Cancer, 2011,117: 723-733.
[30] Elashoff M, Matveyenko AV, Gier B, et al. Pancreatitis, pancreatic, and thyroid cancer with glucagon-like peptide-1-based therapies. Gastroenterology, 2011,141: 150-156.
[31] Rabiee A, Galiatsatos P, Salas-Carrillo R, et al. Pancreatic polypeptide administration enhances insulin sensitivity and reduces the insulin requirement of patients on insulin pump therapy. J Diabetes Sci Technol, 2011,5: 1521-1528.
[32] 袁耀宗, 李为光. 重视糖尿病与胰腺癌内在关系的研究,降低胰腺癌的发病率! 胃肠病学, 2010,15: 65-67.
[33] Maisonneuve P, Lowenfels AB, Bueno-de-Mesquita HB, et al. Past medical history and pancreatic cancer risk: Results from a multicenter case-control study. Ann Epidemiol, 2010,20: 92-98.
[34] Li D, Yeung SC, Hassan MM, et al. Antidiabetic therapies affect risk of pancreatic cancer. Gastroenterology, 2009,137: 482-488.
[35] Shaw RJ, Lamia KA, Vasquez D, et al. The kinase LKB1 mediates glucose homeostasis in liver and therapeutic effects of metformin. Science, 2005,310: 1642-1646.
2012-05-29)
(本文编辑:吕芳萍)
10.3760/cma.j.issn.1674-1935.2013.03.019
700533 兰州,兰州军区兰州军区总医院消化内科
张方信,Email:md_zhangfx@163.com
