经皮冷冻联合125I粒子植入治疗81例Ⅳ期胰腺癌的疗效分析
2013-10-19曾健滢陈继冰姚飞刘卫群李家亮牛立志左建生徐克成
曾健滢 陈继冰 姚飞 刘卫群 李家亮 牛立志 左建生 徐克成
·论著·
经皮冷冻联合125I粒子植入治疗81例Ⅳ期胰腺癌的疗效分析
曾健滢 陈继冰 姚飞 刘卫群 李家亮 牛立志 左建生 徐克成
目的评估氩氦刀经皮冷冻联合125I粒子植入疗法治疗Ⅳ期胰腺癌的疗效。方法对2008年11月至2010年8月收治的81例Ⅳ期胰腺癌患者进行分组,其中Ⅰ组50人,原发灶与转移灶均行氩氦刀冷冻联合125I粒子植入术治疗,Ⅱ组31人,原发灶行125I粒子植入术治疗,转移灶行氩氦刀冷冻联合125I粒子植入术治疗。随访2.5年,比较两组术后不良反应、中位生存期(MST)及治疗频率对MST的影响。结果Ⅰ组和Ⅱ组患者MST分别为8个月和4个月,差异具有统计学意义(P<0.001)。Ⅰ组中接受多次和单次治疗的患者MST分别为11个月和7个月,差异有统计学意义(P=0.0389)。Ⅱ组中接受多次和单次治疗的患者MST分别为4个月和3个月,差异无统计学意义(P=0.99)。结论相对于原发灶行125I粒子植入治疗、转移灶行氩氦刀冷冻联合125I粒子植入术的Ⅳ期胰腺癌患者,原发灶与转移灶均行氩氦刀冷冻联合125I粒子植入术且多次反复治疗的患者生存期得以延长。
胰腺肿瘤; 冷冻疗法; 碘放射性同位素; 治疗结果
氩氦刀靶向冷冻疗法由于其侵入性低、可降低荷瘤率和有效改善生存质量的优点,已开始应用于前列腺癌[1]、肾癌[2]和中晚期胰腺癌的治疗[3-5]。2008年,Xu等[6]总结了38例氩氦刀冷冻联合125I粒子植入治疗中晚期胰腺癌患者的疗效,患者平均存活时间达12个月, 6、12、18、24和36个月的存活率分别为97%、53%、45%、20%和7%。为进一步探讨氩氦刀冷冻联合125I粒子植入治疗晚期胰腺癌的疗效,本研究将进一步对原发灶与转移灶行氩氦刀冷冻联合125I粒子植入术治疗的疗效进行分析。
材料与方法
一、一般资料及分组
从2008年11月截止至2010年8月,广州复大肿瘤医院共收治145例经病理确诊的Ⅳ期胰腺癌患者。患者因下列原因放弃手术及化疗:(1)弥漫性转移;(2)经综合分析原发灶不可手术切除;(3)患者拒绝外科疗法和化疗,或化疗后寻求进一步治疗;(4)有严重并发症,如高血压、胸腔积液和腹水等;(5)年龄过高,手术具有高风险。患者在签署知情同意书后入组。入组条件:(1)治疗前卡氏评分(karnofsky performance status,KPS)≥70;(2)血小板计数≥80×109/L,白细胞计数≥3×109/L,嗜中性粒细胞计数≥2×109/L,血红蛋白含量≥90 g/L;(3)前凝血酶国际标准化比值≥1.5;(4)术前CT评价原发灶或转移灶最大直径<6 cm;(5)胰腺肿瘤无浸润总胆管、后腔静脉、十二指肠或结肠;(6)无3级高血压、严重冠状动脉疾病、骨髓移植、呼吸系统疾病以及急慢性感染;(7)肝功能基本正常、腹水穿刺释放量<1 L;(8)患者被认为可配合完成手术过程;(9)临床与随访资料完整。
入组的Ⅳ期胰腺癌患者共81例,其中男性43例,女性38例,平均年龄65岁(42~84岁)。47例合并肝转移,27例合并腹膜、肝转移,7例多发性转移。患有糖尿病者16例,胸腔积液或腹水15例,患高血压或冠状动脉疾病8例。入组患者分成2组,Ⅰ组50例,原发灶与转移灶均行氩氦刀冷冻联合125I粒子植入术治疗。原发和转移灶肿瘤(共79个)平均直径为(4.3±0.9)cm(3.2~5.7 cm)和(3.5±0.8)cm(2.1~4.5 cm)。Ⅱ组31例,原发灶行125I粒子植入术治疗,转移灶行氩氦刀冷冻联合125I粒子植入术治疗。原发和转移灶肿瘤(共48个)平均直径为(4.5±0.8)cm(3.5~5.8 cm)和(3.7±0.9)cm(2.3~5.0 cm)。
二、方法
采用美国Endocare公司(CRYO-20型)冷冻外科系统和直径为1.7~2 mm的冷冻探针;德国Siemens(SOMATOM Emotion Duo型)双排螺旋CT;日本Aloka株式会社(SSD-5500SA型)超声;中国上海欣科医药有限公司(I125-3631AM-99型)125I粒子。
1.氩氦刀经皮冷冻:患者常规麻醉、消毒、铺巾。根据术前定位及肿瘤大小,选择1~8根冷冻探针。进针途径可选择经腹或经背穿刺。当探针尖端到达肿瘤远端边缘0.5 cm处开始冷冻,冷冻时间10 min或15 min,温度(-160±10)℃,然后主动复温3~5 min,达(25±5)℃,行1~3个循环。超声或CT扫描示冰球覆盖靶区后拔除超冷刀,往针道注射1 ml纤维蛋白原和凝血酶,包扎穿刺点。术后禁食24 h,予以镇痛、抗炎并维持静脉营养支持治疗约3~4 d。对经胃穿刺冷冻胰腺癌患者,术后给予抗酸和胃黏膜保护药。对经肝穿刺者,用腹带包扎固定并给予保肝药物。冷冻术后即行CT平扫,24 h和1周后超声复查。
2.125I粒子植入:患者推入CT室后,按肿瘤部位选择体位,常规消毒、铺巾、局部浸润麻醉,在超声及CT引导下用介入穿刺针从穿刺点穿刺到靶区内,CT扫描确认到位后用粒子枪在病灶内依次植入125I粒子(活度0.7 mCi,半衰期1~ 6 mCi),每粒间隔0.5 cm,处方剂量为120 Gy,范围包括肿瘤周围1 cm,放置粒子数通常≤20枚。植入后通过CT检查确定植入粒子数目、病灶体积变化及粒子分布情况。用放射性粒子植入治疗计划系统计算得出真实植入后治疗剂量分布,得出以120 Gy为处方剂量线及剂量体积直方图,并对治疗质量进行评估。对同一病灶施以氩氦刀冷冻联合125I粒子植入术,可先行125I粒子植入后随即进行氩氦刀冷冻治疗。
3.术后评估和随访:记录患者术后的不良反应,进行视觉模拟量表(VAS)及KPS评分。患者在术后第1个月及每间隔3~4个月行动态CT腹部扫描,并根据实体瘤疗效评价新标准(RECIST1.1)进行总体疗效评价。术后第1个月及每3个月进行一次随访。
三、统计学处理
生存期从入组患者确诊为Ⅳ期胰腺癌之日起算。统计学处理采用美国San Diego公司GraphPad软件,生存率曲线采用Kaplan-Meier方法描绘,生存率比较用对数秩和检验(Long-rank test)。P<0.05为差异具有统计学意义。
结 果
一、术后不良反应
2个治疗组均无术中死亡。术后未发现胰瘘、胆漏和肠瘘等严重并发症。2组患者的不良反应主要有血淀粉酶、空腹血糖升高等(表1)。上述并发症经对症治疗后2周内均逐渐改善或消失。
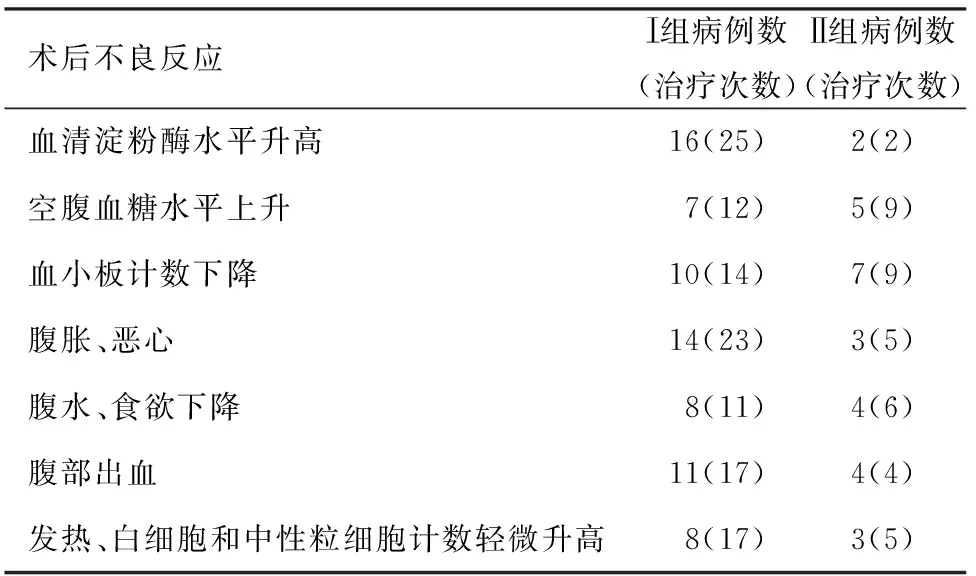
表1 2组患者的术后不良反应
术后1周内,64例(79%)患者VAS评分下降≥50%,57例(70%)患者镇痛剂用量减少50%,43例(53%)患者KPS评分(0~100)增加≥20。
二、术后中位生存期
术后平均随访时间为8个月,患者的中位生存期(MST)为7.12个月(95CI% 3.79~13.37),其中Ⅰ组患者为8个月,Ⅱ组患者为4个月,差异有统计学意义(P<0.001,图1)。Ⅰ组患者的1年生存率为31%,Ⅱ组无1例术后生存超过1年。

图1 Ⅰ组与Ⅱ组Ⅳ期胰腺癌患者生存率曲线
Ⅰ组接受多次治疗的17例患者中,治疗2、3、4、5、9次的患者分别为10、4、1、1、1例,术后MST为11个月,而接受单次治疗的33例患者为7个月,差异有统计学意义(P=0.0389)。Ⅱ组接受多次治疗的14例患者中,治疗2、3次的患者分别为11、3例,术后MST为4个月,而接受单次治疗的17例患者为3个月,差异无统计学意义(P=0.99,图2)。

图2Ⅰ组(a)、Ⅱ组(b)患者接受单次与多次治疗患者的生存率曲线
讨 论
胰腺癌是恶性程度很高的一种消化道肿瘤,80%~90%胰腺癌患者确诊时已不能进行外科切除手术[7]。晚期胰腺癌患者治疗选择少,通常局限于化疗、姑息手术或射频消融,但治疗效果不甚理想。2010年Stathis等[8]报道使用5-FU或吉他西滨治疗Ⅳ期胰腺癌患者的中位生存期分别为4.41个月和5.65个月。而吉他西滨联合其他疗法的多个研究报道的统计结果却未能证实使患者获益[9,10-13]。因此,寻求新的治疗手段具有重要意义。
氩氦刀冷冻技术是近年兴起的微创肿瘤疗法之一,可作为手术切除的辅助疗法,有效消融肝癌[14-15]、肺癌[16]和前列腺癌[17]等恶性肿瘤。特别是对一些不可手术切除的肿瘤,氩氦刀冷冻治疗能有效地控制局部肿瘤灶,缓解瘤体压迫造成的一些临床症状,提高患者生存质量,延长生存期。随着冷冻外科设备及影像学的发展,经皮冷冻已然成为治疗胰腺癌的有效疗法之一。与传统外科疗法相比,该法可避免开腹带来的风险,减少并发症发生的可能。冷冻治疗的效果取决于能否形成超过肿块边缘1 cm的冰球以杀灭边缘肿瘤细胞。然而,对体积较大且形态不规则,具有侵袭性且邻近重要脏器的肿瘤而言,治疗过程中难以做到既使冰球涵盖达到治疗要求,又将并发症控制在可接受范围内。125I粒子是一种能量放射性核素,其半衰期为60.1 d,组织穿透能力1.7 cm,在CT引导下,将125I粒子植入到冷冻冰球的周边以及冰球不能涵盖的部位,进行三维组织间立体定向局部适形放射治疗,肿瘤靶区高剂量而周围正常组织受量较低,能有效提高治疗效果。与冷冻治疗相配合能更好地控制局部肿瘤灶,降低局部肿瘤复发率。现已有经皮冷冻联合125I粒子治疗胰腺癌的报道,并且获得良好的治疗效果[6、9]。
结果显示,Ⅰ组Ⅳ期胰腺癌患者的平均生存期较Ⅱ组患者长,表明原发与转移灶均行氩氦刀冷冻联合125I粒子植入疗法与原发灶行125I粒子植入、转移灶行氩氦刀冷冻联合125I粒子植入疗法相比具有较大优势。而且,原发与转移灶多次行氩氦刀冷冻联合125I粒子植入疗法的患者术后生存期较单次治疗的患者显著延长。由此可见,多次采用氩氦刀冷冻联合125I粒子植入疗法治疗原发灶与转移灶具有较好的治疗效果。
由于冷冻及125I粒子植入属于局部创伤性治疗手段,术后出现血清淀粉酶升高、血小板减少、腹胀、腹水、发热、感染和腹部出血等不良反应,但均在术后2周内经对症治疗逐步恢复正常,且无严重并发症。此外,大部分患者术后得益于局部病灶的有效控制,疼痛评分明显降低,生存质量得到了明显改善。
[1] Clarke DM, Robilotto AT, VanBuskirk RG, et al. Targeted induction of apoptosis via TRAIL and cryoablation: a novel strategy for the treatment of prostate cancer. Prostate Cancer Prostatic Dis, 2007, 10:175-184.
[2] Stroup SP, Kopp RP, Derweesh IH. Laparoscopic and percutaneous cryotherapy for renal neoplasms. Panminerva Med, 2010, 52:331-338.
[3] 徐克成, 牛立志, 胡以则, 等. 冷冻联合125I粒子植入治疗局部进展性胰腺癌. 中华消化杂志, 2009, 29:260-263.
[4] 李波, 李敬东, 陈晓理, 等. 无法切除的胰腺癌的冷冻手术治疗. 中华肝胆外科杂志, 2004, 10:523-525.
[5] 牛立志, 李海波, 文卫锋, 等. 经皮冷消融治疗局部进展性胰腺癌的可行性. 中华胰腺病杂志, 2011, 11:1-4.
[6] Xu KC, Niu LZ, Hu YZ, et al. Cryosurgery with combination of (125)iodine seed implantation for the treatment of locally advanced pancreatic cancer. J Dig Dis, 2008, 9:32-40.
[7] Alexakis N, Halloran C, Raraty M, et al. Current standards of surgery for pancreatic cancer. Br J Surg, 2004, 91:1410-1427.
[8] Stathis A, Moore MJ. Advanced pancreatic carcinoma: current treatment and future challenges. Nat Rev Clin Oncol, 2010, 7:163-172.
[9] Heinemann V, Boeck S, Hinke A, et al. Meta-analysis of randomized trials: evaluation of benefit from gemcitabine-based combination chemotherapy applied in advanced pancreatic cancer. BMC Cancer, 2008, 8:82.
[10] Colucci G, Giuliani F, Gebbia V, et al. Gemcitabine alone or with cisplatin for the treatment of patients with locally advanced and/or metastatic pancreatic carcinoma: a prospective, randomized phase III study of the Gruppo Oncologia dell'Italia Meridionale. Cancer, 2002, 94:902-910.
[11] Scheithauer W, Schull B, Ulrich-Pur H, et al. Biweekly high-dose gemcitabine alone or in combination with capecitabine in patients with metastatic pancreatic adenocarcinoma: a randomized phase II trial. Ann Oncol, 2003, 14:97-104.
[12] Rocha Lima CM, Green MR, Rotche R, et al. Irinotecan plus gemcitabine results in no survival advantage compared with gemcitabine monotherapy in patients with locally advanced or metastatic pancreatic cancer despite increased tumor response rate. J Clin Oncol, 2004, 22:3776-3783.
[13] Oettle H, Richards D, Ramanathan RK, et al. A phase III trial of pemetrexed plus gemcitabine versus gemcitabine in patients with unresectable or metastatic pancreatic cancer. Ann Oncol, 2005, 16:1639-1645.
[14] Adam R, Majno P, Castaing D, et al. Treatment of irresectable liver tumours by percutaneous cryosurgery. Br J Surg, 1998, 85:1493-1494.
[15] Kuang M, Lu MD, Xie XY, et al. Liver cancer: increased microwave delivery to ablation zone with cooled-shaft antenna-experimental and clinical studies. Radiology, 2007, 242:914-924.
[16] Maiwand MO, Asimakopoulos G. Cryosurgery for lung cancer: clinical results and technical aspects. Technol Cancer Res Treat, 2004, 3:143-150.
[17] Katz AE, Rewcastle JC. The current and potential role of cryoablation as a primary therapy for localized prostate cancer. Curr Oncol Rep, 2003, 5:231-238.
Efficacyofcombinationofpercutaneouscryosurgerywithiodine-125seedimplantationinthetreatmentofstageⅣpancreaticcancer
ZENGJian-ying,CHENJi-bing,YAOFei,LIUWei-qun,LIJia-liang,NIULi-zhi,ZUOJian-sheng,XUKe-cheng.
FudaCancerHospital,MedicalofJinanUniversitySchool,GuangZhou510665,China
Correspondingauthor:LIJia-liang,Email:Email:fudaclab@gmail.com
ObjectiveTo investigate the therapeutic effect of percutaneous cryosurgery combined with iodine-125 (125I) seed implantation on stage Ⅳ pancreatic cancer patients.MethodsEighty-one patients with stage Ⅳ pancreatic cancer were enrolled in this study and divided into two groups according to method of treatment. Group Ⅰ consisted of 50 patients, who underwent percutaneous cryosurgery combined with125I seed implantation therapy for both primary and metastasis tumors. Group Ⅱconsisted of 31 patients, who underwent125I seed implantation therapy for primary sites and cryosurgery combined with125I seed implantation therapy for metastasis tumors. The patients were followed for 2.5 years, and the adverse event rates, median survival time (MST) and the effect of treatment episodes on MST were compared.ResultsThe MST of Group Ⅰ and Ⅱ were 8 and 4 months, and the difference between the two groups was statistically significant (P<0.001). In Group Ⅰ, the MST of patients who received multiple treatments was significantly longer than those received single treatment (11vs. 7 months,P=0.0389). In group Ⅱ, the MST of patients who received multiple therapy was not significantly longer than those received single treatment (4vs. 3 months,P=0.99).ConclusionsCompared with controls who receive125I seed implantation for primary sites and cryosurgery combined with125I seed implantation therapy for metastasis tumors, multiple treatment of percutaneous cryosurgery combined with125I seed implantation in both primary and metastasis tumors can prolong stage Ⅳ pancreatic cancer patients′ survival.
Pancreatc neoplasms; Cryotherapy; Iodine radioisotopes; Treatment outcome
2012-10-25)
(本文编辑:吕芳萍)
10.3760/cma.j.issn.1674-1935.2013.03.005
广东省广州市海珠区产学研重大专项(2011-ZD-02)
510665 广州,暨南大学医学院附属复大肿瘤医院 广州复大肿瘤医院 广州市复大肿瘤冷冻研究所
李家亮,Email:fudaclab@gmail.com
