细胞周期的测定方法
2013-10-18曲笑莹高世勇
曲笑莹,高世勇
(1.哈尔滨商业大学生命科学与环境科学研究中心,哈尔滨150076;2.国家教育部抗肿瘤天然药物工程研究中心,哈尔滨150076)
连续分裂的细胞从上一次有丝分裂结束到下一次有丝分裂完成所经历的整个过程为细胞周期.整个细胞周期可分为间期和有丝分裂期,M期即为有丝分裂期,是染色体真正开始分离时期.间期又可进一步细分为G1期、S期、G2期三个时相.G1期为DNA合成前期,该期是从第一次细胞分裂完成到DNA复制开始之前的间隙时间.有些细胞进入G1期后也可能出现暂不增殖的情况,这种不进入周期的细胞被称为G0期细胞.S期为DNA合成期,在该时相,组蛋白、非组蛋白及各种酶类进行大量的合成.G2期为DNA合成后期,这一时期主要为细胞有丝分裂准备物质条件.
细胞分裂完成一个周期的时间称为细胞的倍增时间,测定细胞倍增时间和各时期时长在研究细胞同步化、细胞动力学、药物在体外作用的前期实验等方面具有重要作用.
1 细胞周期测定应用
1.1 同步化应用
应用CCK-8法测定细胞倍增时间,以确定细胞同步化试剂的给药时长.取培养的JEC细胞进行消化、离心、重悬、计数,接种于96孔板,分成6组.培养24 h后每隔2~4 h加入CCK-8,置于37℃、5%CO2恒温孵育2 h,酶标仪检测吸光度(A)值,直至A值升至基点时A值的2倍,得细胞倍增时间[1].在细胞同步化过程中测定细胞倍增时间可以提高对细胞同步的精确度,使细胞同步率达到更高的水平.
1.2 临床应用
S+G2+M期反映了细胞增殖状态,在白血病治疗前,患者骨髓细胞在S期和G2/M期比例减少[2-3],G0/G1期比例升高,表明白血病细胞增值活性低于正常[4].在临床上测定细胞群体的各时期分布和倍增时间,可以了解细胞DNA含量、细胞增殖等特性,对指导治疗、判断和预后有重要意义.
苑锦英等[5]对肝癌的细胞周期比例与名种常用化疗药物敏感性的关系进行了研究发现,细胞周期的改变与化疗药物的敏感性改变相关.肝癌细胞周期比例与化疗药物抑制率之间有明显关系,各种化疗药物对肝癌抑制率上的差异可以通过肝癌细胞周期比例上的不同需反映出来,对于提高肿瘤的化疗效果具有重要的临床指导意义.
1.3 药代动力学应用
在动物实验中测定细胞倍增时间,有助于对动物细胞动力学方面的研究.高凤鸣等[6]在对小鼠骨髓造血细胞动力学研究的基础上,对大鼠骨髓造血细胞细胞周期及其各有关时相的持续时间进行了研究.
2 总倍增时间测定方法
2.1 生长曲线法
利用生长曲线法测定细胞倍增时间的方法,分为作图法和公式法两种[7],都是通过细胞计数或者其他方法检测每生长24 h的细胞总数绘制细胞生长曲线图.如图1所示.

图1 生长曲线
作图法是从图1中对数期任意两截点所表示的细胞数和变化时间计算出细胞生长速率,从而得出倍增时间.
公式法是通过式(1)计算倍增时间.

其中:Td为倍增时间,Δt为计数间隔天数,Nt为对数生长期任一点的理论观察值,N0为对数生长期理论初始值.但由于细胞计数存在误差,使计算出的每天的倍增时间差异较大,不够精确,目前多采用建立生长曲线的拟合曲线,并用倍增公式推导简化来的公式(2)进行计算,可得到较准确地对数期倍增时间[8].

其中:Td为倍增时间,b1为式(1)简化系数.在实际操作中,细胞生长状态会因外界环境发生一定改变,个人实验操作手法不同导致细胞计数产生误差,都会对结果产生影响,所以计数绘制生长曲线法只能大致计算出细胞的倍增时间,如果想要更精确的结果,还要通过其他方法进行.
2.2 3 H-TdR脉冲标记法
3H-TdR脉冲标记DNA复制和细胞分裂指数观测法,是最经典的测定细胞周期各时相时间的方法[9],它是利用3H-TdR(胸腺嘧啶核苷)掺入DNA和放射自显影计数,通过在体外采用3H标记的胸腺嘧啶核苷酸脉冲标记,随后,每个一定时间取样做细胞放射自显影,找出正处于有丝分裂的细胞,计算其中带有3H标记的细胞占有丝分裂细胞的百分比,绘制曲线,即可大致确定细胞倍增时间.此方法适用于细胞运行时间短,周期运转均匀的细胞群体.
3H-TdR脉冲标记法需要用到放射性同位素,对细胞周期有一定影响,且在细胞群类较为复杂时不适用.由于放射性同位素在实验中易造成污染,所以此法目前使用较少.
2.3 BrdU掺入联合流式细胞术法
通过测定S期细胞比例及S期持续时间,求得细胞倍增时间[10].在培养的细胞中掺入5-溴脱氧尿嘧啶核苷(BrdU,可代替胸腺嘧啶掺入S期细胞),在特定时间点通过流式细胞术检测S期细胞比例,通过观察S期细胞比例的增长趋势和线性关系的改变,确定S期持续时间.认为细胞进入和流出S期速率相同,则TS/S%=Tc(Tc为倍增时间).
由于流式细胞术操作简便,结果相对准确全面,目前应用其测定细胞周期较多.
2.4 MTT法/CCK-8法
MTT分析法以活细胞代谢物还原剂MTT噻唑蓝为基础,生成仅活细胞可产生的蓝色结晶,在DMSO中溶解,利用酶标仪测定OD值,反映出活细胞数目.接种孔板后,当细胞生长到对数期,用MTT比色法测定起始OD值,24 h后取特定时间点检测,当OD值为起始OD值2倍时即为倍增时间.CCK-8法是MTT升级方法,所用试剂相比MTT更易操作,更稳定,灵敏度更高.检测方法与MTT法类似[1].
此类方法操作简单,灵敏度高、经济,但可能由于如操作不熟练、DMSO细胞毒性、结晶易被洗去等原因,导致结果波动较大.
3 各时期测定方法
3.1 3 H-TdR标记放射自显影
通过测定有丝分裂百分比的变化可以推断各个时相的长度,推断如图2所示[11].
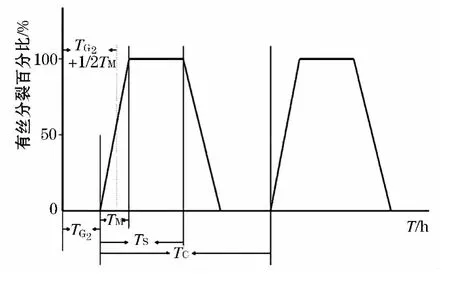
图2 放射自显影法推断周期
3.2 作图法
应用作图法推断各时相长度需要得到以下四个数据[12]:1)细胞倍增时间;2)有丝分裂指数;3)S期细胞百分比;4)G2期持续时间.设定细胞进入和流出各时期的速率相同,在第一象限中作任意与x轴和y轴相交的直线,得到以上数据后作图,结果如图3所示.

图3 作图法推断周期
根据各时相对应点找到对应到x轴上的时间点,从而得出个时相时长.
3.3 S期时长测定
细胞培养中掺入BrdU分别于连续增长的时间点收集细胞经处理后通过流式细胞术测定S期细胞含量[13],作图4.

图4 S期时长测定
设定细胞流入和流出S期的速率相同,通过S期细胞增长所成直线的延长线与x轴相交,交点的绝对值即为S期的时长.
4 结语
细胞倍增时间和各时相时长的测定,作为一项基础实验,越来越被愈加严谨的实验体系所重视,并且随着技术手段的不断提高,更精确、简便的方便被用于实验中.
目前出现的方法中,如CCK-8法、MTT法、生长曲线法具有操作简便的优点,但在操作过程中由于细胞丢失、计数等方面存在误差,可能会对测定结果造成影响.3H-TdR脉冲标记法由于容易出现污染,已逐渐淘汰,被BrdU掺入联合流式细胞术法所取代.流式细胞术在近几年的研究中使用逐渐增多,技术的革新使流式细胞仪的使用更加人性化,实验过程操作简便,系统简单易懂,数据的后期处理更加灵活全面.BrdU掺入联合流式细胞术法能够在短时间内精确地测定出细胞倍增时间,并通过其他条件,推断出各个时相的时长,是目前比较常用的测定细胞周期的方法.在实验室过程中,可依据实验条件、实验要求精确度来选择细胞周期测定方法.
[1]沈慧敏,李小毛,杨越波,等.洛伐他汀诱导人子宫内膜癌JEC细胞G1期同步化的研究[J].中国病理生理杂志,2012,28(5):791-795.
[2]RAZA A,BOKHARI J,YOUSOF N,et al.Cell cycle kinetic studies in human cancers:development of three DNA-specific labels in three decades[J].Arch Pathol Lab Med,1991,115(9):873.
[3]梁英民,张盈华,林 榕,等.流式细胞仪测定成人急性白血病患者DNA含量的临床意义[J].第四军医大学学报,1996,17(3):206-208.
[4]袁宇宁,刘国勋,杨 勤,等.成人白血病患者DNA含量及细胞周期测定的临床意义[J].广东医学,1999,20(12):939-940.
[5]苑锦英,董荣春,于宏宇.人体肝癌细胞周期FCM测定与化疗药物敏感性关系的研究[J].癌症,1993,12(3):207-209.
[6]高凤鸣,于雁南,蒋涵英.骨髓造血细胞动力学研究——大鼠骨髓造血细胞的细胞周期测定[J].解剖学报,1984,15(2):185-188,234.
[7]司徒镇强,吴军正.细胞培养[M].西安:世界图书出版社,1996:1-2.
[8]严泉剑,郭金龙,刘恩靖,等.绘制细胞生长曲线及细胞群体倍增时间的简化计算[J].前卫医药杂志,2000,17(4):228-229.
[9]胡晓华.关于细胞周期测定问题的解答[J].教学月刊:中学版,2011(4):49-52.
[10]RUSTEM U,ISABELLE C,MICHEL P,etal.Cell cycle analysis and synchronization of the xenopus cell line XL2[J].Experimental Cell Research,1998,242(1):60-68.
[11]NIAS A,FOX M.Synchronization of mammalian cells with respect to the mitotic cycle[J].Cell Tissue Kinet,1971,4(4):375-98.
[12]OKADA S.A simple graphic method of computing the parameters of the life cycle of culturedmammalian cells in theexponential growth phase[J].Journal of Cell Biology,1967,34(3):915-916.
[13]SASAKI K,MURAKAMI T,TAKAHASHIM.A rapid and simple estimation of cell cycle parameters by continuous labeling with bromodeoxyuridine[J].Cytometry,1987,8(5):526-528.
