急性脑梗死患者卒中亚型与血清高敏C反应蛋白和糖化血红蛋白的关系
2013-10-18郭正良辛晓瑜曾丽莉刘建荣
郭正良 傅 毅 辛晓瑜 曾丽莉 刘建荣
对于缺血性脑卒中的分型TOAST是被广泛应用的病因学分型标准,它对缺血性脑卒中的治疗和预防均具有重大的指导意义[1]。2005年美国对TOAST进行了改良,称为SSS-TOAST,并被广泛应用于临床[2]。SSS-TOAST虽然比较先进,但需要做的检查项目比较多,费用比较贵,对于发展中国家负担较重,所以我们在探索能否有价廉物美的血液生化学指标与TOAST产生一定的相关性,从而应用于临床。超敏C反应蛋白(hs-CRP)是由肝脏产生的一种急性时相蛋白,在缺血性脑卒中患者中明显升高,同时大量研究显示hs-CRP与动脉粥样硬化斑块的不稳定性密切相关34。糖化血红蛋白(HbA1C)能够反映患者2个月左右的血糖控制情况,而血糖的升高又与微血管的病变密切相关[5]。本 研 究 通 过 探 讨 hs-CRP和 HbA1C 与 SSSTOAST各个亚型之间的关系来帮助临床治疗缺血性脑卒中。
1 对象与方法
1.1 对象 选取本院2011年2月~2011年11月住院的急性缺血性脑卒中患者170例,其中男性92例,女性78例,年龄46~80岁,平均年龄(67.48±8.14)岁,入选标准:(1)发病时间在6~48 h;(2)诊断均符合1995年中华医学会第四届全国脑血管病学术会议修订的急性脑梗死诊断标准,并经头颅CT或MRI扫描证实有梗死灶。排除标准:(1)严重感染或恶性疾病;(2)4周内有潜在的感染的症状和体征;(3)自身免疫性疾病活动期;(4)肝肾功能不全和心功能衰竭。
1.2 指标检测 入院后给予常规检查、心电图检查、心脏超声检查、头颅血管的MRA或CTA检查,并且在发病72 h内取血液标本3 ml,送本院检验科,用免疫浊度法测定高敏C反应蛋白(hs-CRP)的浓度,用高压液相法测定糖化血红蛋白(HbA1C)的浓度
1.3 根据美国最新的SSS-TOAST分型标准,结合相应的辅助检查,把170例患者分为5个类型:大动脉粥样硬化性脑卒中(LAA)、心源性脑栓塞(CE)、小动脉闭塞性脑卒中(SAO)、其他确定病因引起的缺血性脑卒中(SOE)和原因不明的缺血性脑卒中(SUE)。 其 中 LAA 66 例 (38.8%)、CE 23 例(13.5%)、SAO41例(24.1%)、SOE11例(6.5%)和SUE29例(17.1%)。
1.4 统计学处理 采用SPSS17.0软件,数据用均数±标准差(±s)表示,组间用单因素方差分析,并进行方差齐性检验,以P<0.05表示差异有统计学意义。
2 结 果
2.1 LAA组和SUE组患者血液中的高敏C反应蛋白(hs-CRP)的浓度高于其余3组(P<0.05),而LAA组又高于SUE组(P<0.05);其余3组患者血液中的hs-CRP的浓度差异不明显(P>0.05)(表1)。
2.2 SAO组患者血液中的糖化血红蛋白(HbA1C)的浓度高于其余4组(P<0.05),其余4组患者血液中的HbA1C的浓度差异(P>0.05)(表1)。
表1 各组CRP和HbA1C浓度比较(±s)
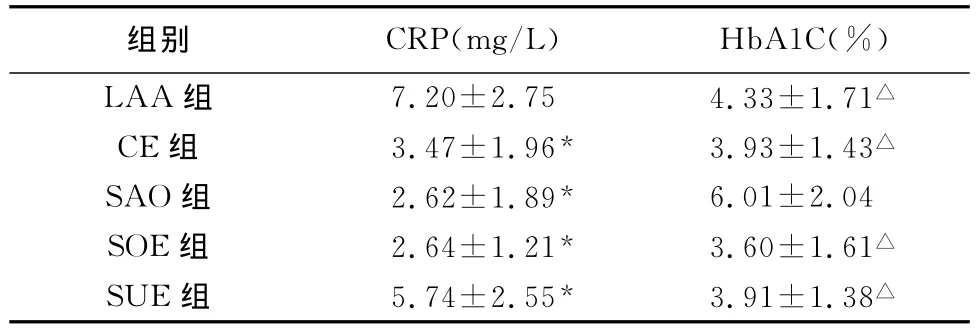
表1 各组CRP和HbA1C浓度比较(±s)
注:与LAA组比较,*P<0.05;与SAO组比较,△P<0.05
组别 CRP(mg/L) HbA1C(%)LAA组 7.20±2.75 4.33±1.71△CE组 3.47±1.96* 3.93±1.43△SAO组 2.62±1.89* 6.01±2.04 SOE组 2.64±1.21* 3.60±1.61△SUE组 5.74±2.55* 3.91±1.38△
3 讨 论
目前对于缺血性脑卒中的治疗已经进入了病因学的阶段,不同的病因不仅治疗方法不同,预后和预防方法也不尽相同。TOAST从1993年推出并应用于临床以来已经广泛得到大家的认同[1]。2005年Ay等对TOAST进行了改良,称为SSSTOAST,它把缺血性脑卒中分为5种类型:大动脉粥样硬化性脑卒中(LAA)、心源性脑栓塞(CE)、小动脉闭塞性脑卒中(SAO)、其他确定病因引起的缺血性脑卒中(SOE)和原因不明的缺血性脑卒中(SUE),每型又分为肯定、很可能和可能3种[2]。SSS-TOAST合理地权衡了TOAST分类中的多重病因,减少了病因不明分类的比例,也考虑了大动脉粥样硬化狭窄程度和斑块性质的双重因素,从而减少了对大动脉粥样硬化引起的缺血性脑卒中的漏诊,所以研究者之间的一致性增加,使得临床操作更为有效[6]。但同时要进行完整的分型需要一系列血液生化学检测和多种辅助检查,时间长并且费用高,对仪器设备的要求也比较高,对于发展中国家和不富裕人群来说负担较重。如何既能享受到SSSTOAST带来的益处,同时花费又比较合理呢?本研究通过检测一些血液生化指标与SSS-TOAST进行相关性研究,来探讨它们可能存在的相关性。
CRP是由肝脏产生的一种急性时相蛋白,急性缺血性脑卒中患者CRP水平明显升高。许多学者认为动脉粥样硬化实际上是一个炎性反应过程,缺血性脑卒中急性期反应以IL-6的激活为标志,诱导产生应激蛋白(如CRP、纤维蛋白、淀粉样蛋白A),引起炎性反应,动脉内膜的局部炎性反应可引起内膜增厚和斑块破裂,导致脑血管病的发生[7]。同时CRP与凝血纤溶系统也密切的关系,CRP可使主动脉的内皮细胞产生较高水平的纤溶酶原抑制剂(PAI),引起动脉内皮的损伤,最终导致血栓形成,并且CRP可使白细胞释放蛋白酶,导致纤维帽破裂引起血栓的形成[8,9]。CRP还能促进粘附因子的释放,后者是启动动脉粥样硬化的关键步骤,可导致白细胞粘附并穿过内皮层,加速动脉粥样硬化[8,10]。本研究发现急性缺血性卒中的LAA组和SUE组患者血液中的hs-CRP浓度明显高于其余3组,而且LAA组又高于SUZ组,这也正确反映了此两种分型的主要病因就是动脉粥样硬化斑块及其不稳定的状态,斑块的脱落和出血直接导致了急性缺血性卒中的发生。而CRP作为急性炎症的检测指标与此型具有较好的相关性,同时CRP的检测较为简便,费用较为合理,所以CRP可以作为动脉粥样硬化型初步筛选的生化学指标。
糖尿病的脑血管病变表现在毛细血管管壁基底膜增厚以及深部白质动脉粥样硬化病变,基底膜糖类沉积、脂肪样变性和透明样变性,微血管内皮细胞功能失调,甚至继发血管狭窄闭塞[11]。同时糖尿病患者脑血流的自动调节功能受损,使局部脑血流下降。过高的血糖还可加重脑细胞损伤,造成脑细胞缺血坏死[12]。另外长期高血糖可引起血液流变学的异常,致细胞聚集功能增强,变形能力减弱,纤维蛋白原增多,使血流处于高粘、高凝状态而加重微循环障碍,最终促成了糖尿病易于发生脑梗死的因素[13,14]。在上述基础上糖尿病并发脑血管病以脑梗塞为主,而且以腔隙性脑梗死常见,极易产生广泛的微小血管病变,造成多部位脑梗死。本研究发现急性缺血性脑卒中SAO组患者的糖化血红蛋白的浓度明显高于其余4组,这可能与高血糖更容易发生微血管病变有关,且通过检测患者血中糖化血红蛋白的浓度不仅可以了解患者近来2-3个月血糖控制的情况,而且还可以初步筛选小血管型的急性缺血性脑卒中患者,为临床分型提供依据。
综上所述,本研究发现hs-CRP的浓度可能与动脉粥样硬化斑块的不稳定性相关,HbA1C的浓度可能与小血管病变相关,虽然通过测定hs-CRP和HbA1C的浓度无法完全取代SSS-TOAST分型,但可以有助于SSS-TOAST分型的研究,从而不仅可以节省有限的医疗费用,而且还可以推广SSSTOAST在临床的应用,从而使更多的患者受益。
1 Adams HP Jr,Bendixen BH,Kappelle LJ,et al.Classification of subtype of acute ischemic stroke.Definitions for use in a multicenter clinical trial.TOAST.Trial of Org 10172 in Acute Stroke Treatment.Stroke,1993,24(1):35-41.
2 Ay H,Furie KL,Singhal A,et al.An evidence-based causative classification system for acute ischemic stroke.Ann Neurol,2005,58(5):688-697.
3 Corrado E,Rizzo M,Coppola G,et al.An update on the role of markers of inflammation in atherosclerosis.J Atheroscler Thromb,2010,17(1):1-11.
4 Andersson J,Johansson L,Ladenvall P,et al.C-reactive protein is a determinant of first-ever stroke:prospective nested casereferent study.Cerebrovasc Dis,2009,27(6):544-551.
5 Katagiri S,Nitta H,Nagasawa T,et al.Multi-center intervention study on glycohemoglobin(HbA1c)and serum,high-sensitivity CRP (hs-CRP)after local anti-infectious periodontal treatment in type 2 diabetic patients with periodontal disease.Diabetes Res Clin Pract,2009,83(3):308-315.
6 Ay H,Benner T,Arsava EM,et al.A computerized algorithm for etiologic classification of ischemic stroke:the Causative Classification of Stroke System.Stroke,2007,38(11):2979-2984.
7 Calabro P,Golia E,Yeh ET.CRP and the risk of atherosclerotic events.Semin Immunopathol,2009,31(1):79-94.
8 Li JJ,Ren Y,Chen KJ,et al.Impact of C-reactive protein on instent restenosis:a meta-analysis.Tex Heart Inst J,2010,37(1):49-57.
9 Zakynthinos E,Pappa N.Inflammatory biomarkers in coronary artery disease.J Cardiol,2009,53(3):317-333.
10 Hemingway H,Philipson P,Chen R,et al.Evaluating the quality of research into a single prognostic biomarker:a systematic review and meta-analysis of 83 studies of C-reactive protein in stable coronary artery disease.PLoS Med,2010,7(6):e1000286.
11 Vigili de Kreutzenberg S,Tiengo A,Avogaro A.Cerebrovascular disease in diabetes mellitus:the role of carotid intima-media thickness.Nutr Metab Cardiovasc Dis,2009,19(9):667-673.
12 Menon U,Kelley RE.Subcortical ischemic cerebrovascular dementia.Int Rev Neurobiol,2009,84:21-33.
13 Bui QT,Prempeh M,Wilensky RL.Atherosclerotic plaque development.Int J Biochem Cell Biol,2009,41(11):2109-2113.
14 Stratmann B,Tschoepe D.Atherogenesis and atherothrombosis-focus on diabetes mellitus.Best Pract Res Clin Endocrinol Metab,2009,23(3):291-303.
