8周有氧运动对单纯性肥胖患者运动后收缩压恢复、体成分和运动能力的影响
2013-10-18常颖,陈磊,朱荣
常 颖,陈 磊,朱 荣
研究证实,肥胖是心血管疾病的独立危险因素,与高血压、脂代谢紊乱、II型糖尿病、某些肿瘤以及睡眠呼吸暂停综合征等多种疾患密切相关,而且,肥胖的程度与死亡率呈正相关[29]。此外,肥胖患者心肺功能下降,运动耐力降低[7],活动量增大时易出现疲劳、缺氧和心悸症状,加之平衡能力、柔韧性和灵活性下降,严重影响患者的生活质量。肥胖患者运动时的血压反应显著高于正常体重者[10],但运动后恢复期血压的变化鲜有关注。运动后收缩压恢复(post-exercise systolic blood pressure recovery,PESBPR)是指在力竭运动后收缩压下降的速率,通常以运动后第3 min的收缩压与运动后第1min收缩压的比值(第3min收缩压恢复比,the third minute systolic blood pressure recovery ratio,rSBPR)作为PESBPR的指标。若rSBPR>1.0,则定义为PESBPR延迟[22]。研究证实,PESBPR延迟是诸多心血管疾患,如冠心病[8]、中风[19]、高血压[2]和急性心梗[20]的敏感预测指标。本研究前期的研究显示,肥胖/超重患者rSBPR和PESBPR延迟发生率明显高于体重正常者,初步揭示了PESBPR与肥胖/超重的关系[1]。本研究旨在观察8周有氧运动干预对单纯性肥胖患者PESBPR、体成分以及运动能力的影响,并探讨PESBPR与体成分、运动能力的关系。
1 研究对象与方法
1.1 研究对象
招募郑州市某社区的志愿者,通过门诊病历、问卷调查了解病史、服药史和吸烟史。纳入标准:1)成年单纯性肥胖患者(体脂百分比:男>20%,女>30%);2)医生建议可以参加本实验;3)依从性好,能够坚持完成运动测试和训练计划。排除标准:1)继发性肥胖(库欣综合征、原发性甲状腺功能减退症、下丘脑性肥胖、多囊卵巢综合症等)和药物引起的肥胖(抗精神病药、糖皮质激素等);2)各种心血管疾病(冠心病、高血压、瓣膜病、心肌病、外周血管疾病等)、糖尿病、血脂异常;3)长期吸烟、酗酒和服药者;4)有中风史、心脏病发作史以及其他严重疾患的病例;5)3个月内有规律运动习惯者(每周2次以上,每次20min以上);6)下肢骨关节疾病不能完成跑台实验以及有运动禁忌征者。符合上述标准的肥胖患者共87人(年龄:30~45岁),按1∶2随机分为两组,即对照组(n=29)和运动组(n=58),运动组进行为期8周的有氧运动,对照组保持日常生活习惯。
1.2 样本量与受试者一般情况
由于各种原因(罹患疾病、未完成测试以及不能坚持运动处方等)退出本实验者共24人(运动组23人,对照组1人),因此,最终进行统计分析的样本量n=63(运动组:n=35,对照组:n=28)。两组患者性别、年龄、身高、体重、BMI、心率、血压、体成分和运动能力等各项指标差异无统计学意义(均为P>0.05),具有可比性(表1)。
1.3 体成分测量
实验开始前一天和实验结束后一天,清晨空腹状态下采用双能 X-线吸收仪(dual-energy X-ray absorptiometry,DXA;Lunar Prodigy,美国)进行体成分测定,每日测量前,用标准体模校正后进行,精确度<1%,准确度>98%。检测程序:嘱受试者脱去外衣、鞋及所有可能影响结果的物品(手表、手机、纽扣等金属物体),仰卧于扫描床中央,人体中线与扫描床中线平行,进行全身扫描。主要观察指标:脂 肪 重 量 (fat mass,FM)、去 脂 体 重 (fat-free mass,FFM)和体脂百分比(percentage of body fat,BF%)。
1.4 症状限制性递增负荷运动实验测试运动后收缩压恢复和运动能力
所有受试者在实验前24h内清淡饮食,避免剧烈运动。利用Monark 839E型功率自行车(瑞典)进行症状限制性递增负荷运动实验。整个过程在心电监护以及两名急诊科医生陪同下进行。安静坐位休息15min后测定安静时的血压(SUN TECH-420自动血压仪,美国)和安静心率(rest heart rate,RHR),进行10min准备活动后,适应性蹬车1min(20W),随后进行正式实验:起始负荷为30 W,每2min递增30W,保持60rpm的转速。用运动心肺测试系统(Cortex MetaLyzerⅡ,德国)测定耗氧量()、CO2呼出量(CO2)、呼吸交换律(RER)等,用遥测心率表(Polar FS1,芬兰)记录心率。实验中,每2min(即每级负荷)测定1次血压、心率以及氧参数。终止实验的标准:1)RER>1.0;2)运动中最大心率达到最大预测心率的90%以上(最大预测心率计算公式:HRmax=208-0.7×年龄)[25];3)心电图显示ST段抬高或压低超过2mm;4)受试者不能坚持预定负荷并主动要求停止实验。峰值持续超过30s即可认为达到max,同时记录最大功率(maximal power,MP)和力竭时间(exhaust time,ET)。实验结束后嘱受试者坐位,立刻(1min内)测量血压,之后每隔1min测定1次,直到血压恢复至安静水平,计算运动后第3min的收缩压与运动后第1min收缩压的比值(即rSBPR)[14]。若该比值>1.0,定义为 PESBPR延迟[22]。

表1 本研究受试者基本情况一览表Table 1 Baseline Characteristics of the Subjects
1.5 有氧运动处方的制定
运动处方的实施时间共8周,每次均在17:00~18:00进行,具体安排:1)运动方式:有氧健身跑;2)运动频率:4次/周,分别在周一、周三、周四和周六进行;3)运动时间:60min/次,其中热身10min,基本部分40min,整理活动10min;4)运动强度:前2周运动强度为50%~60%max对应的心率(佩戴心率表),后6周为60%~75%max对应的心率,受试者在运动中根据提前设定的心率范围及时调整运动强度。整个过程由具有丰富经验的体育教师和科研工作者对训练过程进行严格监控并记录训练日志,每周由专门人员收集1次,同时,通过健康教育等方法提高受试者依从性。
1.6 统计学分析
2 结果
2.1 rSBPR与体成分和运动能力的关系
通过校正相关变量(性别、年龄、身高、体重、BMI、心率、血压等)后,对rSBPR与体成分和运动能力各变量进行偏相关分析,结果发现(表2),rSBPR与BF%正相关(r=0.412,P<0.01),与max、MP和 ET 均呈负相关(分别为r=-0.475,P<0.01;r=-0.366,P<0.01;r=-0.308,P<0.01)。

表2 本研究受试者rSBPR与体成分和运动能力的偏相关分析一览表Table 2 Partial Correlation Analysis of rSBPR and Body Composition,Exercise Capacity
2.2 有氧运动前后SBP、rSBPR与体成分和运动能力的变化
实验后,运动组安静 SBP(P<0.05)、SBPmax(P<0.01)、rSBPR(P<0.05)和PESBPR延迟发生率(P<0.01)均低于实验前,对照组无显著性变化(均为P>0.05);运动组实验后的收缩压在递增负荷运动实验后第7min恢复至安静水平,运动组实验前以及对照组实验前、后收缩压均在递增负荷运动实验后第11min恢复至安静值(图1、表3)。
8周有氧运动干预后,与运动前比较,运动组体重(P<0.05)、BMI(P<0.05)、FM(P<0.01)和 BF%(P<0.01)下降,max(P<0.05)、最大功率(P<0.05)和力竭时间(P<0.01)增加;对照组各指标均无显著性变化(均为P>0.05;表3)。
本研究同时计算了运动组实验前、后rSBPR变化与体成分、运动能力变化的相关系数,结果显示,rSBPR变化与BF%变化的相关系数r=0.315(P<0.01),与max的变化负相关(r=-0.338,P<0.01)。
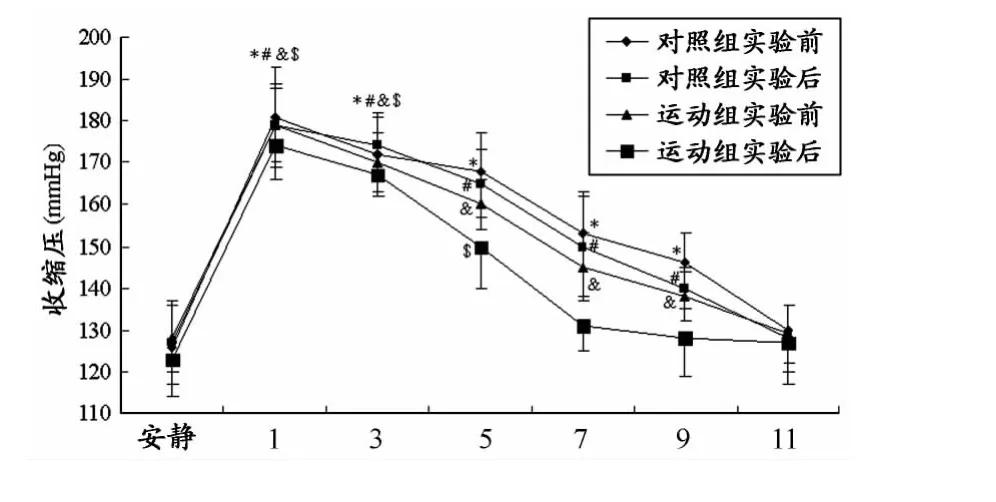
图1 本研究受试者各组收缩压变化曲线图Figure 1.Changes of Systolic Pressure in Each Group

表3 本研究受试者有氧运动前、后rSBPR、体成分和运动能力变化一览表Table 3 Changes of rSBPR,Body Composition and Exercise Capacitybefore and after Aerobic Exercise
3 讨论
本研究对单纯性肥胖患者PESBPR与体成分和运动能力的关系进行探讨并发现,rSBPR与BF%正相关,与运动能力负相关,这种相关在校正了其他变量后仍具有统计学意义。经过8周有氧运动后,运动组rSBPR、PESBPR延迟发生率和BF%下降、运动能力提高,而对照组则无显著性变化。
3.1 肥胖患者PESBPR与体成分、运动能力的关系
研究发现,症状限制性递增负荷运动实验后第3min的收缩压与运动后第1min收缩压的比值(rSBPR)[22]是诊断和预测心血管疾病(如冠心病[8]、中风[19]、高血压[2]和急性心梗[20]等)及其严重程度的重要辅助指标[5]。由于肥胖是心血管疾病及其死亡率的独立危险因素,因此推测,rSBPR可能与肥胖存在关联,本研究前期的研究对此进行了初探并发现肥胖/超重患者rSBPR以及PESBPR延迟发生率明显高于体重正常者,肥胖/超重的男性和女性发生PSBPR延迟的危险性分别是正常体重者的8.0倍和4.6倍[1]。肥胖的主要诊断标准是BMI和BF%,而利用DXA测定BF%则是诊断肥胖的金标准[3]。本研究发现,rSBPR与BF%呈正相关(r=0.412,P<0.01),进一步证实了rSBPR、PESBPR延迟与肥胖的关系。这种关联的具体机制尚不明确,可能与自主神经功能失衡有关。有研究发现,PESBPR延迟可能是由于交感神经系统过度兴奋以及副交感神经功能减弱造成的[20]。近期的研究指出,肥胖患者脂肪过度堆积,脂肪组织通过分泌脂肪因子(如脂联素、TNF-α、瘦素等)诱导交感神经活动过度(sympathetic over-activity),造成血容量和血管张力增加、心脏负荷加重以及发生胰岛素抵抗和代谢紊乱[27],从而影响运动中和运动后的血压反应;同时,交感神经活动过度又可促进体重增加[28],两者互为因果,形成恶性循环。此外,动脉压力反射是维持循环功能和血压稳定最重要的神经调节机制,以负反馈方式抑制交感神经活动。动脉压力反射敏感性是反映心血管自主神经功能的重要指标,动脉压力反射敏感性改变可影响运动血压反应[17]。肥胖患者由于动脉压力反射敏感性下降[12],引起交感神经活动长时间增强,外周血管收缩和外周阻力增加,造成运动后血压恢复减慢。因此,肥胖患者交感神经过度兴奋、动脉压力敏感性降低以及外周阻力增加是rSBPR升高的重要原因。
由于肥胖[24]和心肺适能低下[18]均是心血管疾患的重要危险因子,而本研究中,rSBPR与表征肥胖的指标BF%显著正相关,与表征心肺适能的指标max显著负相关,说明rSBPR可能是肥胖患者可调控的心血管危险因素。同时也提示,肥胖人群应积极采取措施(如长期规律的体育锻炼)减轻体重,提高心肺耐力,降低PSBPR延迟以及心血管事件的发生率。
3.2 有氧运动对单纯性肥胖患者rSBPR、体成分和运动能力的影响
众多随机对照实验以及荟萃分析均证实,长期规律的有氧运动可有效改善肥胖患者的体成分并提高有氧运动能力,减少心血管危险因素和不良事件的发生。本实验证实了前人的研究结论,即运动组经过8周有氧运动后,FM、BF%下降,运动能力(max、最大功率和力竭时间)提高。有氧运动对肥胖患者rSBPR的研究未见报道,本研究发现,实验后运动组安静时的SBP和SBPmax下降,更为重要的是,表征心血管危险因素的指标——rSBPR以及PESBPR延迟发生率均降低,而对照组则无显著性变化。运动影响PESBPR的机制尚不明确,本研究实验前、后运动组rSBPR的变化与BF%正相关(r=0.315,P<0.01),与max的变化负相关(r=–0.338,P<0.01),提示,有氧运动可能通过改善体成分并提高运动能力,最终对PESBPR产生了良性效应。其具体机制包括:1)肥胖患者交感神经过度兴奋和动脉压力敏感性降低是rSBPR升高的重要原因。研究指出,体重减轻可改善自主神经功能(降低交感神经活动并增加迷走调制)[26]。因此,有氧运动通过改善体成分进而抑制交感神经过度兴奋。此外,长期规律的有氧运动还可以提高动脉压力敏感性,从而改善心血管系统的神经调节功能[4,6,15],外周阻力下降,动脉顺应性增加[21],rSBPR随之下调。2)肥胖患者有氧能力下降是rSBPR升高的另一重要因素。研究发现,运动可促进血管内皮细胞分泌一氧化氮(NO)[11],NO具有改善血管内皮功能[32]、舒张血管、降低外周阻力和心脏负荷[30]、增加组织摄氧量[32]、提高心肌[16]和骨骼肌[23]收缩力等作用;补 充L-精氨酸(NO前体)可明显延长力竭运动时间,推迟疲劳发生[9]。因此,运动诱导的NO提高了肥胖患者的有氧能力,从而下调rSBPR。
4 结论
rSBPR与BF%正相关,与运动能力负相关,rSBPR可能是肥胖患者可调控的心血管危险因素;8周有氧运动可显著改善肥胖患者体成分,提高有氧运动能力,下调rSBPR及PESBPR延迟发生率。本研究结果进一步提示,肥胖患者应坚持规律的有氧运动,控制体重,降低rSBPR,避免心血管不良事件的突发。
[1]陈磊,施曼莉.运动后收缩压恢复与单纯性肥胖(超重)的关系[J].体育学刊,2012,19(4):134-139.
[2]黄海云,姚雨凡.高血压病患者运动血压与动态血压关系的研究[J].中华心血管病杂志,2003,31(5):32-35.
[3]雷茂岭,李涛.DEXA 与肥胖症[J].中国现代临床医学,2007,6(7):35-37.
[4]潘燕霞,王玮.运动训练改善心力衰竭大鼠动脉压力反射功能[J].中国病理生理杂志,2010,26(1):59-63.
[5]沈毅,沈爱东,李虹伟,等.心电图平板运动试验阳性患者运动后收缩压恢复延迟与冠状动脉病变程度相关性研究[J].心肺血管病杂志,2008,27(5):268-271.
[6]王松涛,樊晨光.有氧运动对自发性高血压大鼠自主神经失衡状态的影响[J].体育科学,2010,30(11):56-61.
[7]王向东,刘荣华,马宝娟,等.内脏脂肪含量对青年肥胖女性心肺功能及有氧运动能力的影响[J].现代预防医学,2010,37(10):1907-1909.
[8]周纪宁,左进,陈芳,等.活动平板试验中收缩压恢复比对冠心病的预测价值[J].心血管康复医学杂志,2010,19(2):210-212.
[9]BAILEY S J,WINYARD P G,VANHATALO A,et al.Acute L-arginine supplementation reduces the O2cost of moderate-intensity exercise and enhances high-intensity exercise tolerance[J].J Appl Physiol,2010,109(5):1394-1403.
[10]CARLETTI L,RODRIGUES A N,PEREZ A J,et al.Blood pressure response to physical exertion in adolescents:influence of overweight and obesity[J].Arq Bras Cardiol,2008,91(1):24-30.
[11]DA SCA,RIBEIRO J P,CANTO J C,et al.High-intensity aerobic training improves endothelium-dependent vasodilation in patients with metabolic syndrome and type 2diabetes mellitus[J].Diabetes Res Clin Pract,2012,95(2):237-245.
[12]DAVIS G.Baroreflex and somato-reflex control of blood pressure,heart rate and renal sympathetic nerve activity in the obese Zucker rat[J].Exp Physiol,2011,96(7):623-634.
[13]DE LIMA S G,DE ALBUQUERQUE MDE F,DE OLIVEIRA J R,et al.Exaggerated blood pressure response during exercise treadmill testing:functional and hemodynamic features,and risk factors[J].Hypertens Res,2012,35(7):733-738.
[14]DIMKPA U,UGWU A C.Influence of age on blood pressure recovery after maximal effort ergometer exercise in non-athletic adult males[J].Eur J Appl Physiol,2009,106(6):791-797.
[15]FUKUMA N,KATO K,MUNAKATA K,et al.Baroreflex mechanisms and response to exercise in patients with heart disease[J].Clin Physiol Funct Imaging,2012,32(4):305-309.
[16]HAMMOND J,BALLIGAND J L.Nitric oxide synthase and cyclic GMP signaling in cardiac myocytes:from contractility to remodeling[J].J Mol Cell Cardiol,2012,52(2):330-340.
[17]HESSE C,CHARKOUDIAN N,LIU Z,et al.Baroreflex sensitivity inversely correlates with ambulatory blood pressure in healthy normotensive humans[J].Hypertension,2007,50(1):41-46.
[18]KODAMA S,TANAKA S,HEIANZA Y,et al.Association between physical activity and risk of all-cause mortality and cardiovascular disease in patients with diabetes:a meta-analysis[J].Diabetes Care,2013,36(2):471-479.
[19]KURL S,LAUKKANEN J A,RAURAMAA R,et al.Systolic blood pressure response to exercise stress test and risk of stroke[J].Stroke,2001,32(9):2036-2041.
[20]LAUKKANEN J A,KURL S,SALONEN R,et al.Systolic blood pressure during recovery from exercise and the risk of acute myocardial infarction in middle-aged men[J].Hypertension,2004,44(6):820-825.
[21]LU X,HUI-CHAN C W,TSANG W W.Effects of Tai Chi training on arterial compliance and muscle strength in female seniors:a randomized clinical trial[J].Eur J Prev Cardiol,2013,20(2):238-245.
[22]MCHAM S A,MARWICK T H,PASHKOW F J,et al.Delayed systolic blood pressure recovery after graded exercise:an independent correlate of angiographic coronary disease[J].J Am Coll Cardiol,1999,34(3):754-759.
[23]MERRY T L,LYNCH G S,MCCONELL G K.Downstream mechanisms of nitric oxide-mediated skeletal muscle glucose uptake during contraction[J].Am J Physiol Regul Integr Comp Physiol,2010,299(6):R1656-1665.
[24]ORTEGA F B,LEE D C,KATZMARZYK P T,et al.The intriguing metabolically healthy but obese phenotype:cardiovascular prognosis and role of fitness[J].Eur Heart J,2013,34(5):389-397.
[25]PINKSTAFF S,PEBERDY M A,KONTOS M C,et al.Quantifying exertion level during exercise stress testing using percentage of age-predicted maximal heart rate,rate pressure product,and perceived exertion[J].Mayo Clin Proc,2010,85(12):1095-1100.
[26]SJOBERG N,BRINKWORTH G D,WYCHERLEY T P,et al.Moderate weight loss improves heart rate variability in overweight and obese adults with type 2diabetes[J].J Appl Physiol,2011,110(4):1060-1064.
[27]SMITH M M,MINSON C T.Obesity and adipokines:effects on sympathetic overactivity[J].J Physiol,2012,590(Pt 8):1787-1801.
[28]SOROF J M,POFFENBARGER T,FRANCO K,et al.Isolated systolic hypertension,obesity,and hyperkinetic hemodynamic states in children[J].J Pediatr,2002,140(6):660-666.
[29]STRAZZULLO P,D'ELIA L,CAIRELLA G,et al.Excess body weight and incidence of stroke:meta-analysis of prospective studies with 2million participants[J].Stroke,2010,41(5):e418-426.
[30]SWIFT D L,EARNEST C P,BLAIR S N,et al.The effect of different doses of aerobic exercise training on endothelial function in postmenopausal women with elevated blood pressure:results from the DREW study[J].Br J Sports Med,2012,46(10):753-758.
[31]TSIOUFIS C,KYVELOU S,TSIACHRIS D,et al.Relation between physical activity and blood pressure levels in young Greek adolescents:the Leontio Lyceum Study[J].Eur J Public Health,2011,21(1):63-68.
[32]WRAY D W,WITMAN M A,IVES S J,et al.Progressive handgrip exercise:evidence of nitric oxide-dependent vasodilation and blood flow regulation in humans[J].Am J Physiol Heart Circ Physiol,2011,300(3):H1101-1107.
