以葡萄糖调节蛋白78(GRP78)为靶向的胰蛋白酶抑制剂抗肠癌效应研究
2013-10-16李宗伟赵亚蕊史通麟李卓玉
赵 超 李宗伟 付 荣 赵亚蕊 史通麟 李卓玉
(山西大学生物技术研究所-化学生物学与分子工程教育部重点实验室 太原 030006)
肿瘤是严重危害人类生命的重大疾病之一。传统的治疗手段非选择性地杀伤肿瘤细胞,产生了较大的毒性作用和不良反应,因此寻找新的分子靶点、开发高效低毒的分子靶向抗癌药物已成为抗肿瘤研究的重要课题。
葡萄 糖 调 节 蛋 白 78(glucose-regulated protein 78,GRP78)是位于细胞内质网中的重要分子伴侣蛋白。GRP78在肿瘤细胞中通常发生过表达,促进多个肿瘤恶性特征的形成。值得关注的是,肿瘤细胞中的GRP78可以转移到细胞膜表面发挥信号分子受体的功能。因此,肿瘤细胞表面GRP78蛋白可以作为肿瘤靶向治疗的重要靶点[1]。目前,已发现多个多肽序列可以与GRP78蛋白结合并发生细胞内化过程,如WIFPWIQL[2]、WDLAWMFRLPVG[2]和 GIRLRG[3]。
胰蛋白酶抑制剂能够抑制肿瘤细胞的增殖、迁移,并促进肿瘤细胞的凋亡,其在抗肿瘤方面的效应受到研究者的广泛关注[4-6]。绿豆胰蛋白酶抑制剂全长72个氨基酸,含有赖氨酸和精氨酸两个活性中心[7]。本课题组前期研究发现绿豆胰蛋白酶抑制剂赖氨酸活性中心(命名为TI),具有较高的胰蛋白酶抑制剂活性,能够抑制大肠癌细胞SW480细胞迁移,但对细胞存活无显著影响[8]。
本研究旨在通过基因工程手段构建GRP78结合肽段WIFPWIQ与TI的融合蛋白GBP-TI表达载体,通过GST亲和层析柱纯化获得GBP-TI蛋白,探讨GBP-TI能够通过细胞表面GRP78实现靶向抗肠癌效应,从而为肿瘤靶向药物的开发提供一种新的策略。
材料和方法
菌株与质粒 E.coli DH5a、E.coli BL21和载体 p GEX-4 T-1由本室保存。重组质粒p GEX-4 T-1-Lys GP33由中科院上海生化所戚正武教授馈赠。
细胞系 人结肠癌细胞系SW620、DLD1、人正常肝细胞HL7702和人胚胎肾细胞HEK293由本室保存。
试剂 DMEM培养基(美国Ther mo公司),Gl utat hione Sephar ose 4 Fast Flow (美 国 GE Healthcare公司);BAp NA(苯甲酰-dl-Arg-P-硝基酰替苯胺盐酸盐,上海三杰生物技术有限公司);胰蛋白酶(北京北方同正生物技术发展公司);MTT(北京索莱宝科技有限公司),GRP78和GST抗体(江苏碧云天生物技术研究所)。其他化学试剂均为进口分装或国产分析纯试剂。
GBP-TI表达载体的构建及蛋白表达和纯化设计GBP-TI表达序列扩增引物(图1),以p GEX-4T-1-Lys GP33质粒中TI表达序列为模板,PCR扩增GBP-TI表达序列,扩增片段与p GEX-4T-1质粒双酶切,连接产物转化大肠埃希菌E.coli DH5α,获得 GBP-TI原核表达质粒p GEX-4 T-1-GBP-TI。质粒转化大肠埃希菌BL21,构建大肠埃希菌工程菌p GEX-4T-1-GBP-TI/BL21。将该工程菌接种在含氨苄青霉素的LB培养基中,37℃摇床培养至D600约为0.5,加IPTG至终浓度为0.5 mmol/L进行诱导表达。37℃培养3 h后,8 000 r/min离心10 min收集菌体,悬浮于PBS缓冲液中,冰上放置。用超声波破菌体,13 000 r/min离心10 min沉淀细胞碎片。取上清过GST亲和层析柱,PBS缓冲液洗去杂蛋白,10 mmol/L还原谷胱甘肽竞争洗脱目的蛋白,10%SDS-PAGE检测目的蛋白纯化效果。

图1 GBP-TI表达序列扩增示意图Fig 1 Amplification schemes of GBP-TI expressed sequence
GBP-TI胰蛋白酶抑制剂活性测定 以BAp NA(苯甲酰-dl-Ar g-P-硝基酰替苯胺盐酸盐)为底物,在3 mL 缓冲液(100 mmol/L Tris-HCl,10 mmol/L Ca Cl2)中加入40μg胰蛋白酶和一定量的GBP-TI,37℃保温5 min,加入底物 BAp NA (150 mmol/L,溶于DMSO)17μL。继续保温10 min,加入33%的乙酸溶液250μL,终止反应,在410 n m波长处测定吸光度值(D)。由于胰蛋白酶可催化底物水解BAp NA,引起410 n m波长处吸光度增加,加入重组胰蛋白酶抑制剂后可使410 n m波长处吸光度减少,根据减少程度可知抑制剂的抑制活性。
细胞培养 人结肠癌细胞系SW620、DLD1、人正常肝细胞HL7702和人胚胎肾细胞HEK293。细胞用含10%灭活新生牛血清的DMEM培养基,在5%CO2,37℃恒温培养箱中培养,取对数生长期细胞进行实验。
激光共聚焦检测GBP-TI与细胞表面GRP78相互作用 将生长状态良好的DLD1细胞接种到6孔培养板中的盖玻片上,细胞生长至50%融合时用GBP-TI处理24 h。然后PBS洗涤、免疫染色固定液固定30 min。5%BSA(PBS配制)封闭30 min。加入兔抗 GRP78的多克隆抗体(1∶200)和鼠抗GST的单克隆抗体(抗体浓度为1∶100),4℃孵育过夜,用PBS清洗细胞3次,加入FITC标记的羊抗兔和TRITC标记羊抗鼠二抗,室温避光孵育1 h,PBS洗涤3次,用 Ol y mpus Fl uoview FV1000激光共聚焦显微镜观察标记结果并拍摄图像,分析荧光分子的共定位情况。
MTT法GBP-TI对细胞存活的影响 选取对数生长期的SW620、DLD1、HL7702和HEK293细胞,经胰酶消化后,以7 000/100μL的细胞浓度接种到96孔培养板。37℃、5%CO2培养箱中过夜培养。待细胞贴壁后取出培养板,以浓度为0、5、10、20μmol/L的GBP-TI处理细胞48 h后,每孔加入20μL MTT(5.0 mg/mL),继续培养4 h,吸弃板中的培养液,每孔加入150μL的DMSO,震荡均匀,于570 n m处测定各孔D值。
细胞核DAPI染色观察GBP-TI诱导细胞凋亡
人结肠癌DLD1细胞以4×105/mL细胞密度接种于6孔板。待细胞贴壁后,加入GBP-TI处理细胞,倒置显微镜下拍摄细胞状态变化。培养24 h后,弃去培养液,免疫染色固定液固定20 min,0.3%Triton X-100孵育10 min,DAPI染色10 min,荧光显微镜下观察细胞核形态变化。
统计学处理 结果中的数据表达为x—±s,数据图中用误差棒(Err or Bar)表示标准差,单因素分析采用 Student′s t 检验,数据经 SPSS 11.0 统计分析,P<0.05为差异有统计学意义。
结 果
GBP-TI蛋白表达、纯化及酶活力测定 将重组质粒p GEX-4T-1-GBP-TI经Bam H I与Xho I双酶切鉴定,获得了与预期大小一致的片段(图2 A),将酶切阳性菌液送至公司测序,测序结果与目的基因片段一致,表明质粒构建成功。将 p GEX-4T-1-GBP-TI质粒转化到E.coli BL21进行诱导表达、纯化,得到纯度较高的GBP-TI融合蛋白,其相对分子质量(Mr)约为30 000,与预期大小相符(图2B)。采用紫外吸收法测定GBP-TI的胰蛋白酶抑制剂活性,GBP-TI与GST-TI具有相当的胰蛋白酶抑制剂活力,GBP-TI与胰蛋白酶摩尔比在1∶4时,抑制率可达到90% 以上(图2C),表明加入GRP78结合肽的不影响TI的胰蛋白酶抑制剂活性。
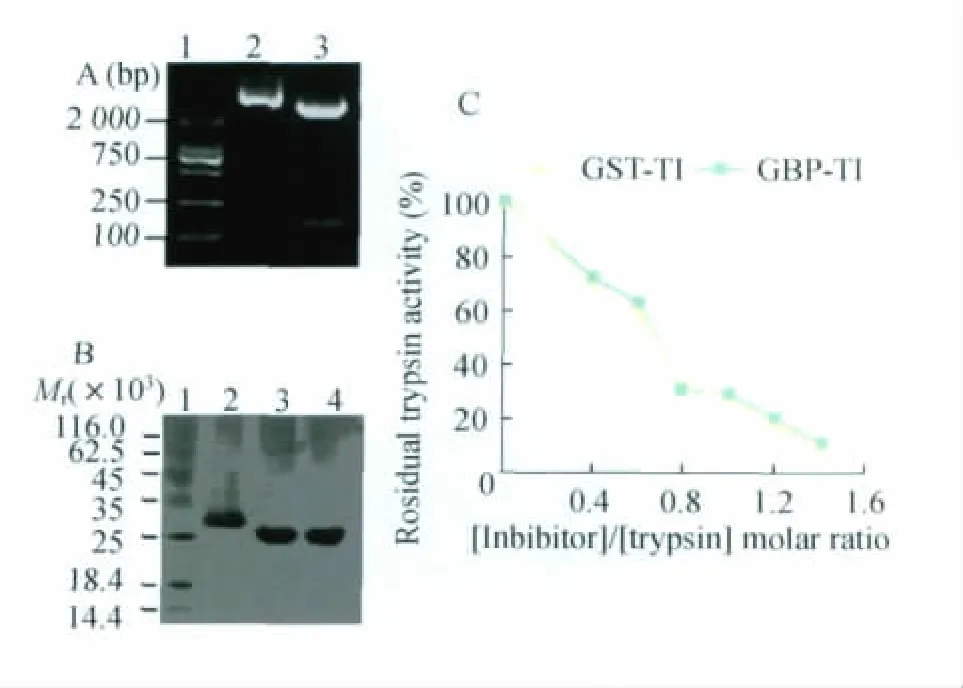
图2 GBP-TI克隆、表达及酶活力测定Fig 2 Cloning,expression and activity deter mination of GBP-TI protein
激光共聚焦检测GBP-TI与细胞表面GRP78相互作用 为验证GBP-TI能否与肠癌细胞表面的GRP78蛋白结合,我们采用免疫细胞化学染色方法检测了GBP-TI与DLD1细胞表面GRP78的定位关系。细胞表面GRP78蛋白(绿色)和GBP-TI(红色)复染结果表明,GBP-TI和GRP78在DLD1细胞有明显的共定位(黄色),表明GBP-TI能够与肠癌细胞表面的GRP78蛋白结合(图3)。
GBP-TI对肠癌细胞存活的影响 为了确定GBP-TI对肿瘤细胞生长的影响,用不同浓度的GBP-TI处理人结肠癌细胞系SW620、DLD1、人正常肝脏细胞HL7702和人胚肾细胞HEK293。与GST、GST-TI蛋白相比,GBP-TI能够剂量依赖性地诱导肠癌DLD1和SW620细胞死亡,半数致死剂量约为5μmol/L。在相同浓度下,GBP-TI对人正常组织细胞系HEK293和HL-7702细胞存活影响不显著(图4)。以上结果表明,GBP-TI能够特异性靶向抑制肠癌细胞生长,表现出对肿瘤细胞的特异靶向性。
GBP-TI诱导肠癌细胞凋亡检测 为了进一步确定GBP-TI抑制肿瘤细胞生长的分子机制,我们用10μmol/L的 GBP-TI处理肠癌 DLD1、SW620细胞,倒置显微镜下观察其形态变化。与GST、GST-TI蛋白相比,10μmol/L的 GBP-TI处理后,细胞发生明显皱缩、变圆,部分细胞发生漂浮,处理36 h后细胞完全死亡(图5 A)。DAPI细胞核染色后可见细胞核发生浓缩变亮,并出现典型的凋亡小体(图5B)。以上结果表明,GBP-TI是通过诱导肠癌细胞凋亡从而抑制肠癌细胞存活的。
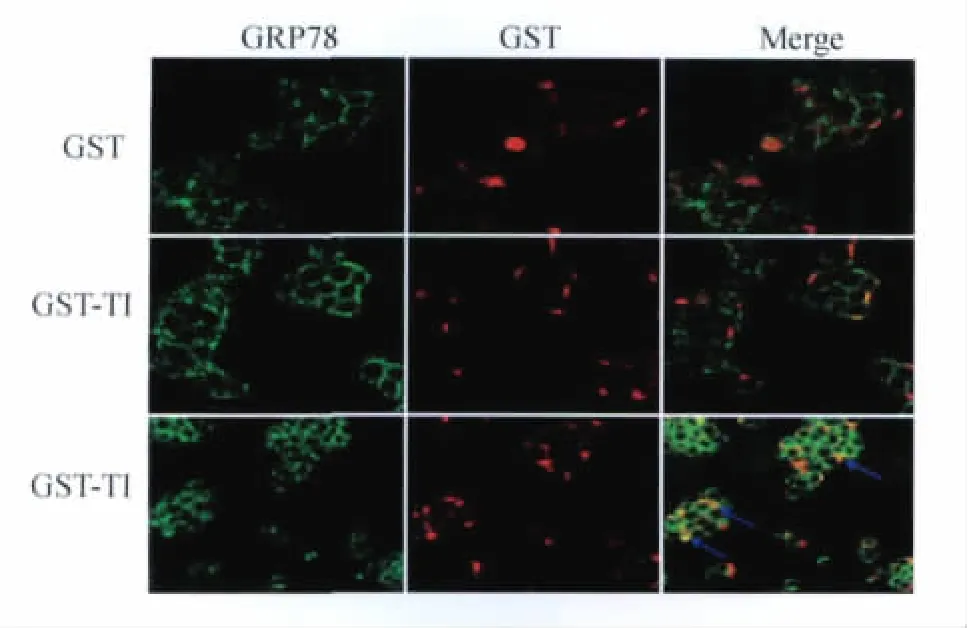
图3 免疫化学染色检测GBP-TI与细胞表面GRP78相互作用(×200)Fig 3 Detection of the interaction bet ween GRP78 and GBP-TI by confocal i mmunofluorescence analysis(×200)
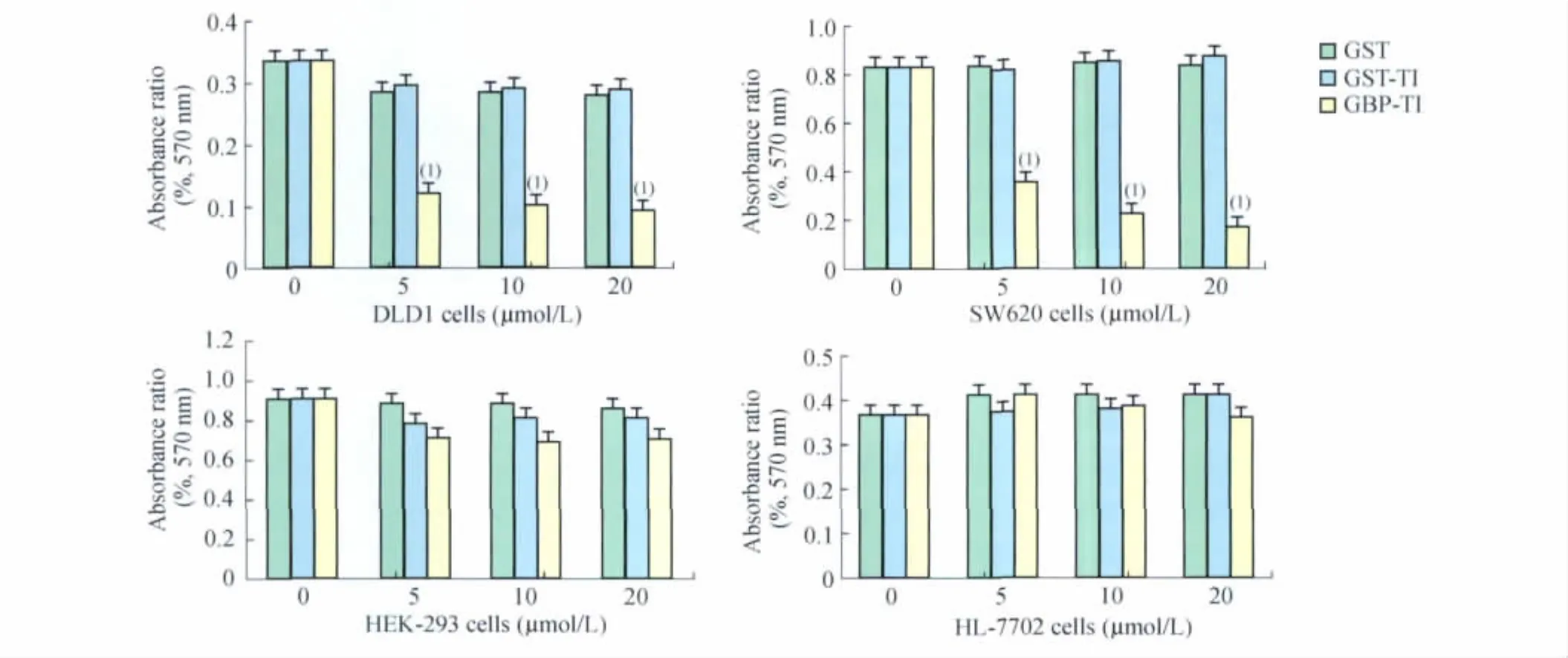
图4 MTT检测GBP-TI对肠癌细胞生长的影响Fig 4 The effect of GBP-TI on the growth of DLD1,SW620,HEK-293 and HL-7702 cells
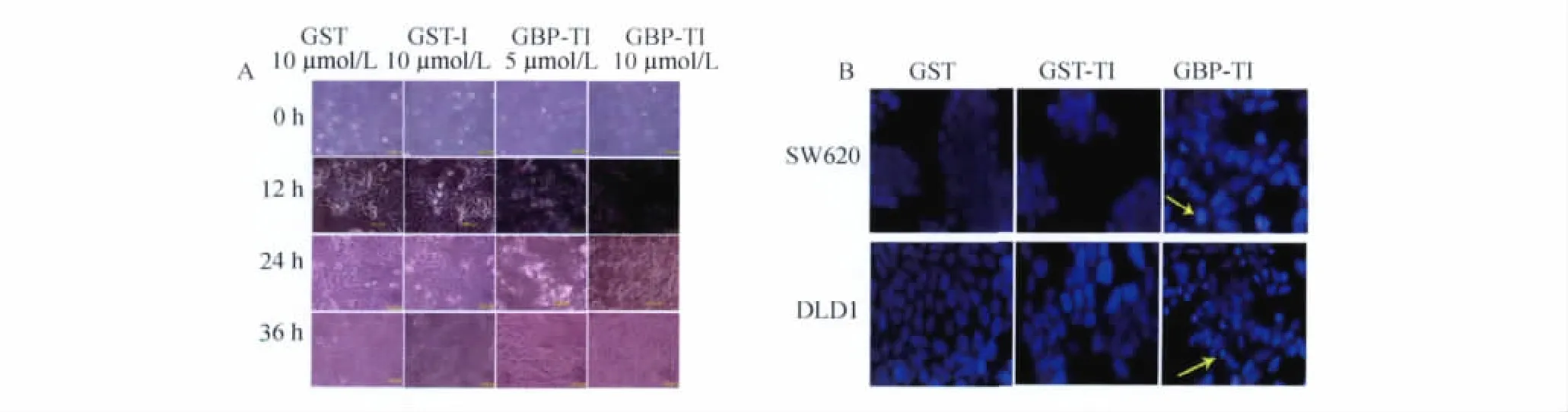
图5 DAPI染色检测GBP-TI诱导细胞凋亡(×400)Fig 5 Detection of GBP-TI-induced apoptosis by DAPI staining(×400)
讨 论
肿瘤的分子靶向治疗是一种非常有前景的治疗方式,寻找合适的分子靶点是实现肿瘤靶向治疗的关键。GRP78蛋白是存在于所有细胞内质网中的分子伴侣蛋白,帮助内质网中新生肽链折叠与装配,并参与内质网应激反应的调控[9]。值得关注的是,肿瘤细胞中的GRP78蛋白可以转移到细胞膜表面发挥信号分子受体的功能[10]。已发现多个多肽序列可以与GRP78蛋白结合并发生细胞内化过程,这为以GRP78为分子靶点的肿瘤治疗奠定了基础。本课题组发现大肠癌细胞表面也存在GRP78蛋白分子,因此构建了GRP78结合多肽WIFPWIQL与绿豆胰蛋白酶抑制剂赖氨酸活性片段的融合蛋白GBP-TI,实现了靶向诱导肠癌细胞凋亡,为肿瘤的靶向治疗提供了一种有效、可行的策略。
本课题组前期研究了绿豆胰蛋白酶抑制剂赖氨酸活性片段GST-TI对大肠癌细胞生物特性的影响,发现GST-TI能够抑制大肠癌细胞SW480细胞迁移,但对细胞存活无显著影响[8]。添加了GRP78结合多肽WIFPWIQL后的GBP-TI蛋白不但保留了GST-TI的胰蛋白酶抑制剂活性,而且表现出对人肠癌细胞特异靶向性杀伤,而对人正常组织细胞系生长的影响不明显。我们认为,GST-TI分子中的WIFPWIQL可通过与肠癌细胞表面的GRP78蛋白结合,来介导GST-TI分子的细胞内化过程。进入细胞中GST-TI则通过干扰细胞中细胞器或功能分子的正常功能,导致细胞凋亡。
细胞内多个细胞器都具有胰蛋白酶活性,如泛素-蛋白酶体降解系统中的蛋白酶体(proteasome)的20 S催化颗粒具有类糜蛋白酶、类胰蛋白酶和肽-谷氨酰胺肽水解酶活性,并且其活性状态对于细胞正常功能的维持至关重要。蛋白酶体抑制剂能通过抑制蛋白酶体活性进而干扰和影响细胞原有的功能,尤其是对肿瘤生长有明显的抑制作用[11]。因此,进入肿瘤细胞的GBP-TI可能通过抑制蛋白酶体的胰蛋白酶活性干扰细胞内泛素-蛋白酶体降解系统正常功能,从而诱导肿瘤细胞的凋亡。GBP-TI是否通过细胞表面GRP78蛋白进入肿瘤细胞内部,进而以泛素-蛋白酶体系统为靶点诱导肿瘤细胞凋亡还有待于进一步实验证实(图6)。此外,GBP-TI靶向抗肿瘤效应还需要在体整体动物实验进一步验证。
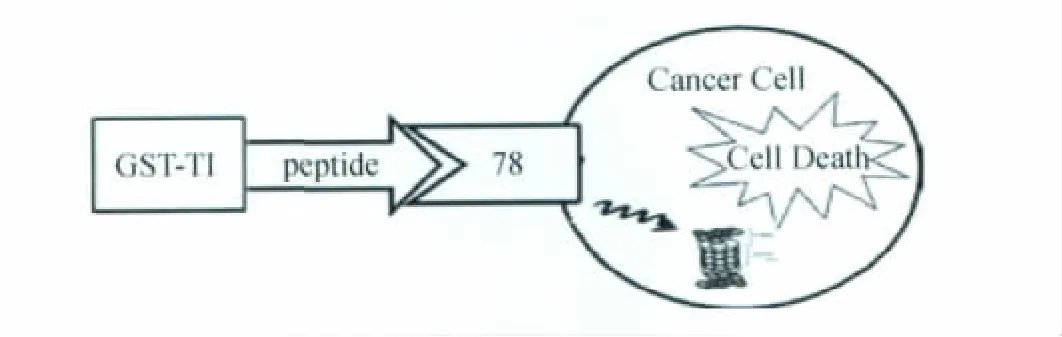
图6 GBP-TI结合癌细胞表面GRP78进入细胞抑制蛋白酶体活性引起癌细胞死亡Fig 6 The pathway of GBP-TI enters into cancer cells and inhibits activity of proteasomes,which further induces apoptosis by the association of GBP-TI and cell surface GRP78
综上所述,本研究采用基因工程的方法构建了基于绿豆胰蛋白酶抑制剂、以细胞表面GRP78蛋白为靶点的重组靶向抗肿瘤活性分子GBP-TI。GBPTI能够特异、高效地诱导肿瘤细胞凋亡,而对正常组织细胞生长影响不明显,表现出抗肿瘤靶向性。本研究为多肽类肿瘤靶向药物的开发提供了一种新的实现策略,具有重要的理论意义和应用价值。
致谢 本研究得到了戚正武院士及其课题组的指导和大力支持。
[1] Li Z.Glucose regulated pr otein 78:A critical link bet ween tu mor microenviron ment and cancer hall mar ks [J].Biochi m Biophys Acta,2012,1826(1):13-22.
[2] Arap MA,Lahdenranta J,Mintz PJ,et al.Cell surface expression of the stress response chaperone GRP78 enables tu mor targeting by circulating ligands[J].Cancer Cell,2004,6(3):275-284.
[3] Passarella RJ,Spratt DE,van der Ende AE,et al.Tar geted nanoparticles t hat deliver a sustained,specific release of Paclitaxel to irradiated tu mors[J].Cancer Res,2010,70(11):4550-4559.
[4] Li YY,Zhang Z,Wang ZH,et al.r BTI induces apoptosis in human solid tu mor cell lines by loss in mitochondrial trans membrane potential and caspase activation [J].Toxicol Lett,2009,189(2):166-175.
[5] Kobayashi H,Suzuki M,Kanayama N,et al.A soybean Kunitz trypsin inhibitor suppresses ovarian cancer cell invasion by blocking urokinase upregulation[J].Clin Ex p Metastasis,2004,21(2):159-166.
[6] Oka N,Oku mura Y,Kanayama HO,et al.Amiloride and urinary trypsin inhibitor inhibit urothelial cancer invasion[J].Eur Urol,2003,44(6):737-741.
[7] Qi RF,Liu ZX,Xu SQ,et al.Small peptides derived fr om the Lys active fragment of the mung bean trypsin inhibitor are f ully active against trypsin[J].FEBS J,2010,277(1):224-232.
[8] 赵亚蕊,李宗伟,赵超,等.重组绿豆胰蛋白酶抑制剂片段对肠癌细胞SW480迁移的影响[J].山西大学学报,2012,35(1):126-129.
[9] Li X,Zhang K,Li Z.Unf ol ded protein response in cancer:the physician′s perspective[J].J Hematol Oncol,2011,4:8.
[10] Ni M,Zhang Y,Lee AS.Beyond t he endoplasmic reticulu m:atypical GRP78 in cell viability,signalling and therapeutic tar geting[J].Biochem J,2011,434(2):181-188.
[11] Crawford LJ,Wal ker B,Ovaa H,et al.Comparative selectivity and specificity of the proteasome inhibitors Bz LLLCOCHO,PS-341,and MG-132[J].Cancer Res,2006,66(12):6379-6386.
