局部灌注化疗显著抑制pTNM IIIB期结直肠癌肿瘤病灶的生长
2013-05-07施东华王小林许剑民程洁敏龚高全刘凌晓李国平李长煜
施东华 王小林,2 许剑民 程洁敏 龚高全 陈 颐 刘凌晓,2 李国平 李长煜
(1复旦大学附属中山医院放射科 上海 200032;2上海市影像医学研究所 上海 200032;3复旦大学附属中山医院普外科 上海 200032)
近30年,结直肠癌的发病率和死亡率稳居男女性所有肿瘤发病率和死亡率的第3位,仅次于前列腺癌(乳腺癌)和支气管肺癌;对个体而言,随着年龄的增加,发生结直肠癌的风险也随之增加[1]。由于人们生活水平的提高,我国的结直肠癌死亡病例数也呈明显上升趋势[2]。得益于检查手段、治疗方案的改进和新型治疗药物的开发应用,结直肠癌患者的总体生存率(overall survival,OS)、无进展生存期(progress free survival,PFS)、治疗总有效率(overall response rate,ORR)和患者生存质量均得到显著改善[3-7],但这些研究大多局限于全身化疗、新辅助化疗以及分子靶向治疗。作为姑息性肿瘤治疗手段,肿瘤局部灌注化疗(包括化疗栓塞)的临床价值越来越受到国际医疗界的认可,它能够推迟Ⅲ期肠癌肝转移的发生、增加患者 OS及 PFS[8-9]。
为探讨经导管动脉内灌注化疗(trans-catheter arterial infusion chemotherapy,TAI)在结直肠癌术前肿瘤降期治疗中的价值,我们随机入组cTNMⅢ期结直肠癌患者各60例(A组患者单纯手术治疗,B组患者术前1周接受TAI治疗),剔除术后病理分期非pTNM IIIB期患者后,以每组各20例患者作为研究对象,观察TAI对肠癌病灶生长的影响,阐明术前TAI化疗的临床应用价值。
资料和方法
一般资料 本研究经复旦大学附属中山医院生物医学研究伦理委员会讨论通过,获得批准(编号:2011-150)。所有入组病例均获患者本人或其家属知情同意,严格保护其隐私权,并确保所有数据资料仅用于本研究。
2010年11月至2011年7月中山医院内外科和介入科门诊疑似结直肠癌患者行腹、盆腔MRI检查,对影像学分期[10]为TNM Ⅲ期的患者随机分两组,A组为直接手术切除组,B组为术前1周TAI化疗联合手术切除组。入组标准为:(1)按照结直肠癌TNM分期系统(AJCC/UICC 2010年第7版)TNM分期Ⅲ期患者;(2)既往无其他系统器官肿瘤疾病史,首诊病人未接受任何其他形式的抗肿瘤治疗;(3)Karnofsky评分≥70分;(4)肝功能 Childpugh评分A级;(5)年龄18岁~77岁。排除标准为:(1)肝功能 Child-pugh评分 B级以下;(2)血肌酐≥3mg/dL;(3)重度高血压、心脏病及其他系统器官长期慢性疾病史;(4)空腹血糖≥10mmol/L的糖尿病患者;(5)WBC<3×109/L;(6)严重出血倾向;(7)碘过敏;(8)合并精神疾病或严重神经官能症患者;(9)不能表达主观不适症状者;(10)非pTNM IIIB期患者。A、B两组各60例患者,以术后病理分期为pTNM IIIB期患者作为研究对象,A组20例,其中男性7例,女性13例,男女比例1∶1.86,年龄41岁~77岁,平均(60.9±11.1)岁;B组20例,其中男性12例,女性8例,男女比例1.5∶1,年龄16岁~72岁,平均(56.6±11.6)岁。由有经验的影像科医生测量瘤体MRI二维直径,并由病理科医生测量大体病理标本的实际瘤体二维直径;患者体力状态评估采用Karnofsky评分。所有患者根据统一设计的资料登记表格采集相关信息,入组患者的临床病理特征见表1,两组资料临床病理特征比较采用Fisher精确χ2检验,以P<0.05为差异有统计学意义。
灌注化疗药物 替加氟(君瑞清,批号Z21021356)1g以0.9%氯化钠注射液稀释至200 ml;奥沙利铂(乐沙定,批号 H20070098)100mg以5%葡萄糖注射液稀释至200mL;丝裂霉素(注射用丝裂霉素,批号H33020786)10mg以0.9%氯化钠注射液稀释至100mL;在DSA(digital subtraction angiography)引导下用4Fr RH导管插管至肝固有动脉及肠系膜动脉入口1~2cm,以优维显300(优维显300,批号H10970164)5mL/s行血管造影证实导管位置及见肠道肿瘤血管染色后(图1~3),分别于肝动脉和肠系膜动脉注入君瑞清0.5g、乐沙定50mg及丝裂霉素5mg。
统计学方法 建立术前MRI评估肿瘤影像学直径和肿瘤实际直径数据库,建立TAI组不良反应评估指标数据库,成组样本采用SPSS 17.0统计软件行Wilcoxon秩和检验,以P<0.05为差异有统计学意义。
不良反应评估 根据NCI不良反应分级CTCAE v3.0,我们主要评估TAI后第5天,经内科支持治疗后患者的血液系统、心脏毒性、胃肠道功能、肝胆功能、神经毒性、肾功能、局部血管损伤等系统器官的功能以及患者的体力状态。

表1 入组病例的临床病理特征(括号内为平均年龄)Tab1 Clinicopathologic features of all enrolled cases(n)
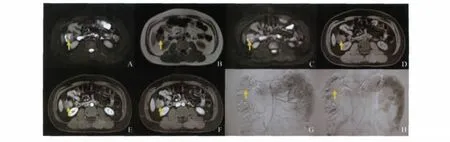
图1 结肠肝曲癌Fig1 Hepatic flexure colon neoplasm
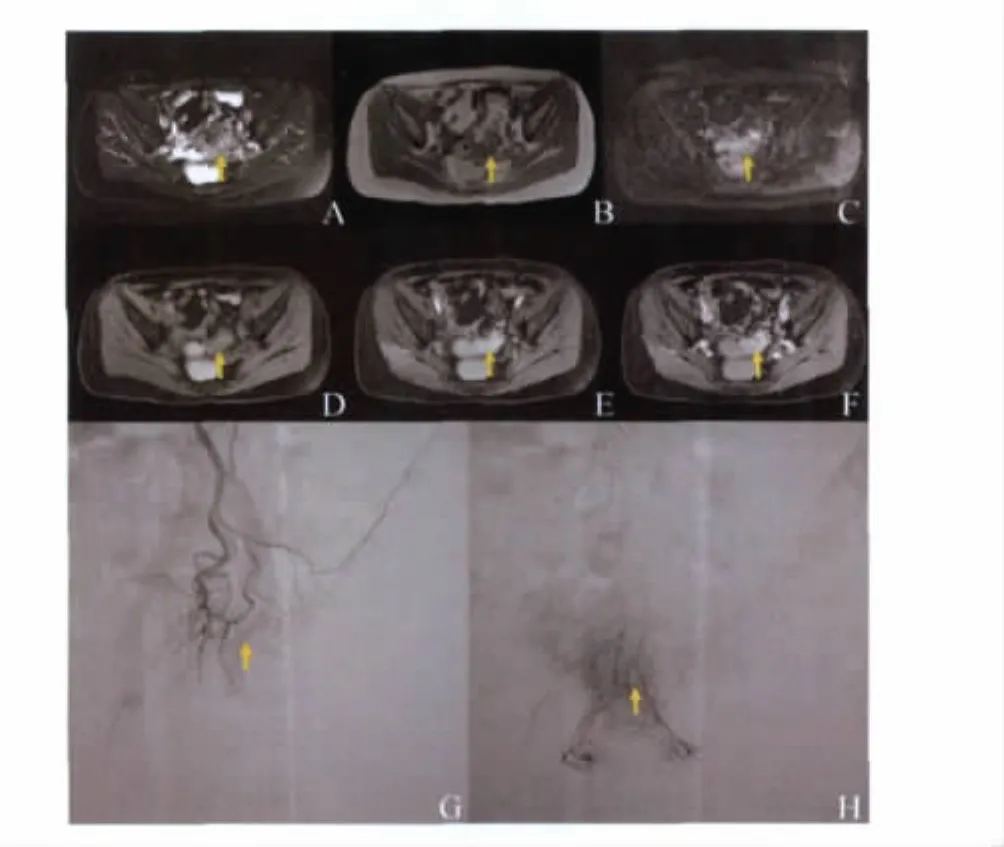
图2 乙状结肠癌Fig2 Sigmoid colon neoplasm
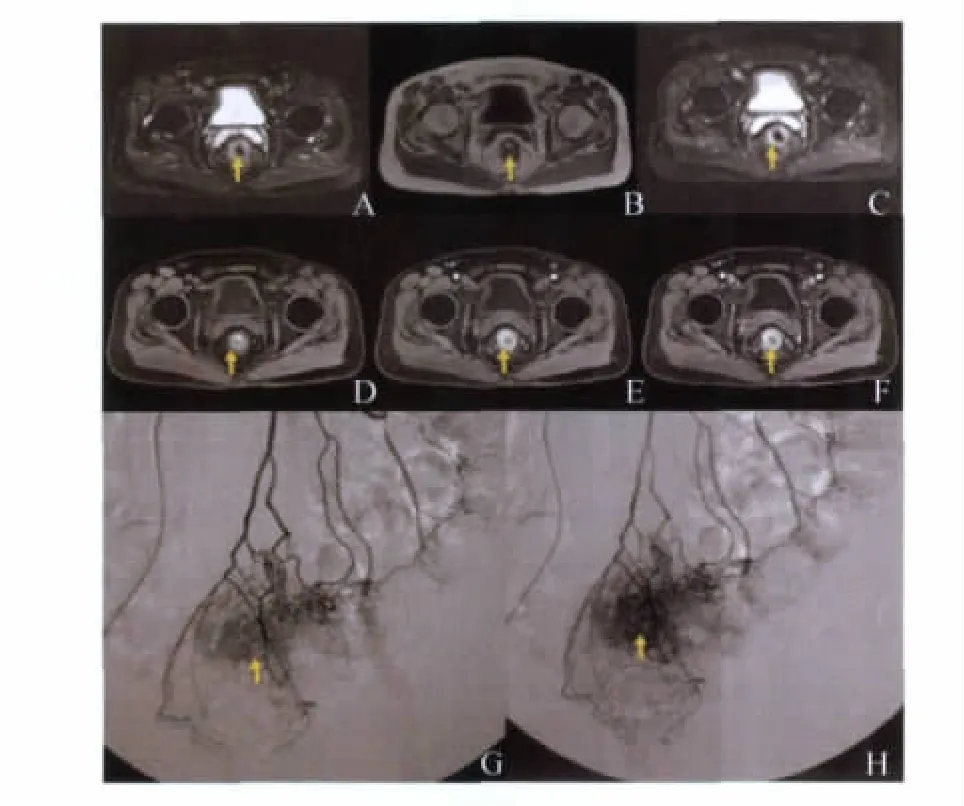
图3 直肠癌Fig3 Rectal neoplasm
结 果
两组患者术前MRI评估肿瘤直径 A、B组患者入组时,MRI评估其瘤体影像学直径分别为长径(4.26 ± 1.17)cmvs.(4.29 ± 1.01)cm(P=0.994);短径(3.31±0.78)cmvs.(3.14±0.64)cm(P=0.457)。经成组样本 Wilcoxon秩和检验,入组时两组患者肿瘤平均直径差异在影像学上无统计学意义(图4)。
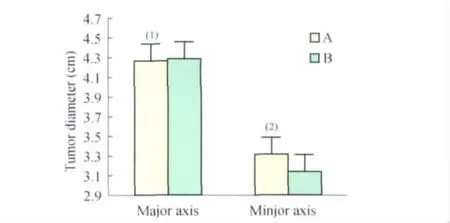
图4 TAI化疗前A、B两组病例肿瘤直径的MRI评估Fig4 MRI evaluation of mean tumor size of the two groups before TAI
术后大体病理肿瘤平均直径 测量切除术后A、B两组肿瘤病灶的实际平均直径分别为长径(4.835±1.368)cmvs.(3.485±1.294)cm(P=0.003);短径 (3.75±0.814)cmvs.(2.6±0.994)cm(P<0.001)。经成组样本 Wilcoxon秩和检验,术前灌注化疗(B)组的肿瘤平均直径明显小于直接手术(A)组(图5)。
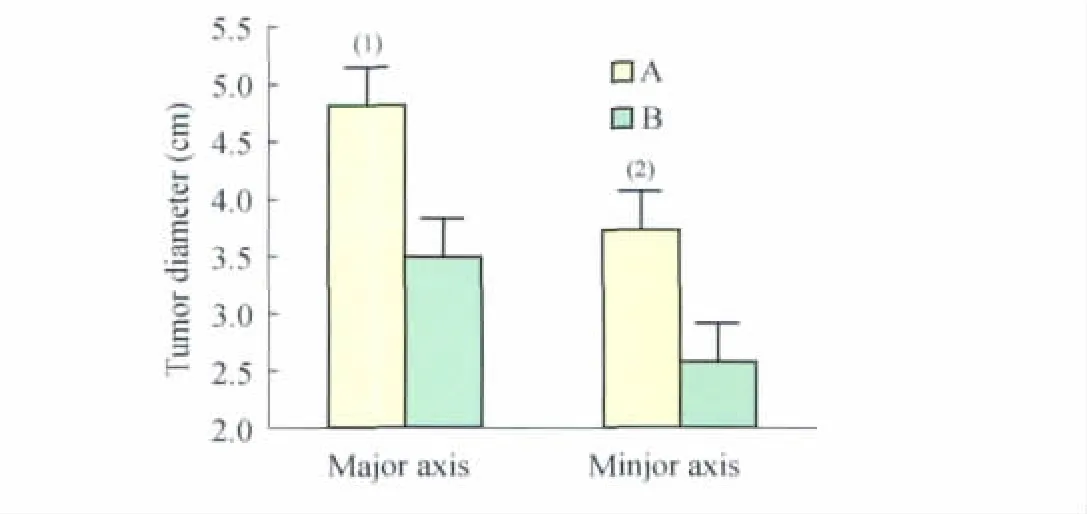
图5 术后大体病理测量A、B两组病例的肿瘤直径Fig5 Actual mean tumor size of these two groups after resection
TAI化疗不良反应 所有接受TAI化疗的患者,经内科支持治疗后第5天Karnofsky评分≥90分,患者生存质量并未受到明显影响。在TAI组60例患者中,未见血液系统、心脏毒性、肝肾功能及局部血管损伤的发生。53例患者TAI后24h内出现不同程度的呕吐,予以对症治疗后48~72h内呕吐反应缓解至消失;5名患者出现便秘,予以对症治疗后便秘症状好转;3名患者出现腹泻症状,予以对症支持治疗后腹泻症状好转,未发生消化系统其他严重不良反应;外周神经系统的毒性反应主要表现为19例患者出现不同程度的一侧或双侧肢体麻木感,但患肢肌力IV级以上,予以神经营养、水化、镇静治疗后12h内肢体麻木感消失,未发生其他严重不良反应。所有患者在TAI后经约1周的对症支持治疗均能顺利接受外科手术,手术如期进行。A、B两组病人在外科术前常规复查的血常规、血生化指标及体力状态Karnofsky评分和平均住院天数无显著性统计学意义,且均在正常值范围(表2)。
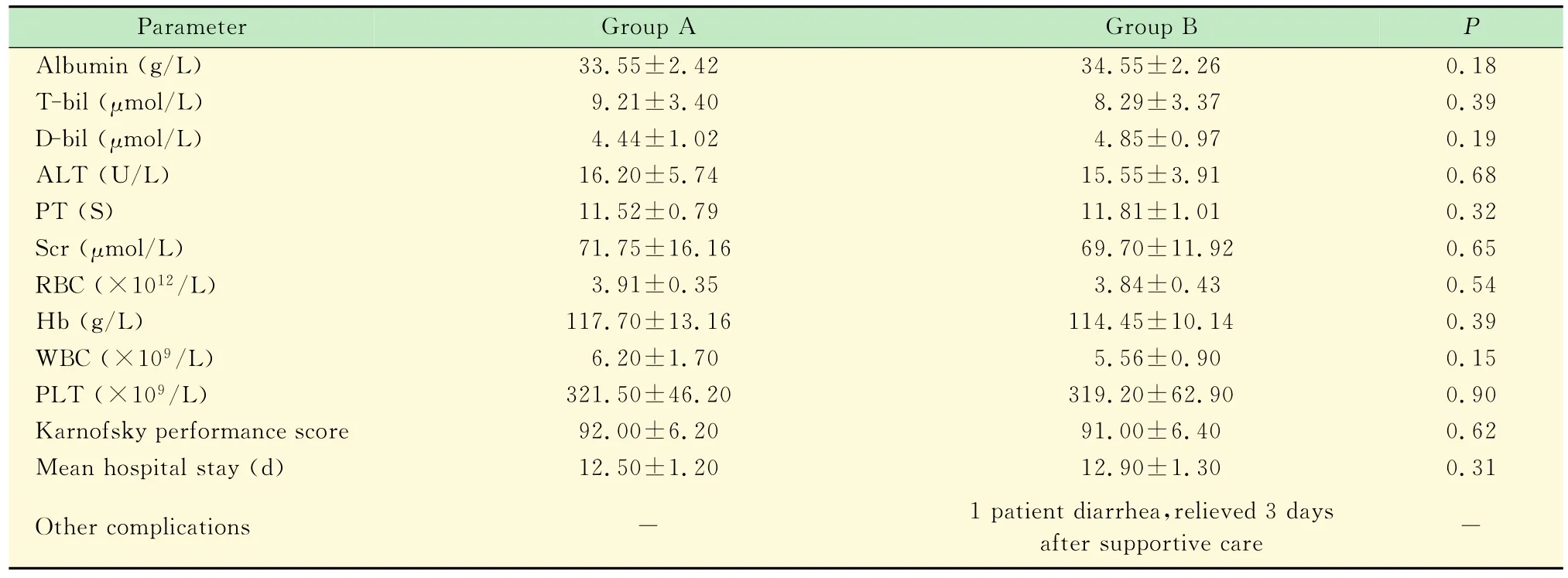
表2 所有入组患者术前血生化指标、平均住院天数及体力状态评估Tab2 Assessment of serum biochemicals,mean hospital stay and performance status for all observed patients exactly before operation
讨 论
目前,对于TNM II期和Ⅲ期结直肠癌的治疗,仍然以全身辅助化疗联合手术切除为主,3年无瘤生存率为61%~71%[11]。然而,对于有肝转移的肠癌患者,局部灌注化疗和全身化疗的前瞻性随机对照研究显示,局部灌注化疗的总有效率(62%~82%)要高于全身化疗的总有效率(9%~21%)[12-19],虽然这些临床研究存在样本量小、不合理的交叉设计、入组病例患有其他系统器官疾病,存在远处转移及局部灌注化疗过程中由于患者因素而使治疗存在困难等局限性,但也有若干质量较好的临床试验能够说明术前局部灌注化疗在结直肠癌治疗中的价值[8-9]。肝脏是Ⅲ期结直肠癌患者术后最常见的转移部位[20],根据肿瘤倍增时间,术中未见肝转移而术后随访发现肝转移灶的患者,其肝内的微转移灶可能在术前2年就已存在[21]。然而术前超声检查对于最大径小于5 mm的肿瘤很难检出,因此术前TAI能够达到杀伤或杀死肝内潜在转移的肠癌细胞的目的,从而降低肝转移发生率及推迟肝转移的发生,提高患者的OS和3年无瘤生存率[8,22]。目前NCCN推荐对于肠癌淋巴结阳性而无肝转移证据者,应行辅助化疗后外科手术,而肝动脉灌注化疗既具有高发转移部位肝转移灶的预防和治疗作用,化疗药物到达全身后又具有全身辅助化疗的作用。Vogl等[9]对463例全身化疗无效的肠癌肝转移患者利用丝裂霉素、碘油等进行肝动脉栓塞化疗,总有效率为62.9%。也有研究认为,经肝动脉灌注5-Fu[8,12,18]和奥沙利铂[8]对于肠癌肝转移的总有效率要高于全身化疗,能推迟肝转移的发生。上述研究在一定程度上体现了局部动脉灌注化疗优于全身化疗,目前尚未见严格设计的术前TAI与新辅助化疗在Ⅲ期肠癌患者治疗中的前瞻性随机对照研究结果。
术前TAI化疗治疗肠癌的机制包括诱导肠癌细胞凋亡、抑制肠癌细胞增殖、促进肿瘤组织坏死及抑制新生肿瘤血管的形成。局部动脉内灌注化疗后的4天内,镜下观察肿瘤组织坏死不明显;而超过10天后,坏死的肿瘤组织表面可见新生的肿瘤血管和肿瘤组织[8]。鉴于此,我们选择TAI后1周进行外科切除手术,为改善预后,提高患者的无瘤生存率,术后1月开始全身化疗方案。
在我们的研究中,术前经结直肠癌供血动脉行局部灌注化疗能够明显抑制肿瘤病灶的生长,这也可能是局部灌注化疗能够提高肠癌无瘤生存率和治疗总有效率、推迟肝转移的发生、提高肿瘤病灶切除率的一个重要因素。对应于局部灌注化疗,单纯新辅助化疗是否也能显著抑制pTNM IIIB期的患者肿瘤病灶的生长,目前尚未见报道。目前所见的局部灌注化疗和全身化疗的随机对照研究大多为存在肝转移的病例。
我们认为,结直肠癌外科手术前行肿瘤供血TAI化疗能够明确抑制肿瘤病灶的生长,有利于结直肠癌术前的肿瘤降期,理论上能够增加外科手术切除率。同时我们期待临床大规模的Ⅲ期结直肠癌术前全身化疗和TAI化疗疗效比较的前瞻性随机对照研究,为优化肠癌治疗方案提供循证医学依据。
[1]Siegel R,Ward E,Brawley O,et al.Cancer statistics,2011 The impact of eliminating socioeconomic and racial disparities on premature cancer deaths[J].CA Cancer J Clin,2011,61(4):212-236.
[2]Center MM,Jemal A,Smith RA,et al.Worldwide variations in colorectal cancer[J].CA Cancer J Clin,2009,59(6):366-378.
[3.]Jonker DJ,O′Callaghan CJ,Karapetis CS,et al.Cetuximab for the treatment of colorectal cancer[J].New Engl J Med,2007,357(20):2040-2048.
[4]Falcone A,Ricci S,Brunetti I,et al.Phase Ⅲ trial of infusional fluorouracil,leucovorin,oxaliplatin,and irinotecan (FOLFOXIRI)compared with infusional fluorouracil,leucovorin,and irinotecan (FOLFIRI)as first-line treatment for metastatic colorectal cancer:the gruppo oncologico nord ovest[J].J Clin Oncol,2007,25(13):1670-1676.
[5]Bokemeyer C,Bondarenko I, Makhson A,et al.Fluorouracil,leucovorin,and oxaliplatin with and without cetuximab in the first-line treatment of metastatic colorectal cancer[J].J Clin Oncol,2009,27(5):663-671.
[6]Aslam MI,Taylor K,Pringle JH,et al.MicroRNAs are novel biomarkers of colorectal cancer[J].Brit J Surg,2009,96(7):702-710.
[7]Lieberman DA.Screening for colorectal cancer[J].New Engl J Med,2009,361(12):1179-1187.
[8]Xu J,Zhong Y,Niu W,et al.Preoperative hepatic and regional arterial chemotherapy in the prevention of liver metastasis after colorectal cancer surgery[J].Ann Surg,2007,245(4):583-590.
[9]Vogl TJ,Gruber T,Balzer JO,et al.Repeated transarterial chemoembolization in the treatment of liver metastases of colorectal cancer:prospective study[J].Radiology,2009,250(1):281-289.
10 Brown GRichards CJNewcombe RGet al.Rectal carcinoma:thin-section MR imaging for staging in 28 patients[J].Radiology,1999,211(1):215-222.
[11]Rousseau B,Chibaudel B,Bachet JB,et al.Stage II and stageⅢcolon cancer treatment advances and future directions[J].Cancer J,2010,16(3):202-209.
[12]Chang AE,Schneider PD,Sugarbaker PH,et al.A prospective randomized trial of regional versus systemic continuous 5-fluorodeoxyuridine chemotherapy in the treatment of colorectal liver metastases[J].Ann Surg,1987,206(6):685-693.
[13]Kemeny N,Daly J,Reichman B,et al.Intrahepatic or systemic infusion of fluorodeoxyuridine in patients with liver metastases from colorectal carcinoma.A randomized trial[J].Ann Intern Med,1987,107(4):459-465.
[14]Hohn DC,Stagg RJ,Friedman MA,et al.A randomized trial of continuous intravenous versus hepatic intraarterial floxuridine in patients with colorectal cancer metastatic to the liver:the Northern California oncology group trial[J].J Clin Oncol,1989,7(11):1646-1654.
[15]Martin JK,O′Connell MJ,Wieand HS,et al.Intra-arterial floxuridine vs systemic fluorouracil for hepatic metastases from colorectal cancer.A randomized trial[J].Arch Surg,1990,125(8):1022-1027.
[16]Wagman LD,Kemeny MM,Leong L,et al.A prospective,randomized evaluation of the treatment of colorectal cancer metastatic to the liver[J].J Clin Oncol,1990,8(11):1885-1893.
[17]Rougier P,Laplanche A,Huguier M,et al.Hepatic arterial infusion of floxuridine in patients with liver metastases from colorectal carcinoma:long-term results of aprospective randomized trial[J].J Clin Oncol,1992,10(7):1112-1118.
[18]Kemeny NE,Niedzwiecki D,Hollis DR,et al.Hepatic arterial infusion versus systemic therapy for hepatic metastases from colorectal cancer:a randomized trial of efficacy,quality of life,and molecular markers(CALGB 9481)[J].J Clin Oncol,2006,24(9):1395-1403.
[19]Kerr DJ,McArdle CS,Ledermann J,et al.Intrahepatic arterial versus intravenous fluorouracil and folinic acid for colorectal cancer liver metastases:a multicentre randomised trial[J].Lancet,2003,361(9355):368-373.
[20]Bonnen M,Crane C,Vauthey JN,et al.Long-term results using local excision after preoperative chemoradiation among selected T3 rectal cancer patients[J].Int J Radiat Oncol Biol Phys,2004,60(4):1098-1105.
[21]Thomas WM,Morris DL, Hardcastle JD.Contact ultrasonography in the detection of liver metastases from colorectal cancer:an in vitro study[J].Brit J Surg,1987,74(10):955-956.
[22]Sadahiro S,Suzuki T,Ishikawa K,et al.Prophylactic hepatic arterial infusion chemotherapy for the prevention of liver metastasis in patients with colon carcinoma[J].Cancer,2004,100(3):590-597.
