MEK信号通路活化在榄香烯致人源U87MG胶质瘤细胞增殖抑制及G0/G1细胞周期阻滞中的作用
2013-10-16朱廷准徐英辉李晓明罗力涵梁国标
朱廷准,徐英辉,李晓明,罗力涵,梁国标*
脑胶质瘤是人类神经系统肿瘤中最常见的类型,具有发病率高、死亡率高的特点[1]。目前国内外尚无理想的治疗方法,常用的化疗药物疗效较差。榄香烯(Elemene)是从中药莪术中提取的非细胞毒性药物,目前已应用于肺癌、膀胱癌和卵巢癌等多种恶性肿瘤的治疗[2-3]。前期的多项临床研究发现,榄香烯可以显著抑制患者体内胶质瘤的生长,延长生存期,且未出现明显的毒副作用[4-5]。但是由于其抗胶质瘤的分子机制不明,限制了在临床上的应用。本实验通过观察榄香烯对人U87MG胶质瘤细胞的增殖抑制及细胞周期阻滞作用,结合MEK信号通路中的MKK3和MKK6分子在其中的关键性作用,初步阐述了榄香烯抗胶质瘤作用的分子机制。
1 材料与方法
1.1 材料 人U87MG和U251胶质瘤细胞系均购自中国科学院上海生命科学院细胞资源中心。榄香烯由大连金港制药有限公司生产。标准胎牛血清、青霉素、链霉素购自美国 GIBCO公司。DMEM培养基购自美国HyClone公司。MTT试剂、碘化丙啶(PI)购自德国 Sigma公司。Lipofectamine 2000购自美国Invitrogen公司。磷酸化蛋白提取试剂盒、BCA蛋白含量检测试剂盒购自南京凯基生物科技发展有限公司。DN-MKK3质粒、DN-MKK6质粒由加拿大多伦多大学 Jim Woodgett教授惠赠。抗MKK3抗体购自美国Santa公司,抗p-MKK3、MKK6和p-MKK6抗体购自英国Abcam公司。辣根酶标记的羊抗兔及兔抗小鼠抗体均购自北京中杉金桥生物技术有限公司。
1.2 方法
1.2.1 细胞培养 将人U87MG和U251胶质瘤细胞培养于含10%胎牛血清的DMEM培养基(含青霉素 50 IU/mL,链霉素 50 mg/mL)中,置37℃、5%CO2培养箱中培养至对数生长期。
1.2.2 细胞增殖检测(MTT法) 将对数生长期的U87MG和U251胶质瘤细胞以6×103/孔的密度接种于96孔培养板中(每组设5个复孔),培养24 h,分别加入 0、20、40、60、80 μg/mL 浓度的榄香烯,在5%CO2、37 ℃培养箱中孵育0、12、24、36、48 h。然后每孔加入0.5%MTT溶液20 μL,继续培养4 h后吸去孔内培养液,用PBS冲2遍后,每孔加入150 μL二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪OD 490 nm处测量各孔的吸光值,绘制标准曲线。
1.2.3 Western blot检测 ①按实验需要处理细胞后,胰酶消化并收获细胞,置于冰盒上操作。将细胞放置于Eppendorf管中。于4℃ 3 000 rpm离心5 min以沉淀细胞,弃上清。用4℃冷PBS洗涤细胞沉淀1次。用凯基公司的磷酸化蛋白提取试剂盒,按说明书比例配制细胞裂解液。每EP管中加入200 μL裂解液重悬细胞沉淀物,吹打。在5×SDS上样缓冲液中煮细胞5 min,使蛋白充分变性,应用BCA蛋白定量试剂盒(南京凯基)对样品蛋白进行定量检测。②按浓缩胶6%、分离胶10%的浓度,配制聚丙烯酰胺凝胶。加样,在150 V电压下电泳约2.5~3 h,直至溴酚蓝指示剂到达距玻璃板下缘约1 cm时停止电泳。将电泳后的SDS-PAGE凝胶转到NC膜上。5%脱脂奶粉(TTBS配制)4℃过夜封闭。一抗4℃孵育过夜,二抗37℃孵育1 h。ECL检测,Gel-Pro Analyzer 4.0软件(Media Cybernetics)分析目的条带。
1.2.4 基因转染 将U87MG胶质瘤细胞以4×105/孔的密度接种于6孔板中,培养至对数生长期。用Lipofectamine 2000脂质体通过瞬时转染方法(步骤详见Lipofectamine 2000说明书),将空质粒以及HA标签标记的DN-MKK3和DNMKK6质粒转染进入U87MG细胞中。
1.2.5 细胞周期检测 取转染后处于对数生长期的人U87MG胶质瘤细胞,以4×105/孔密度接种于6孔培养板中培养24 h后,榄香烯共同孵育24 h,收集各组细胞,离心,弃上清,PBS洗2次,加入70%乙醇1 mL,充分混匀,-20℃过夜。检测前离心,弃上清,PBS洗2次,加0.2 mg/mL Rnase 37℃共同孵育1 h,PI染液置暗处染色30 min,细网过滤,于流式细胞仪上进行荧光检测。
1.2.6 统计学分析 应用SPSS 12.0统计软件。每一项分析至少有3次结果。数值以表示,采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 榄香烯抑制人U87MG和U251胶质瘤细胞增殖 分别以 0(对照组)、20、40、60、80 μg/mL(药物组)浓度的榄香烯处理对数生长期的人U87MG和U251胶质瘤细胞,然后行MTT法检测细胞活性,倒置显微镜观察细胞形态。结果显示,榄香烯能显著抑制人U87MG和U251胶质瘤细胞的增殖活性,该抑制作用呈时间和剂量依赖性(图1A、B)。榄香烯处理后的U87MG细胞突起收缩、形态变圆、胞核缩小,部分细胞松动脱落,并在一定程度上出现接触抑制现象(图1C~E)。
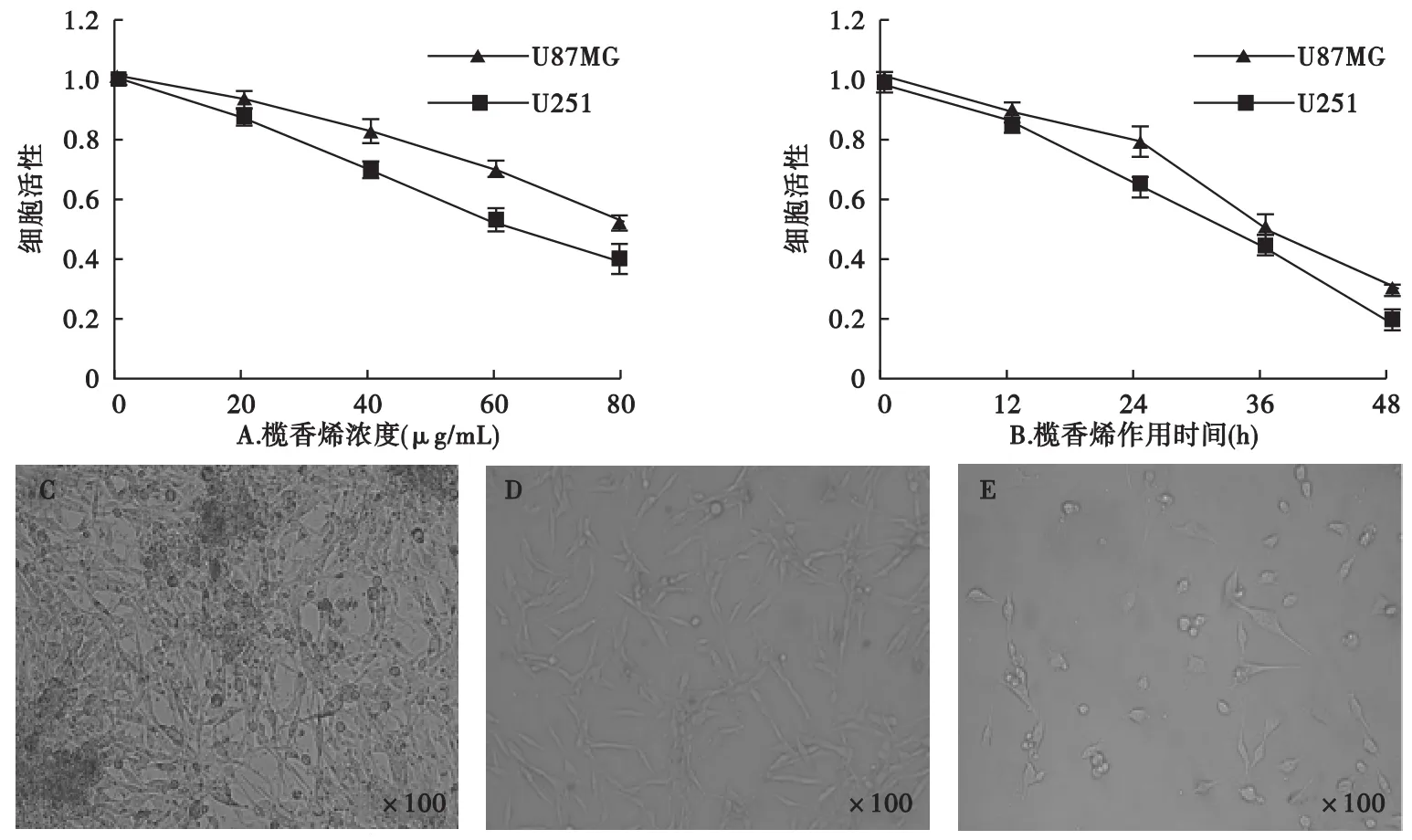
图1 榄香烯抑制人U87MG和U251胶质瘤细胞增殖与时间和剂量的关系
2.2 榄香烯增加人U87MG胶质瘤细胞中MKK3和MKK6的磷酸化水平 不同浓度的榄香烯处理U87MG细胞1 h后行Western blot检测。结果显示,随着榄香烯浓度的增加,p-MKK3和p-MKK6的表达水平显著增高,而MKK3和MKK6的总蛋白的表达未出现明显变化(见图2)。

图2 榄香烯增加人U87MG胶质瘤细胞中MKK3和MKK6的磷酸化水平
2.3 抑制MKK3和MKK6的活性导致榄香烯的抗胶质瘤作用降低 为进一步检测MKK3/6在榄香烯抗胶质瘤细胞增殖中的作用,将DN-MKK3和DN-MKK6突变质粒转染进入U87MG细胞中。设空质粒载体组为对照组(图3,柱a),其他4组为实验组(图3,柱b~e)。采用MTT法检测细胞的增殖活性。结果显示,在60 μg/mL榄香烯的作用下,DN-MKK3 组(图3,柱 c)、DN-MKK6 组(图3,柱d)以及 DN-MKK3+DN-MKK6共转染组(图3,柱e)的细胞活性明显高于空质粒转染组(图3,柱 b,P<0.05或 P<0.01)。结果显示,阻断MKK3/6活性可使榄香烯的抗瘤作用显著减弱,MKK3/6介导榄香烯的抗胶质瘤细胞增殖作用。

图3 抑制MKK3和MKK6活性与榄香烯抗胶质瘤增殖作用的关系
在空质粒、DN-MKK3、DN-MKK6和 DNMKK3+DN-MKK6质粒转染进入U87MG细胞后,细胞被60 μg/mL的榄香烯处理24 h,行MTT检测。与空质粒组相比,DN-MKK3组(柱 c)和DN-MKK6组(柱d)中榄香烯抗细胞增殖作用部分被削弱。而在DN-MKK3+DN-MKK6共转染组(柱e)中,榄香烯的抗瘤作用几乎被完全抵消。
2.4 抑制MKK3和MKK6的活性导致榄香烯的细胞周期G0/G1期阻滞作用减弱 本实验包括5组:榄香烯+空质粒组、榄香烯+DN-MKK6组、榄香烯+DN-MKK3组、榄香烯+DN-MKK6+DNMKK3组以及空质粒组(图4 E)。流式细胞术检测结果显示,榄香烯+空质粒组中G0/G1期比例较空质粒组明显升高。在榄香烯的作用下,DNMKK3(图4 C)、DN-MKK6(图4 B)和DN-MKK3+DN-MKK6共转染组(图4d)G0/G1期的比例较空质粒组(图4 A)更低(P<0.05或P<0.01),即:抑制MKK3和MKK6的活性可导致U87MG细胞对榄香烯的抗药性增加。结果表明,榄香烯的抗肿瘤作用是通过激活MKK3/6通路,将胶质瘤细胞阻滞于G0/G1期,进而抑制胶质瘤细胞的增殖来实现的。
3 讨论
胶质瘤是一种最常见、最顽固的颅内恶性肿瘤。目前,临床治疗胶质瘤主要以手术、化疗或放疗为主要治疗手段,但效果均不理想。因此,如何提高胶质瘤疗效,延长患者的生存期,已成为神经外科最富挑战性而又亟待解决的一个难题。
榄香烯是从姜科植物温郁金(莪术)中提取的以榄香烯为主要成分的混合物。实验药理学研究证实,榄香烯对体内外多种肿瘤细胞具有较强的抑制和杀伤效应,而且该作用具有一定的特异性。榄香烯不但具有直接抗肿瘤作用,还有免疫保护与放化疗协同作用,能缓解癌性疼痛、升高白细胞和抑制血小板聚集等。相对于大多数化疗药物而言,该药毒副作用小,无明显肝、肾功能损害,不发生骨髓抑制[6]。笔者在前期的临床应用中发现,榄香烯对胶质瘤具有明显的抗肿瘤作用。然而,由于榄香烯抗胶质瘤作用的分子机制不明,成为其在临床推广应用的“瓶颈”。
丝裂原活化蛋白激酶(Mitogen-activated Protein Kinases,MAPKs)是哺乳动物细胞内的一类丝氨酸/苏氨酸蛋白激酶,参与细胞的生长、发育、分化、凋亡以及细胞间的功能同步等多种过程[7-8]。MAPKs经其上游的MAPK激酶激酶(MKKK)和MAPK激酶(MEK)磷酸化而活化,形成“刺激-MKKK-MEK-MAPK-反应底物”的瀑布式级联反应。MAPKs信号通路主要包括p38 MAPK、JNK和ERK 3条通路[9-11]。MEK中的两个重要成员MKK3和MKK6是p38 MAPK的上游激酶。国内外的多项研究显示,MKK3/6-p38 MAPK通路在肿瘤细胞的增殖和凋亡中起着重要作用。在NIH3T3细胞中,亚砷酸钠通过激活p38 MAPK引起短暂的细胞生长延迟[12];MKK3/6-p38 MAPK在笑气和细胞因子诱导的胰腺细胞凋亡中扮演重要角色[13]。此外,MKK3/6也介导了异黄酮衍生物、丁酸钠、TNF-α、2,2-二氟脱氧胞嘧啶核苷等多种药物的抗癌作用[14-15]。传统的观点认为,MKK3/6是p38 MAPK的特异性激活因子,但最近的研究显示,p38 MAPK可不依赖于“MKKKMKK3/6-p38 MAPK”途径而被激活。本课题组前期的研究显示,p38 MAPK的激活和Raf/ERK的抑制介导了榄香烯的抗胶质瘤作用[16-19]。因此,MKK3/6是研究榄香烯抗胶质瘤机制过程中的关键环节。

图4 MKK3和MKK6的活性抑制与榄香烯细胞周期G0/G1期阻滞作用关系
本实验显示,榄香烯可以使U87MG细胞停滞于G0/G1期,阻止其向DNA复制加倍的S期及M期转化,从而造成肿瘤细胞的生长缓慢和增殖活性降低。进一步的研究显示,MKK3/6信号通路的磷酸化激活在其中发挥至关重要的作用。相反,通过转染显性负突变体质粒抑制MKK3和MKK6的活性则可以抵消榄香烯的抗胶质瘤作用。因此,MKK3/6激活对榄香烯抗胶质瘤增殖的介导作用为榄香烯的临床应用在分子水平上提供了理论依据,也为胶质瘤的分子治疗提供了重要的参考靶点。然而,榄香烯是如何调控MKK3/6信号通路的活性,其上下游还有哪些分子事件发生,尚有待于更深入的研究。
[1]Fisher PG,Buffler PA.Malignant gliomas in 2005:where to go from here[J].JAMA,2005,293(5):615-617.
[2]Wang G,Li X,Huang F,et al.Antitumor effect of beta-elemene in non-small-cell lung cancer cells is mediated via induction of cell cycle arrest and apoptotic cell death[J].Cell Mol Life Sci,2005,62(7-8):881-893.
[3]Yu Z,Wang R,Xu L,et al.β-Elemene piperazine derivatives induce apoptosis in human leukemia cells through downregulation of c-FLIP and generation of ROS[J].PLoS One,2011,6(1):e15843.
[4]周洪语,沈建康,侯菊生,等.榄香烯抗神经胶质瘤的临床研究[J].辽宁医学杂志,2003,17(4):189-191.
[5]徐英辉,侯菊生,周洪语.颈动脉持续灌注榄香烯治疗老年多发脑转移癌的临床探讨[J].中国肿瘤临床,2005,31(24):1423-1424.
[6]Chen M,Wang S,Tan M,et al.Applications of nanoparticles in herbal medicine:zedoary turmeric oil and its active compound β-elemene[J].Am J Chin Med,2011,39(6):1093-1102.
[7]Kyriakis JM,Avruch J.Mammalian MAPK signal transduction pathways activated by stress and inflammation:a 10-year update[J].Physiol Rev,2012,92(2):689-737.
[8]何莉,周焕娟.MAPK信号转导通路在糖皮质激素耐药白血病中的研究进展[J].实用药物与临床,2012,15(7):434-436.
[9]Kang YJ,Seit-Nebi A,Davis RJ,et al.Multiple activation mechanisms of p38alpha mitogen-activated protein kinase[J].J Biol Chem,2006,281(36):26225-26234.
[10]Zhu T,Xu Y,Dong B,et al.β-elemene inhibits proliferation of human glioblastoma cells through the activation of glia maturation factor β and induces sensitization to cisplatin[J].Oncol Rep,2011,26(2):405-413.
[11]Zhao YS,Zhu TZ,Chen YW,et al.Beta-elemene inhibits Hsp90/Raf-1 molecular complex inducing apoptosis of glioblastoma cells[J].J Neurooncol,2012,107(2):307-314.
[12]Kim JY,Choi JA,Kim TH,et al.Involvement of p38 mitogenactivated protein kinase in the cell growth inhibition by sodium arsenite[J].J Cell Physiol,2002,190(1):29-37.
[13]Makeeva N,Myers JW,Welsh N.Role of MKK3 and p38 MAPK in cytokine-induced death of insulin-producing cells[J].Biochem J,2006,393(Pt 1):129-139.
[14]Chen JT,Fong YC,Li TM,et al.DDTD,an isoflavone derivative,induces cell apoptosis through the reactive oxygen species/apoptosis signal-regulating kinase 1 pathway in human osteosarcoma cells[J].Eur J Pharmacol,2008,597(1-3):19-26.
[15]Cho SD,Ahn NS,Jung JW,et al.Critical role of the c-JunNH2-terminal kinase and p38 mitogen-activated protein kinase pathways on sodium butyrate-induced apoptosis in DU145 human prostate cancer cells[J].Eur J Cancer Prev,2006,15(1):57-63.
[16]Yao YQ,Ding X,Jia YC,et al.Anti-tumor effect of beta-elemene in glioblastoma cells depends on p38 MAPK activation[J].Cancer Lett,2008,264(1):127-134.
[17]姚轶群,徐英辉,卢军,等.p38在榄香烯致鼠胶质瘤C6细胞周期阻滞中的作用[J].中华医学杂志,2008,88(1):56-58.
[18]赵永顺,董斌,吴春明,等.榄香烯阻碍大鼠胶质瘤C6细胞ERK信号通路中Hsp90/Raf-1分子复合体的形成[J].实用药物与临床,2011,14(4):274-276.
[19]赵永顺,吴春明,董斌,等.榄香烯抑制Raf/MEK/ERK信号通路诱导人源胶质瘤U87细胞凋亡[J].实用药物与临床,2011,14(5):365-367.
