稀土镧对成纤维NIH3T3细胞生长的作用
2013-10-16张丽平
张丽平
(太原科技大学环境科学研究所,太原 030024)
稀土是镧系及钪、钇共17种元素的总称。随着稀土元素在工农业、畜牧业以及医药等领域的广泛应用,有关其在生物体内的代谢、积累及生物学效应的研究已成为热点[1]。由于稀土元素的化合物具有多种生物学以及药物活性[2-4],所以其在医药领域的应用研究很早就引起了广泛关注[5]。目前临床上钆的配合物被用于磁共振成像的造影剂,以及碳酸镧治疗晚期肾衰所引发的高磷酸血症[6]等。很多的研究表明稀土及其化合物在药理方面有多的潜在应用价值[7]。同时,稀土化合物对生物体的负面效应也一直受到广泛的关注。
稀土镧是镧系元素中的第一个元素,因为La3+在离子半径、配位能力及与含氧配体亲和力等方面与Ca2+很相似,因此,当镧离子进入生物体后可能占据或取代很多蛋白(如:离子通道蛋白、G蛋白以及钙调蛋白等)中钙的位点[8-9],从而影响细胞的功能。与此同时,有关镧离子对细胞增殖和凋亡的研究也很多[10-13]。本文研究了稀土镧对成纤维NIH3T3细胞增殖,周期和凋亡的影响,为进一步明确稀土镧的细胞生物学效应提供一些实验依据。
1 材料和方法
1.1 材料
FACS流式细胞仪(美国 Becton-Dickinson公司);水套式CO2细胞培养箱(上海力申科学仪器有限公司)。成纤维NIH3T3细胞株由北京大学医学部药学院提供;胰蛋白酶和DMEM细胞培养液购自美国Gibco公司;溴化二甲噻唑二苯四氮唑—噻唑蓝(MTT)、碘化丙啶(PI)和RNase酶购自美国Sigma公司;胎牛血清购自杭州市四季青生物工程材料研究所。其余试剂都是国产的(分析纯)。
三氧化二镧为湖南省稀土研究所产品。镧离子溶液的制备:将浓盐酸加入三氧化二镧中,加热溶解到盐酸挥发将干为止,随后加入纯净水溶解定容,配制成20毫摩尔每升储备液,在0~4℃下保存备用。
1.2 成纤维细胞的培养和传代
在37℃、5%CO2和饱和湿度的条件下,加入含10%胎牛血清的DMEM细胞培养液培养成纤维细胞。在成纤维细胞生长到接近单层时,通过含0.25%胰酶的消化液消化后,按1∶3比例进行传代培养,每2 d~3 d换1次培养液,然后置于显微镜下,细心观察细胞的贴壁形态和生长状况。传代几次后,等到细胞的生长状态良好时,再进行其他实验。
1.3 成纤维NIH3T3细胞的活性检测
将处在生长旺盛期的成纤维细胞消化后,用培养液制成单个细胞悬浮液,并使细胞浓度大概为2×104个/ml,再接种到96孔板中,每孔加入细胞液200 μL,细胞数大概为 4×103个/孔,每组设6个平行孔,并且重复3次。培养24 h后,仔细弃去清液,加入新的细胞培养液,同时加入镧离子溶液,使其最终浓度分别为 1 μmol/L、10 μmol/L、100 μmol/L.继续培养24 h、48 h、72 h,然后每孔加入20 μL的5 mg/mL MTT溶液,继续培养4 h后,仔细弃去清液,每孔加入150 μL的二甲基亚砜,并在震荡器上振荡10 min,将结晶物溶解完全后,测定490 nm波长下各孔的吸光度(A)值,按照下面公式计算细胞活力:
细胞活力(%)=(加药组A值平均数/对照组A值平均数)×100%.
1.4 流式细胞仪检测细胞周期
取对数生长期的细胞消化后,接种于25 ml的培养瓶中,培养24 h后,仔细弃去清液,加入新的细胞培养液,同时加入镧离子溶液,使其终浓度分别为 1 μmol/L、10 μmol/L、50 μmol/L、100 μmol/L.继续培养24 h、48 h、72 h后,用PBS洗3次,消化后加入培养液制成单细胞悬浮液,以1000 rpm离心5 min,仔细弃去清液,再用冷的PBS洗3次,加入预冷的75%乙醇固定细胞,4℃过夜。染色前用PBS洗涤离心2次,除去固定液,加入200 μl的10 mg/L RNase消化,37 ℃水浴30 min,再加入600 μl的50 mg/L的PI染色液混匀,4℃避光染色30 min,用400目筛网过滤后,上机检测。
1.5 细胞凋亡检测
取对数生长期的细胞消化后,接种于25 ml培养瓶中,培养24 h后,仔细弃去清液,加入新的培养液,同时加入镧离子溶液,使其最终浓度分别为1 μmol/L、10 μmol/L、100 μmol/L、1000 μmol/L.继续培养24 h、48 h、72 h后,用PBS洗3次,消化后加入培养液制成单细胞悬浮液,以1000 rpm离心5 min后,弃去上清液,再用冷 PBS洗3次,接着用Annexin V/PI凋亡试剂盒进行双染色,避光室温反应20 min,加入300 μl缓冲液,立即用流式细胞仪进行检测。
2 实验结果
2.1 LaCl3促进NIH3T3细胞增殖
不同浓度 LaCl3(0,1 μmol/L,10 μmol/L,100 μmol/L)分别作用NIH3T3细胞不同时间后,MTT法分析结果(图1)表明:LaCl3可明显促进NIH3T3细胞的增殖,并且具有一定的时间和浓度依赖性。100 μM LaCl3作用72 h后细胞增殖率可达到46.7%.
分别加入不同浓度 LaCl3(0,1 μmol/L,10 μmol/L,
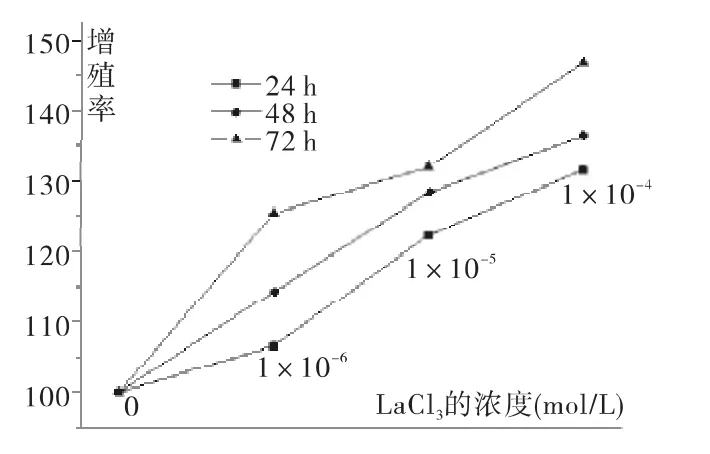
图1 La促进NIH3T3细胞增殖Fig.1 La promoted cell proliferation of NIH3T3 cells
2.2 LaCl3加快G1/S细胞周期进程
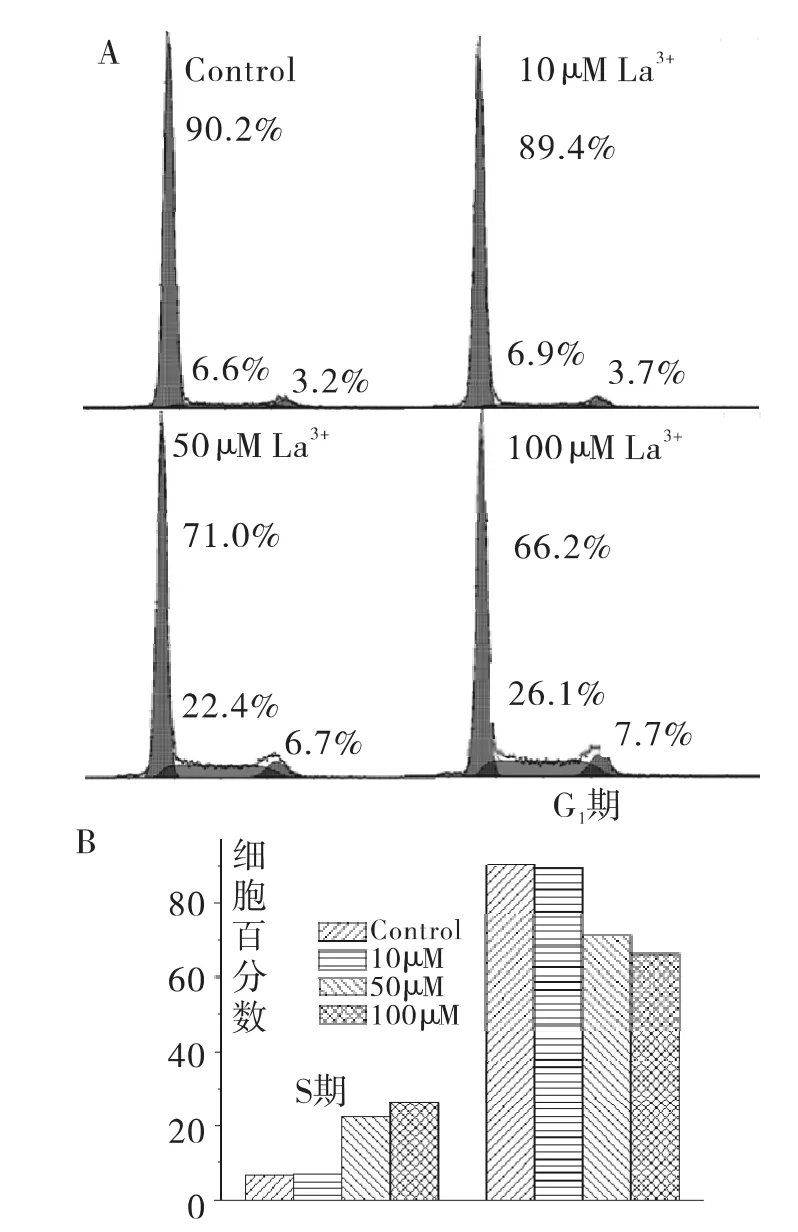
图2 La对NIH3T3细胞周期的影响Fig.2 Effect of La on the cell cycle of NIH3T3 cells
50 μmol/L,100 μmol/L)作用NIH3T3 细胞72 h 后,流式细胞仪分析细胞周期结果显示(图2),与对照组相比,LaCl3使G1期细胞数量明显减少(P<0.01),S期细胞数明显上升(P<0.01)。结果提示LaCl3可能通过加快G1/S期转换而促进NIH3T3细胞增殖。
2.3 LaCl3未引起NIH3T3细胞凋亡
不同浓度 LaCl3(0,1 μmol/L,10 μmol/L,100 μmol/L,1000 μmol/L)作用 NIH3T3 细胞72 h 后,流式细胞分析仪结果表明:所选浓度条件下,LaCl3基本上不引起NIH3T3细胞的凋亡。
3 结论
研究已发现,钙元素参与广泛的生理过程,如细胞兴奋性的控制、细胞代谢的调节、细胞形态的维持以及细胞周期的调控等。本文研究了不同浓度的LaCl3作用NIH3T3细胞后可促进其增殖,使G1期细胞数量明显减少,S期细胞数明显上升。此表明LaCl3可促进成纤维NIH3T3细胞的G1/S期转换,加快细胞周期进程,从而提高其增殖活性。稀土元素镧促进成纤维NIH3T3细胞的增殖的可能机制为:由于La3+与Ca2+具有很多的相似性,所以La3+进入细胞内后可能占据或取代很多蛋白包括离子通道蛋白、G蛋白和钙调蛋白等中钙的位点,从而影响细胞的一系列生物功能,进而促进细胞的增殖。此机制还有待于进一步的深入研究。
La3+对细胞增殖和凋亡的影响广被研究。王熙等[14]研究表明 La3+促进成骨细胞的增殖和分化,而刘丝荪等[15]研究表明氯化镧抑制宫颈癌Hela细胞的增殖和迁移并诱导其凋亡,氯化镧还可抑制大鼠肝癌细胞株CBRH-7919细胞的生长[16]。这些研究表明:在不同条件和对象下,稀土元素的生物效应不完全相同。因此,只有在全方位的系统研究下,才能更全面、更准确的了解稀土元素的生物效应,才会有助于我们更准确地把握稀土元素生物效应的内在机制和应用价值。
[1]李荣昌,杨晓达,王夔,等.我国稀土生物无机化学研究进展[J].中国稀土学报,2004,22(1):1-6.
[2]SWITZER M E.The lanthanide ions as probes of calcium ion binding sites in biological systems[J].Sci Prog,1978,65:19-30.
[3]DAS T,SHARMA A,TALUKDER G.Effects of lanthanum in cellular systems[J].A review Biol Trace Elem Res,1988,18:201-228.
[4]KRAMSCH D M,ASPEN A J,ROZLER L J.Atherosclerosis:prevention by agents not affecting abnormal levels of blood lipids[J].Science,1981,213:1511-1518.
[5]WANG K,CHENG Y,YANG XG,et al.Cell responses to lanthanides and potential pharmmacological actions of lanthanides[J].Sigel/Sigel-Metal Ions in Biological Systems,2003,40:707-751.
[6]BERNS J S,KOBRIN S.Boning up on lanthanum[J].Semin Dial,2006,19(1):87-89.
[7]WANG K,LI R,CHENG Y,ZHU B.Lanthanides-the future drugs[J].Coord Chem Rev,1999,190-192:297-308.
[8]EVANS C H.Chemical properties of biochemical relevance.In:Biochemistry of the Lanthanides[M].New York:Plenum,1990.
[9]NIEBOER E.The lanthanide ions as probes in biological systems[J].Structure and Bonding,1975,22:1-47.
[10]SMITH J B,SMITH L.1984 Initiation of DNA synthesis in quiescent Swiss 3T3 and 3T6 cells by lanthanum[J].Biosci Rep,1984(4):777-782.
[11]DAI Y,LI J,YU I,et al.Effects of rare earth compounds on growth and apoptosis of leukemic cell lines,In.Vitro[J].Cell Dev Biol Anim,2002,38:373-375.
[12]LACOUR B,LUCAS A,AUCHERE D,et al.Chronic renal failure is associated with increased tissue deposition of lanthanum after 28-day oral administration[J].Kidney Int,2005,67:1062-1069.
[13]YU SW,YUAN L,YANG XD,QIAN ZM,WANG K.La3+-Promoted Proliferation Is Interconnected with Apoptosis in NIH 3T3 Cells[J].J Cell Biochem,2005,94:508-519.
[14]王熙,黄健,张天蓝,等.La3+通过重组细胞骨架影响大鼠成骨细胞增殖、分化[J].自然科学进展,2008,18(9):1053-1057.
[15]刘丝荪,陆丹,缪丽芳,等.氯化镧对子宫颈癌HeLa细胞增殖和迁移能力的影响[J].中华妇产科杂志,2010,45(8):609-613.
[16]姜文华,陈东,董智勇,等.三氯化镧对大鼠肝癌细胞株CBRH-7919细胞生长的影响[J].吉林大学学报:医学版,2004,30(3):372-375.
