叶面喷施脱落酸对桃果实着色及相关基因表达的影响
2013-10-16蔡志翔张斌斌许建兰宋宏峰马瑞娟
郭 磊, 蔡志翔, 张斌斌, 许建兰, 宋宏峰, 马瑞娟
(江苏省农业科学院园艺研究所,南京 210014)
叶面喷施脱落酸对桃果实着色及相关基因表达的影响
郭 磊, 蔡志翔, 张斌斌, 许建兰, 宋宏峰, 马瑞娟*
(江苏省农业科学院园艺研究所,南京 210014)
以“美香”桃为试材,于果实着色前用25 mg/L 的脱落酸(ABA)溶液喷施叶片,研究了ABA处理促进桃果皮着色的效果以及对果皮花色素苷合成相关基因表达的影响。结果表明,ABA处理对果实单果重、 可溶性固形物含量和固酸比影响不显著, 但明显改善果实着色,果皮花色素苷含量增加了39.48%,果面光泽明亮度(L*值)和色调角(h*值)分别下降了6.86%和18.64%,红绿色差指标(a*值)增大了134.19%。ABA处理显著促进了查尔酮合成酶基因(CHS)的上调表达以及类黄酮葡萄糖苷转移酶基因(UFGT)、 二氢黄酮醇4-还原酶基因(DFR)、花色素合成酶基因(LDOX)的提前表达。据此推测,ABA可能参与了桃果实花色素苷合成的调控,对花色素苷合成具有促进作用。
桃; 脱落酸(ABA); 着色; 基因表达
Abstract: To investigate of influence of ABA on coloration and expression of genes related to anthocyanin synthesis, a 25 mg/L of ABA solution was sprayed on peach before the peach coloring(cultivar, Meixiang). The results show that the foliar application of ABA(25 mg/L) has no significant effects on the fruit weight, mass fraction of soluble solids and total soluble sugar(TSS)-acid ratio in flesh, while can improve coloration and the content of anthocyanin by 39.48%. The ABA treatment decreasesL*andh*values much, and increasesa*value. In addition, the ABA treatment up-regulatesCHSexpression and significantly acceleratesUFGT,DFRandLDOXexpression. These results indicate that ABA might be involved in the regulation of anthocyanin accumulation in peach and the improvement of the level of anthocyanin accumulation in peach.
Keywords: peach; ABA; coloration; gene expression
随着市场对果实品质要求的提高,果皮色泽逐渐成为果实外观品质的重要指标之一,同时也成为衡量果品商品价值的重要因素。如何提高果品外观品质,尤其是改善红色果实着色一直是国内外果树工作者普遍关心的问题。对桃、 甜樱桃和葡萄等主要水果的研究表明[1-3],外源脱落酸(ABA)处理可以提高果实的成熟度,促进果实软化和后熟衰老进程,而且在改善果实品质、 促进果实着色方面也有明显的效果。在前期的研究中,我们已基本在生理水平上明确了ABA提高果实品质,促进果实着色的原因,并且获得了外源ABA的最佳使用浓度和时期[4-5]。然而,ABA处理是如何调控桃果皮花色素苷生物合成途径主要基因转录水平的?国内现有的研究报道甚少。本研究以桃品种“美香”为试材,研究了ABA 处理对果实着色相关生理指标和基因表达的影响,以期为探讨ABA调控桃果皮花色素苷积累的机理提供理论依据,为生产应用提供参考。
1 材料与方法
1.1 试材与试验设计
试验于2012年进行,试材取自江苏省农业科学院国家果树种质南京桃资源圃保存的8年生“美香”,树形为自然开心形,株行距为3 m × 5 m,树体生长健壮,按常规栽培措施管理。试验共选6棵树,2棵树为1个重复,共3次重复。每棵树选长势相近的2个主枝,分别作为处理(ABA)和对照(CK),处理和对照分别选6个主枝。落花后5周左右疏果,留果量基本一致,随后套白色单层纸袋直至果实成熟。
试验处理于7月16日果实转色前进行,所用ABA溶液浓度为25 mg/L。处理时叶面喷施ABA溶液至滴水,以喷施清水作为对照。
1.2 取样方法
处理当天取样,之后每隔5 d 取样一次,至果实成熟,共取样7次。每次取样随机从不同处理的主枝上采摘果实12个,最后一次取30个果实。每次样品带回实验室,测定单果重、 颜色指数、 可溶性固形物含量、 可滴定酸含量,然后用削皮器刮下果皮,立即置于液氮中,保存在-70℃,用于花色素苷含量的测定和RNA的提取。
1.3 测定项目与方法
单果质量用分析天平测定;可溶性固形物含量用数字折射仪(PR-101,Atago,日本)测定;可滴定酸含量采用0.1 mol/L NaOH标准溶液滴定法测定。
果面色泽用HunterLab Color Quest XE色差计(Hunter Associates Laboratory Inc,USA)测定,共测4个点(腹部、 背部、 两个侧面)的色泽,其中L*表示颜色的亮度,取值范围为[1,100],a*、b*表示颜色组分,取值范围为[-60,60],a*值为红绿色差指标(正值代表红色程度,正值越大,红色越深;负值代表绿色程度,负值越小,绿色越深);b*值为黄蓝色差指标(正值代表黄色程度,正值越大,黄色越深;负值代表蓝色程度,负值越小,蓝色越深)。利用a*和b*值可以计算出色调角(hue angle,h°),h°=arctangentb*/a*,(ho为综合颜色指标,从0至180依次为紫红、 红、 橙、 黄、 黄绿、 绿、 蓝绿色,其中h=0紫红色;h=90,黄色;h=180,蓝绿色)。
花色素苷的提取及测定: 整个过程在避光和低温条件下进行,果皮加液氮研磨后,称取1 g,加入5 mL预冷的1%盐酸-甲醇溶液,置4 ℃下避光浸提24 h。之后在4℃下,12000 r/min离心20 min。花色素苷质量分数的测定采用pH示差检测法[6],1 mL的上清液分别加入2 mL pH值为1.0和4.5的缓冲液,混匀静置10 min后,测定520 nm和700 nm下的吸光值。
果皮RNA的提取与cDNA合成: 果皮总RNA的提取采用CTAB法[7],利用Eppendorf BioPhotometer plus核酸蛋白测定仪(Eppendorf,德国)进行初步定量后,DNase I处理和cDNA 第一链合成的所有操作均依照TaKaRa公司的PrimeScript RT reagent Kit with gDNA Eraser试剂盒说明书进行。
荧光定量PCR分析: 根据桃已登录序列分别设计UFGT、DFR、F3H、LDOX和CHS5个基因的特异性引物序列,同时以桃看家基因TEF2为内标基因,内标和目的基因的引物序列委托Invitrogen 公司合成,见表1。应用ABI 7500实时定量PCR仪(Applied Biosystems,USA),使用SYBRGreen(TaKaRa,日本)试剂,以桃不同发育时期的果皮cDNA为模板进行qRT-PCR检测,扩增体系含2 μL cDNA,上下游引物各0.8 μL,10 μL反应MIX,6 μL ddH2O以及0.4 μL ROX Reference Dye II,总体系20 μL。反应程序为95℃预变性30 s,95℃变性5 s,60℃退火34 s,40个循环。表达量用相对表达量2-ΔCT来表示。试验设3次重复。
1.4 数据处理
本试验采用完全随机区组设计,试验数据采用DPS3.01 软件进行分析,采用Excel软件作图。
2 结果与分析
2.1ABA对果实单果重、可溶性固形物含量和固酸比的影响
ABA处理与对照(CK)果实单果重都呈“S”型增长趋势(图1)。ABA处理后果实单果重与对照总体没有显著差异。可溶性固形物含量呈现先上升,至果实成熟后期又下降的趋势,处理与对照总体无显著性差异。ABA处理使果实固酸比于处理15 d和25 d分别达到76.02和67.30,显著高于对照的64.22和58.76,然而,由于果实成熟后期恰逢大雨影响,固酸比与可溶性固形物表现出相同的下降趋势,至果实成熟时显著性差异消失。
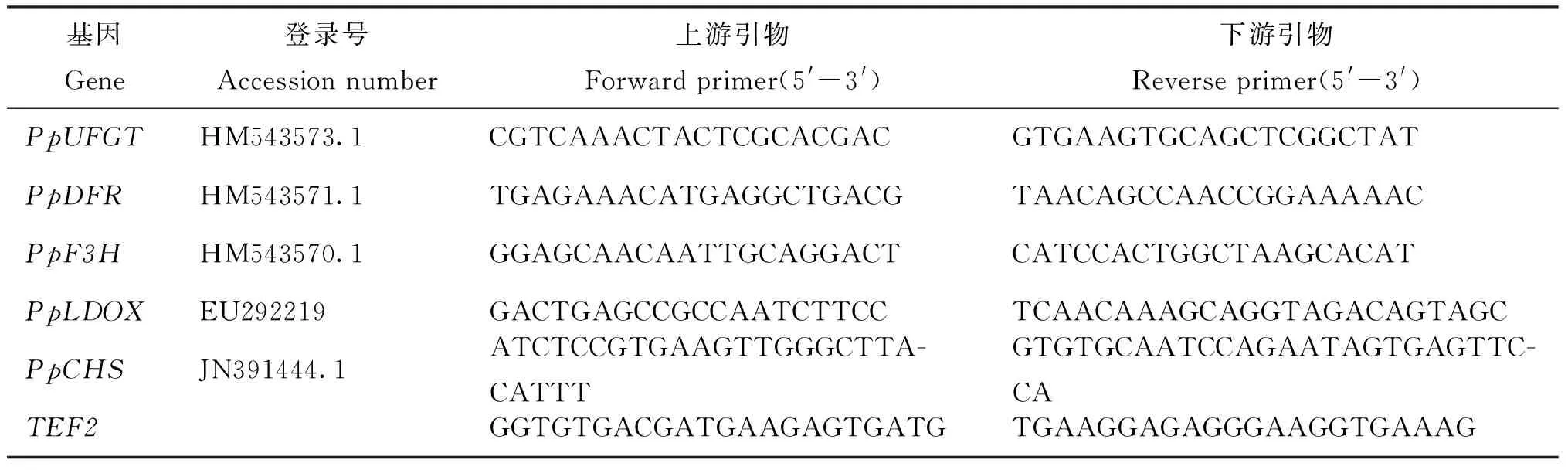
表1 实时荧光定量 PCR引物序列
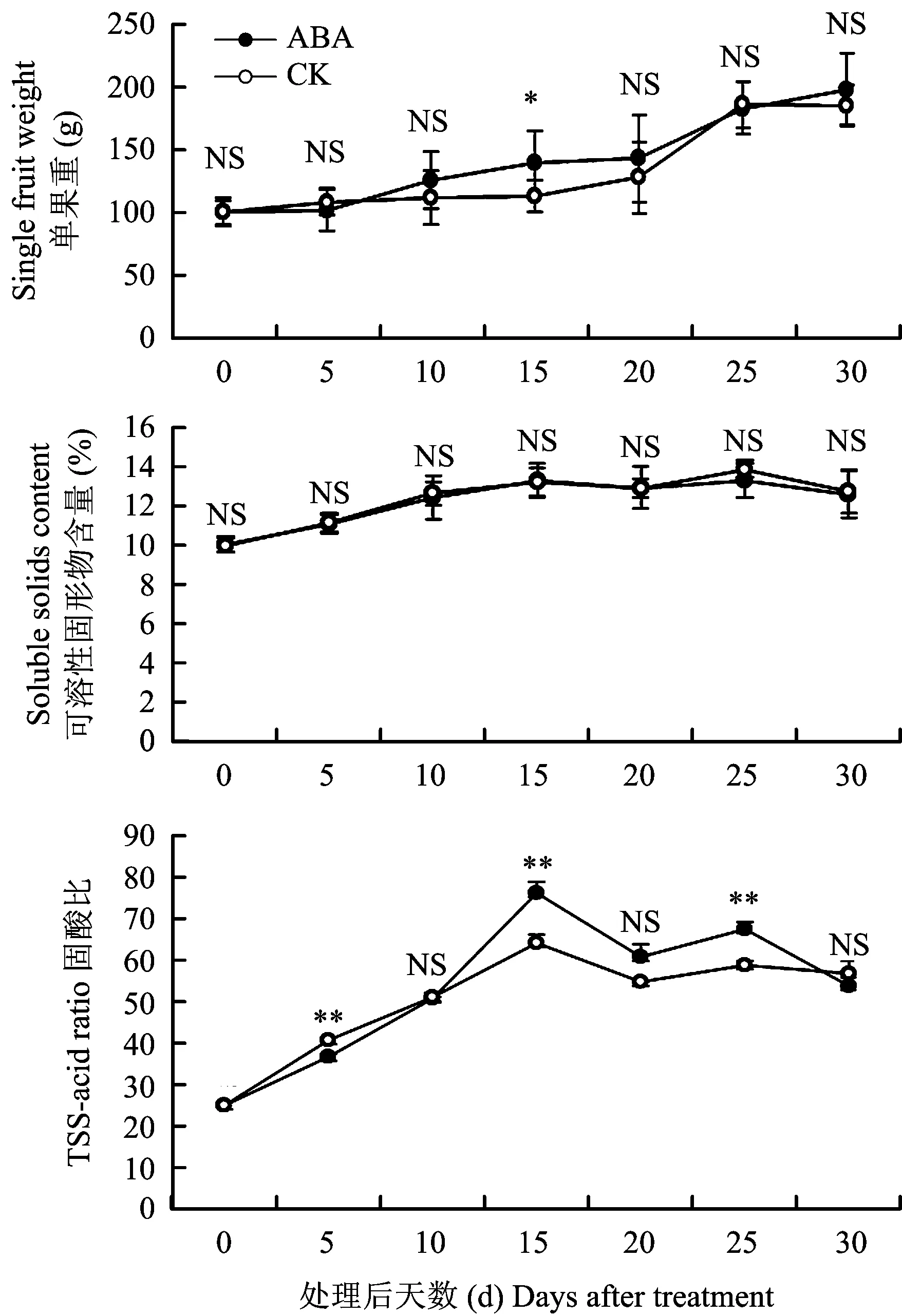
图1 ABA处理对桃单果重、可溶性固形物含量和固酸比的影响Fig.1 Effects of ABA on the single fruit weight, soluble solids content and TSS-acid ratio of peach fruit[注(Note): * 代表处理间差异达0.05显著水平Means significantly different at the 0.05 level; ** 代表处理间差异达0.01显著水平Means significantly different at the 0.01 level; NS代表处理间差异不显著Means no obvious difference.]
2.2 ABA处理对果面色泽参数的影响
由图2可知,“美香”在果实发育成熟的过程中,处理和对照L*值总体都呈缓慢下降趋势,至果实成熟,对照果实L*值下降至68.53,处理下降至63.83,比对照低了6.86%,差异显著;随着果皮颜色由绿色转为红色,处理和对照色泽指标a*值由负转正,并逐渐升高,且以处理果实的a*值增加速度更为迅速(图2),至果实成熟,处理果实的a*值达到15.55,为对照的2.34倍,差异显著;处理与对照b*值总体呈下降变化,ABA处理变化略大于对照,但未达到显著性差异(图2);h*值同样表现出了ABA处理对着色的促进作用,随着果面颜色加深,处理h*值下降较对照更为迅速,至果实成熟,对照h*值下降至77.19,处理下降至62.80,比对照低了18.64%,差异显著。同时,果面色泽参数的变化与样品视觉观察的变化表现出较好的一致性(图2、图3)。
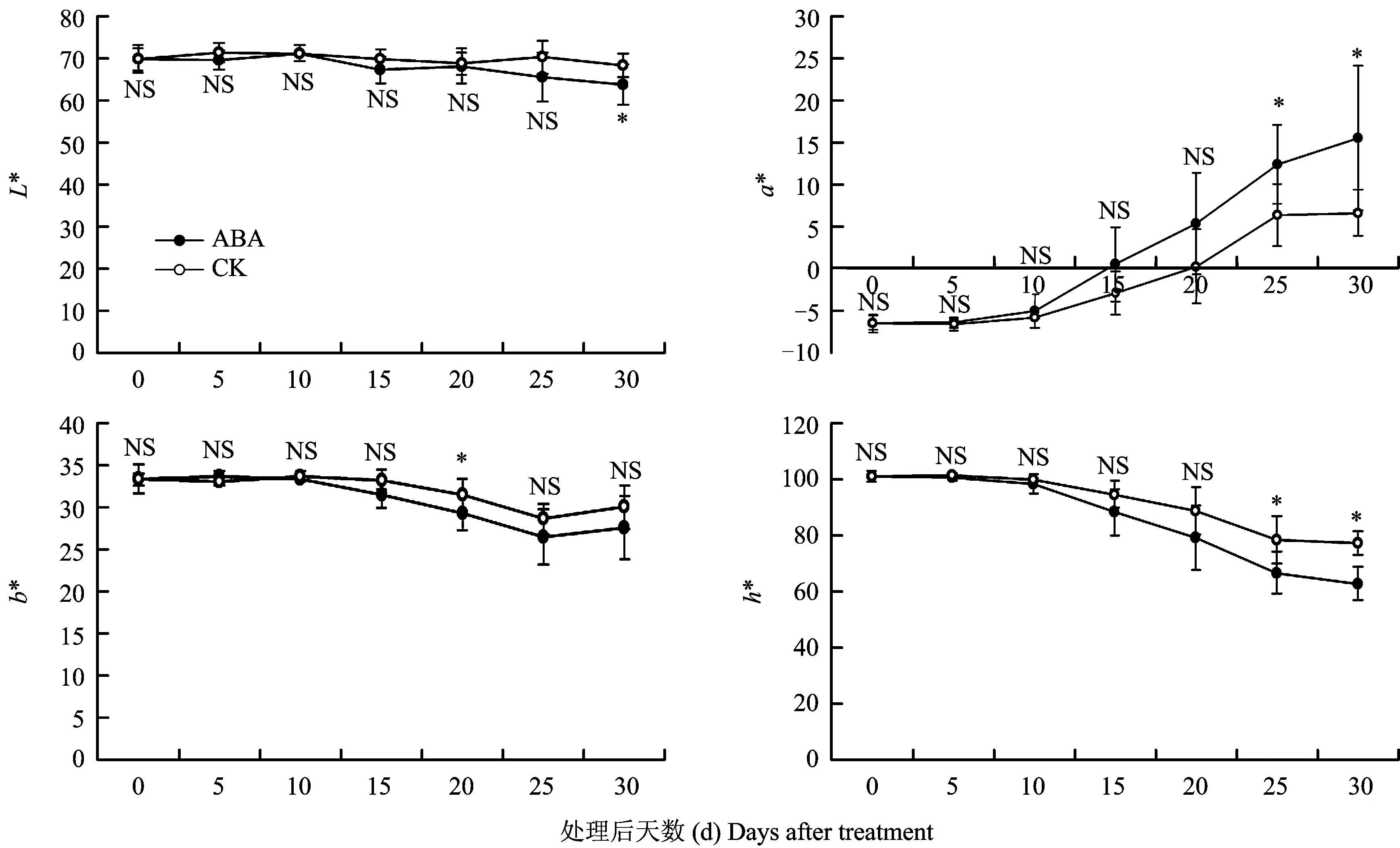
图2 ABA处理对桃果面色泽参数的影响Fig.2 Effects of ABA on the skin color parameters of peach fruit[注(Note): * 代表处理间差异达0.05显著水平Means significantly different at P<0.05 level; ** 代表处理间差异达0.01显著水平Means significantly different at P<0.01 level; NS代表处理间差异不显著Means no obvious difference.]
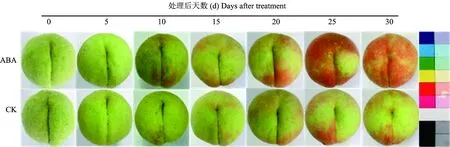
图3 ABA处理对桃果面色泽的影响Fig.3 Effects of ABA on the skin color of peach fruit
2.3 ABA处理对果皮花色素苷积累的影响
图4显示,“美香”果皮中花色素苷含量随果实发育呈明显的上升趋势,ABA处理后果皮花色素苷含量在前期没有明显增加,处理后10 d处理果皮花色素苷含量开始迅速增加,并在之后均显著高于对照。至果实成熟时ABA处理和对照果皮花色素苷含量分别达到3.25和2.33 mg/g,FW,花色素苷含量增加了39.48%,差异显著。因此,ABA处理促进了果皮总花青苷的合成与积累。
2.4ABA处理对果皮花色素苷合成相关基因表达的影响
ABA处理影响果皮花色素苷合成基因转录水平(图4),对照和处理随果实进入着色期,花色素苷合成相关基因上调表达,至果实成熟下调表达。ABA处理对F3H的表达诱导效果不显著,显著促进了CHS中后期的转录水平,在ABA处理下CHS的转录水平在果实着色后期显著提高并维持远高于对照的水平。同时,ABA处理诱导了UFGT、DFR和LDOX3个基因表达时期的前移,处理后3个基因的表达水平迅速上调且相对表达量在处理后10 d 达到最高值,分别上调为对照的10.25、 24.74和26.90倍,之后表达水平下降;对照在处理后15 d 时3个基因的相对表达量达到最高值,比处理晚了5 d左右。ABA处理在促进花色素苷合成的同时也促进了相关基因的转录水平和表达时期的前移。同时,UFGT、DFR、LDOX和CHS4个基因的表达与花色素苷的积累也表现出良好的一致性,推测这是本研究中ABA处理后“美香”果皮色素提前合成与积累的原因。

图4 ABA处理对桃果皮花青苷含量及花色苷合成结构基因表达的影响Fig.4 Effects of ABA on anthocyanin content and the relative expression of anthocyanin structural genes [注(Note): * 代表处理间差异达0.05显著水平Means significantly different at the 0.05 level; ** 代表处理间差异达0.01显著水平Means significantly different at the 0.01 level; NS代表处理间差异不显著Means no obvious difference.]
3 讨论
果实的成熟和品质的形成在很大程度上受植物内源激素的调控[8]。植物内源激素的变化,又调节着果实中各种物质的合成、 运输,进而调节果实成熟和着色的进程。大量研究表明,外源物质处理后势必要打破内源激素在树体内的平衡,进而影响到一些次生物质在树体内的合成与代谢[1, 9-10]。然而,近年来有关外源物质影响桃果实成熟和着色的研究,大多集中在生理水平[2, 11-13],能够拓展到分子生物学水平的研究少有报道。生产实践表明,外源ABA 处理确实有促进桃果实综合品质的效应[4],并且在此基础上对外源ABA的使用浓度和时期进行了探讨和筛选[5],大量的前期研究为本次试验提供了理论基础。
一般情况下,花色素苷含量随着糖含量增加而增加[14]。本研究中,ABA处理促进了花色素苷的合成与积累,但是对可溶性固形物的积累却未有显著影响,同时,花色素苷含量与可溶性固形物含量也未表现出很好的相关性。该结果与成钰厚等[15]人的研究结果类似,这可能是由于糖对花色素苷合成的作用,并不单纯通过糖酵解途径,更多的可能是通过信号机制来促进花色素苷合成,同时,含糖量对花色素苷的影响还受到了其他因素的制约[14, 16]。 大量研究表明,外源ABA可影响叶片中蔗糖代谢相关酶的活性[17], 同时,对植物光合作用、 光合产物的运输积累以及对氮、 磷、 钾等的吸收利用能力有重要影响[18-20]。本研究中,喷施ABA可能同样导致了叶片光合产物积累的变化,进而影响了花色素苷合成途径中关键酶活性以及一些中间产物的含量,最终影响了“美香”果皮花色素苷的积累速率和含量。本研究结果与Ban等[21]的结果相似,这再次显示了ABA可能在桃果实着色过程中起到了一定的调控作用。
目前,果树植物花色素苷合成研究进展迅速,苹果、 葡萄中花色素苷合成途径已经比较明确[16, 22],相关基因的调控机制研究也有很大进展[23-24]。然而,有关桃果实着色过程中相关基因的表达前人研究相对较少。Tsuda等[25]曾指出CHS基因和DFR基因是红肉桃中调节花青素合成的关键基因。本研究中,ABA处理促进了CHS中后期的转录水平,并诱导了DFR表达时期的前移,这表明CHS和DFR在白肉桃果皮花色素苷合成过程中可能同样起到了一定作用。同时,随着果实着色的加深,ABA处理后果皮UFGT、DFR和LDOX的表达规律与果皮花青苷的积累规律呈现了一定的相关性,ABA处理明显促进了3个基因表达高峰的提前。CHS、UFGT、DFR和LDOX表达的结果共同说明了果皮花色素苷的合成可能受到了多个基因的协同调控[26]。然而,F3H的转录水平和花色素苷合成没有表现显著的相关性,这与Ageorges等[27]在葡萄上研究的结果相似,这可能是因为F3H和果皮的花色素苷合成没有紧密关系,而与果实其他部位花色苷的合成有关[27-28]。
值得注意的是,至果实成熟后期所有基因都下调表达,然而,花色素苷仍在大量合成积累,该结果与郭磊等[29]的研究结果相似,可能是由于花色素苷合成相关基因位于花色素合成的上游,当基因大量表达后,果皮产生花色素合成相关酶蛋白,此时即便上游基因不再大量表达,已有酶的活性也能维持花色素合成,同时,大量合成的花色素苷也可能反馈抑制上游基因的表达,导致花色素含量的峰值与基因表达高峰时期不一致。
4 结论
桃果实转色前叶面喷施25 mg/L的ABA,能有效促进果皮花色素苷的合成,同时促进了相关基因的上调和提前表达。这在一定程度上有助于理解ABA促进桃果皮着色更深层次的原因,同时,为更好地认识桃果实着色的分子机理提供一定的理论参考。
[1] 任杰, 冷平. ABA和乙烯与甜樱桃果实成熟的关系[J]. 园艺学报, 2010, 37(2): 199-206. Ren J, Leng P. Role of abscisic acid and ethylene in fruit maturation of sweet cherry[J]. Acta Hort. Sin., 2010, 37(2): 199-206.
[2] 曹永庆, 冷平, 潘烜, 等. 脱落酸在桃果实成熟过程中的作用[J]. 园艺学报, 2009, 36(7): 1037-1042. Cao Y Q, Leng P, Pan Xetal. Role of abscisic acid in fruit ripening of peach[J]. Acta Hort. Sin., 2009, 36(7): 1037-1042.
[3] 霍珊珊, 惠竹梅, 马立娜, 栾丽英. 植物生长调节剂对赤霞珠葡萄果实品质的影响[J]. 西北农林科技大学学报(自然科学版), 2012, 40(1): 183-189. Huo S S, Xi Z M, Ma L N, Luan L Y. Effect of plant growth regulator on the quality of Cabernet sauvignon grape[J]. J. Northwest A & F Univ.(Nat. Sci. Ed.)., 2012, 40(1): 183-189.
[4] 许建兰, 马瑞娟, 张斌斌, 等. 喷施外源物质对霞晖6号桃果实品质的影响[J]. 江苏农业学报, 2011, 27(5): 1078-1082. Xu J L, Ma R J, Zhang B Betal. Influence of exogenous substances on fruit quality of peach variety Xiahui 6[J]. Jiangsu J. Agric. Sci., 2011, 27(5): 1078-1082.
[5] 许建兰, 马瑞娟, 张斌斌, 倪林箭. 叶面喷施不同浓度ABA对美香桃果实品质的影响[J]. 西南农业学报, 2012, 25(3): 1027-1030. Xu J L, Ma R J, Zhang B B, Ni L J. Effects of different concentration of ABA on fruit quality of peach cultivar ‘Meixiang’[J]. Southwest China J. Agric. Sci., 2012, 25(3): 1027-1030.
[6] Dussi M C, Sugar D, Wrolstad R E. Characterizing and quantifying anthocyanin in red pears and the effect of light quality on fruit color[J]. J. Am. Soc. Hort. Sci., 1995, 120(5): 785-789.
[7] 陈长宝, 朱树华, 周杰. 改良CTAB法提取成熟肥城桃果实的总RNA[J]. 山东农业科学, 2009, (5): 102-104. Chen C B, Zhu S H, Zhou J. Improved CTAB method for total RNA extraction of mature Feicheng peach fruit[J]. Shandong Agric. Sci., 2009, (5): 102-104.
[8] 朱明月, 沈文涛, 周鹏. 果实成熟软化机理研究进展[J]. 分子植物育种, 2005, 3(3): 421-426. Zhu M Y, Shen W T, Zhou P. Research advances on mechanism of fruit ripening and softening[J]. Mol. Plant Breed.., 2005, 3(3): 421-426.
[9] 王贵元, 夏仁学. 红肉脐橙果肉中番茄红素和β-胡萝卜素含量的变化及外源ABA和GA3对其的影响[J]. 园艺学报, 2005, 32(2): 207-211. Wang G Y, Xia R X. Lycopene and beta-carotene content in flesh of Cara orange and effects of exogenous ABA and GA3on their content changes[J]. Acta Hort. Sin., 2005, 2005, 32(2): 207-211.
[10] 陈昆松, 李方, 张上隆, Gavin S R. ABA和IAA对猕猴桃果实成熟进程的调控[J]. 园艺学报, 1999, 26(2): 81-86. Chen K S, Li F, Zhang S L, Gavin S R. Role of abscisic acid and indole-3-acetic acid in kiwifruit ripening[J]. Acta Hort. Sin., 1999, 26(2): 81-86.
[11] Ohmiya A. Effects of auxin on growth and ripening of mesocarp discs of peach fruit[J]. Sci. Hort., 2000, 84(3): 309-319.
[12] 朱云娜, 王中华, 张凤颂, 等. 金雀异黄素促进桃果实着色的效应[J]. 园艺学报, 2007, 34(3): 569-574. Zhu Y N, Wang Z H, Zhang F Setal. Effect of genistein on promotion of fruit coloration in peaches[J]. Acta Hort. Sin, 2007, 34(3): 569-574.
[13] 王志霞, 刘国杰, 梁艳萍, 等. 桃果实迅速膨大期生长调节剂及摘心处理对果实品质影响[J]. 中国农业大学学报, 2011, 16(3): 76-80. Wang Z X, Liu G J, Liang Y Petal. Effects of plant growth regulators and topping on peach quality during fruit expansion period[J]. J.China Agric. Univ., 2011, 16(3): 76-80.
[14] 姜卫兵, 徐莉莉, 翁忙玲, 韩健. 环境因子及外源化学物质对植物花色素苷的影响[J]. 生态环境学报, 2009, 18(4): 1546-1552. Jiang W B, Xu L L, Weng M L, Han J. Effects of environmental factors and exogenous chemicals on anthocyanins in plants: A review[J]. Ecol. Environ. Sci., 2009, 18(4): 1546-1552.
[15] 成钰厚, 刘国杰, 孟昭清. 苹果成熟期间果皮花青素含量与果实品质的关系[J]. 果树科学, 1999, 16(2): 98-103. Cheng Y H, Liu G J, Meng Z Q. Relationship between anthocyanidin content in fruit peel and fruit quality during maturation in apples[J]. J. Fruit Sci., 1999, 16(2): 98-103.
[16] 张学英, 张上隆, 骆军, 等. 果实花色素苷合成研究进展[J]. 果树学报, 2004, 21(5): 456-460. Zhang X Y, Zhang S L, Luo Jetal. Advances in research on fruit anthoyanin synthesis[J]. J. Fruit Sci., 2004, 21(5): 456-460.
[17] 魏小春, 李格, 郑群. 脱落酸与赤霉素对瓜尔豆蔗糖代谢酶类的影响[J]. 作物杂志, 2012, (3): 44-48. Wei X C, Li G, Zheng Q. Effects of abscisic acid and gibberellin on sugar metabolization enzymes of guar[J]. Crops, 2012, (3): 44-48.
[18] Chen G, Shi Q, Lips S H. Comparison of growth of flacca and wild-type tomato grown under conditions diminishing their differences in stomatal control[J]. Plant Sci., 2003, 164, 753-757.
[19] 李雪梅, 张利红, 何兴元, 等. 脱落酸对UV-C胁迫下小麦幼苗光合特性及抗氧化酶活性的影响[J]. 应用生态学报, 2006, 17(5): 822-826. Li X M, Zhang L H, He X Yetal. Effects of abscisic acid on photosynthetic characteristics and antioxidant enzyme activities of wheat seedlings exposed to UV-C[J]. Chin. J. App. Ecol., 2006, 17(5): 822-826.
[20] 任旭琴, 缪旻珉. 低温下喷施ABA对辣椒光合特性和NPK的影响[J]. 湖北农业科学, 2008, 47(12): 1461-1463. Ren X Q, Miao M M. Effect of ABA on photosynthesis characteristics and N P K in capsicum annum under chilling stress[J]. Hubei Agric. Sci., 2008, 47(12): 1461-1463.
[21] Ban T, Shiozaki S, Ogata Tetal. Effects of abscisic acid and shading treatment on the levels of anthocyanin and resvratrol in skin of Kyoho gape berry[J]. Acta Hort., 2000, 51(4): 83-89.
[22] Boss P K, Davies C, Robinson S P. Analysis of the expression of anthocyanin pathway genes in developingVitisviniferaL. cv Shiraz grape berries and the implications for pathway regulation[J]. Plant Physiol., 1996, 111: 1059-1066.
[23] Kondo S, Hiraoka K, Kobayashi Setal. Changes in the expression of anthocyanin biosynthetic genes during apple development[J]. J. Am. Soc. Hort. Sci., 2002, 127(6): 971-976.
[24] El-Kereamy A, Chervin C, Roustan J Petal. Exogenous ethylene stimulates the long-term expression of genes related to anthocyanin biosynthesis in grape berries[J]. Physiol. Plant., 2003, 119: 175-182.
[25] Tsuda T, Yamaguchi M, Honda C, Moriguchi T. Expression of anthocyanin biosythesis genes in the skin of peach and nectarine fruit[J]. J. Am. Soc. Hort. Sci., 2004, 129(6): 857-862.
[26] 许志茹, 李春雷, 崔国新, 孙燕. 植物花青素合成中的MYB蛋白[J]. 植物生理学通讯, 2008, 44(3): 597-604. Xu Z R, Li C L, Cui G X, Sun Y. MYB protein of anthocyanin biosynthesisin in plant[J]. Plant Physiol. J., 2008, 44(3): 597-604.
[27] Ageorges A, Fernandez L, Vialet Setal. Four specific isogenes of the anthocyanin metabolic pathway are systematically co-expressed with the red colour of grape berrie[J]. Plant Sci., 2006, 170: 372-383.
[28] 刘闯萍, 王军. 葡萄花色苷的生物合成[J]. 植物生理学通讯, 44(2): 363-377. Liu C P, Wang J. Anthocyanin biosynthesis in grapevine[J]. Plant Phys. Comm., 2008, 44(2): 363-377.
[29] 郭磊, 王涛, 岳林旭, 等. 藤稔葡萄主枝环剥对果实着色及相关基因表达的影响[J]. 园艺学报, 2012, 39(3): 409-416. Guo L, Wang T, Yue L Xetal. Influence of main-branch-girdling on berry coloring and expression of some related genes in ‘Fujiminori ’grapevine[J]. Acta Hort. Sin., 2012, 39(3): 409-416.
EffectoffoliarapplicationofABAonfruitcolorationandexpressionofsomerelatedgenesinpeach
GUO Lei, CAI Zhi-xiang, ZHANG Bin-bin, XU Jian-lan, SONG Hong-feng, MA Rui-juan*
(InstituteofHorticulture,JiangsuAcademyofAgriculturalSciences,Nanjing210014,China)
2013-01-24接受日期2013-07-24
江苏省农业科技自主创新项目(CX(11)1009);现代农业产业技术体系建设专项资金(CARS-31)资助。
郭磊(1984—),男,山西太原人,硕士,主要从事果树栽培生理方面的研究。E-mail: guolei_92@163.com * 通信作者 E-mail: rjmajaas@aliyun.com.cn
S 662.1.601
A
1008-505X(2013)06-1464-07
