不同种植模式对甘蔗根际土壤生物学特性的影响
2013-10-16张爱加周明明林文雄
张爱加 , 周明明 , 林文雄*
(1福建农林大学农业生态研究所, 福州 350002; 2莆田市生物工程研究所, 福建莆田 351100)
不同种植模式对甘蔗根际土壤生物学特性的影响
张爱加1, 2, 周明明1, 林文雄1*
(1福建农林大学农业生态研究所, 福州 350002; 2莆田市生物工程研究所, 福建莆田 351100)
甘蔗多年单一化的宿根栽培导致甘蔗产量下降,而套种豆科作物能较明显地提高宿根蔗产量。本研究以“赣蔗18”的新植栽培、 宿根栽培和宿根/大豆套种栽培的甘蔗根际土壤为对象,结合土壤微生物区系、 土壤酶活性,甘蔗基本农艺性状及其产量、 质量指标,揭示宿根蔗套种大豆的增产机制及生物学意义。结果表明,不同种植模式下甘蔗蔗糖含量基本一致,但宿根蔗套种大豆由于茎径粗大而较宿根连作表现出明显的产量优势。不同栽培模式下甘蔗根际土壤酶活性有显著差异,套种明显提高了宿根蔗根际土壤酶活性,尤其是与碳、 氮、 磷循环相关的蔗糖酶、 脲酶、 酸性磷酸单酯酶。不同栽培模式下甘蔗根际土壤微生物总量有显著性差异,单一宿根连作甘蔗根际土壤微生物总量和细菌/真菌比例降低,而宿根蔗套种大豆根际土壤微生物总量和细菌/真菌比例提高,使甘蔗根际土壤微生物从“真菌型”向“细菌型”转变。总之,单一的宿根连作可导致根际土壤总微生物量及酶活性下降,引起土壤微生物介导的营养循环受阻,从而使甘蔗产量下降,而宿根蔗套种大豆模式对根际土壤微生物区系具有明显的改善作用,宿根蔗具有明显的产量优势。
宿根蔗; 套种; 微生物区系; 磷脂脂肪酸; 土壤酶活性
Abstract: Ratooning cane monoculture leads to yield decline, but ratooning cane intercropped with legume crops increases the yields. The rhizosphere soils of “Ganzhe 18” newly planted sugarcane, ratooning sugarcane and its intercropping with soybean were used to study the alteration of the microflora and soil enzyme activities, and as well as some agronomic traits indexes. The sugar contents of the canes show no significant difference in different cultivation modes. However, owing to the larger diameter of ratooning cane, the ratooning cane intercropped with soybean has high yield. Furthermore, the soil enzyme activities in the rhizosphere soils under different cultivation modes are significantly different. The intercropping practice increases the enzyme activities, especially the activities of three soil enzymes involved in the cycles of carbon, nitrogen, and phosphorus, i.e., invertase, urease and phosphomonoesterase. The microbial biomass and the ratio of bacteria/fungi are decreased under the ratooning cane monoculture mode but recovered under the intercropping ratooning cane with soybean, suggesting a shift from fungal type to bacterial type in the compositions of microbial communities between two systems. The ratooning practice declines the total microbial biomass and the soil enzyme activities, suggesting that the nutrient cycles mediated by microbes in ratooning cane soil are blocked and thus decreased the yield of sugarcane, whereas, the intercropping mode has a significant improvement on soil microflora, which increases the yield of sugarcane.
Keywords: ratoon sugarcane; intercropping; microflora; phospholipid fatty acid(PLFA); soil enzyme activity
甘蔗(SaccharumofficenarumL.)是能进行多年宿根栽培的禾本科作物,也是我国重要的制糖原料,其种植区域主要分布在南方的广西、 云南、 广东、 海南、 福建和台湾等省区,常年种植面积占我国糖料作物面积的 85%以上,产糖量占食糖总产的 90%以上,甘蔗已成为蔗区农民脱贫致富和该区农业的主导产业[1]。
宿根连作栽培(consecutive monoculture)是种植甘蔗通常采用的模式,具有省种省工、 节省成本、 提高效益之效果。但是甘蔗长期宿根连作会导致其生长不良,病虫害严重,影响作物产量与质量,即连作障碍。如何克服或消减作物因宿根(ratooning cultivation)或连作栽培(consecutive monoculture)而导致的连作障碍问题(monculture problems)已成为国内外同行关注的焦点之一[2-4]。朱有勇及其同事[5]通过利用不同水稻品种(地方和杂交品种)的混合间栽模式来控制稻瘟病的实践表明,采取不同品种间的混栽或间作种植方式,可以增加有害生物和寄主的多样化,使任何一种有害生物都达不到大规模流行的条件,从而达到有效持续控制病虫害、 大大减少农药和化肥的使用量、 改善农业生态环境、 提高水稻单位面积的产量和品质的目的。李隆等[6]研究还表明,在高氮低磷处理条件下,禾本科作物玉米套种豆科作物蚕豆对双方均有利,经 4年的试验观察,玉米和蚕豆分别比其单作增产 46%和 23%。这是因为套种的蚕豆不仅能够增强固氮能力而促进自身生长发育,还可以通过其根系与玉米根系的互作关系,分泌一些有机酸和质子酸化根际环境,从而提高土壤磷营养有效性及其含量,促进玉米生长发育而增产。 Fang等[7]的研究结果还表明,玉米与大豆间套作存在一种有趣的临近植物根系识别(neighbor recognition behavior)及协调磷营养状态(coordinating phosphorus status)的行为,因此合理的作物品种选择与科学搭配是创造理想作物群落结构、 提高生物多样性、 改善生物关系、 提高系统生产力的关键[6-7]。
长期的生产实践表明,春植蔗间套作豆科作物是一种比较理想的种植模式,因为豆科作物一般较矮生,早生,根系分布较窄,所需矿质营养不同于甘蔗,且有根瘤菌固定空气中的游离氮和较多的茎叶可压青作肥,有利于甘蔗生长,春植蔗生长前期,植株矮小,一般在 7月才封行,互相荫蔽的影响不大[8],陈怀珠等[9]研究表明,适应性好的早熟春大豆间作甘蔗,甘蔗的分蘖数虽比单作栽培减少 27.6%,但有效茎较单作高了 5.7%,经多年多次试验示范,增产效果明显。然而,对于宿根蔗套种大豆增产增收机制研究,目前多集中在土壤酶活性及其肥力变化、 作物营养状况等方面,但对其根际土壤微生物多样性的影响研究较少。实际上,土壤微生物是农田生态系统的重要组成部分,充当土壤中一个强大的动力资源库,在植物残体降解、 腐殖质形成及土壤肥力形成,植物养分转化与循环中扮演着十分重要的角色[10-14]。前人研究表明,作物合理间套种可以通过增加土壤微生物多样性,建立对土传病原菌的有益拮抗种群,改善生物关系,促进营养循环,提高系统机能,使作物高产稳产[15-16],然而,有关宿根蔗套种大豆对这方面的影响研究鲜见报道。据此,本研究从不同栽培模式甘蔗根际土壤微生物组成及其变化规律以及土壤酶活性及其动态特征出发,分析不同种植模式对甘蔗根际土壤微生物的影响,以期为阐明宿根蔗套种大豆的生物学意义与增产机理提供理论依据和技术支撑。
1 材料与方法
1.1 试验设计与材料

根际土壤采集方法为: 将植株根部完整挖出,抖掉与根系松散结合的土壤,收集与根系紧密结合的土壤作为根际土壤。样品采集时间为 2011年 9月 15日,为甘蔗拔节伸长期,每小区按 5点随机取样,混合样品,并过 2 mm筛以除去植物根系残体,新鲜的土样立即用于土壤酶活性和磷脂脂肪酸的测定,每个样品重复 3次。
1.2 研究方法
土壤基本理化性质采用常规分析法测定。用电位测定法测定土壤 pH值,水壤比为 2.5 ∶1;有机质用重铬酸钾容量法;速效氮用碱解扩散—硼酸吸收法;速效磷用钼锑抗比色法;速效钾用火焰光度法测定。
多酚氧化酶和过氧化物酶活性测定方法参照Yu等[17]的方法,以 1%焦性没食子酸为底物,测定 2h 后1 g干土中紫色没食子素的含量,两种酶活性单位均以[gallnut μg/(g·h)]表示。蔗糖酶活性测定参照Wang等[18]的方法,以 8%蔗糖为底物, 测定24h 后1 g干土中葡萄糖的含量,蔗糖酶活性单位以[glucose μg/(g·d)]表示。脲酶活性测定参照Wang等[18]的方法,以 10%尿素为底物,测定24h 后1 g干土中氨基氮的含量,脲酶活性单位以[NH4-N μg/(g·d)]表示。酸性磷酸单酯酶活性测定方法参照Carine等[19],以 50 mmoL四水对硝基苯磷酸二钠为底物,测定单位时间内1 g干土生成对硝基苯酚的含量,酸性磷酸单酯酶活性单位以[p-Np μg/(g·h)]表示。

微生物特征性脂肪酸有: 细菌标记性脂肪酸(如12 ∶0,14 ∶0,a16 ∶0,18 ∶0, cy17 ∶0,cy19 ∶0等)[20-25];真菌标记性脂肪酸(18 ∶1ω9c,18 ∶2ω,18 ∶3ω等特征脂肪酸)[20, 26-27];放线菌标志性脂肪酸(10Me17 ∶0,10Me18 ∶0)[20, 28];原生动物标记性脂肪酸(20 ∶4ω等)[29]。
磷脂脂肪酸含量的标定与计算 土壤中某磷脂脂肪酸质量的计算公式为 Cx=(Mi/Ai)×Ax/M,式中: M为土壤质量(g); Ax为该磷脂脂肪酸甲酯 GC图谱上的积分面积; Mi为内标磷脂脂肪酸甲酯的质量(μg); Ai为内标磷脂脂肪酸甲酯在 GC图谱上的积分面积,最后统一换算成摩尔质量(nmol/g)。
蔗糖糖分含量测定使用折光锤度计,从测定单茎重的甘蔗中随机选取 10株,每株样品分上、 中、 下三段进行甘蔗锤度测定,计算平均锤度,含糖量计算公式为: 甘蔗蔗糖分(%)=锤度(%)×1.0825-7.703。
甘蔗产量计算公式: 1)单茎重(kg)=茎径2×(株高-30)×0.7854/1000 ; 2)理论产量(kg/hm2)=单茎重(kg)×有效茎数(No./hm2)。
试验数据采用方差分析及主成份分析,分析软件为 EXCEL,DPS v7.05和SPSS 11.5。
2 结果与分析
2.1 不同栽培模式下甘蔗农艺性状及产量和质量
甘蔗农艺性状调查结果表明,3种栽培模式下甘蔗株高相当, NP栽培模式下甘蔗有效茎数最高, IS栽培模式最低,但 IS栽培模式下甘蔗茎径明显高于 RS和 NP。不同栽培模式下甘蔗产量质量调查结果表明,3种处理下甘蔗糖分含量基本一致,但 IS较 RS表现出明显的产量优势(表 1)。
2.2不同栽培模式下甘蔗根际土壤理化性质分析
从表2 可以看出,3种栽培模式甘蔗根际土壤pH与CK相差不大,均呈酸性; 3种栽培模式甘蔗根际土壤有机质含量比CK低,达显著差异水平,但3种栽培模式之间差异不显著;3种栽培模式的碱解氮含量与CK差异均不显著;速效磷含量均高于CK,达显著差异水平,但3种模式之间差异不显著;速效钾含量呈IS>RS>NP>CK,RS与IS差异达显著水平,IS与NP差异达显著水平,而NP与CK差异不显著。

表1 不同栽培模式下甘蔗的农艺性状及产量
注(Note): NP—新植蔗Newly planted cane; RS— 一年宿根蔗1st-year ratoon cane; IS— 一年宿根蔗套种大豆1st-year ratoon cane intercropped with soybean. 大豆产量指带豆荚的鲜毛豆产量 The soybean yield refers to the yield of fresh soybean with pod. 同列数据后不同字母表示不同栽培模式间差异达5%显著水平Values followed by different letters in a column are significant different among cultivation modes at the 5% level.

表2 不同栽培模式下甘蔗根际土壤基本理化性质
注(Note): NP—新植蔗Newly planted cane; RS— 一年宿根蔗1st-year ratoon cane; IS— 一年宿根蔗套种大豆1st-year ratoon cane intercropped with soybean.同列数据后不同字母表示不同栽培模式间差异达5%显著水平Values followed by different letters in a column are significant different among cultivation modes at the 5% level.
2.3 不同栽培模式下甘蔗根际土壤酶活性分析
蔗糖酶、 脲酶、 磷酸单酯酶分别参与碳、 氮、 磷循环,过氧化物酶、 多酚氧化酶与环境胁迫相关。NP栽培模式下甘蔗根际土壤多酚氧化酶、 过氧化物酶、 蔗糖酶、 脲酶、 酸性磷酸单酯酶活性分别为 148.95 μg/(g·h)、 315.22 μg/(g·h)、 2676.71 μg/(g·d)、 185.23 μg/(g·d)、 57.28 μg/(g·h); IS栽培模式分别为147.46 μg/(g·h)、 279.17 μg/(g·h)、 2656.47 μg/(g·d)、 353.20 μg/(g·d)、65.55 μg/(g·h);RS栽培模式下分别为110.67 μg/(g·h)、 237.12 μg/(g·h)、 1414.73 μg/(g·d)、 159.86 μg/(g·d)、 38.22 μg/(g·h)(图 1)。 IS栽培模式下甘蔗根际土壤多酚氧化酶、 过氧化物酶、 蔗糖酶、 脲酶、 酸性磷酸单酯酶活性分别是 RS的 1.33倍、 1.17倍、 1.88倍、 2.21倍、 1.71倍,且达到 NP栽培模式的酶活性水平。统计分析结果表明,除多酚氧化酶差异不显著外,其余4种酶活性均表现出显著差异。由此可见,套种明显提高了宿根蔗根际土壤酶活性,尤其是与碳、 氮、 磷循环相关的蔗糖酶、 脲酶、 酸性磷酸单酯酶,使宿根蔗根际土壤酶活性趋于向高活性方向转化。
2.4不同栽培模式下甘蔗根际土壤微生物多样性的PLFA分析
经 GC-MS测定,共鉴定出 26种脂肪酸,其中有 20种微生物标记性脂肪酸(表3)。由表 3、 表 4可以看出,不同栽培模式下甘蔗根际土壤微生物总量表现出不同的变化趋势。方差分析表明,不同栽培模式下甘蔗根际土壤微生物总量有显著性差异。 NP栽培模式下,甘蔗根际土壤微生物总量最高,IS次之,RS最低。可见,宿根蔗栽培会使甘蔗根际土壤微生物总量降低,但套种模式使其较明显增加。
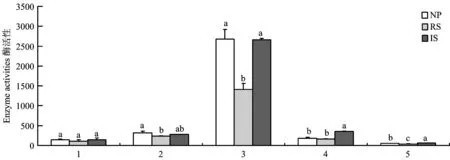
图1 不同栽培模式下甘蔗根际土壤酶活性Fig.1 The enzyme activities in sugarcane rhizosphere soils under different cultivation modes{注(Note): NP—新植蔗Newly planted cane; RS— 一年宿根蔗1st-year ratoon cane; IS— 一年宿根蔗套种大豆1st-year ratoon cane intercropped with soybean. 1—多酚氧化酶Polyphenol oxidase[gallnut μg/(g·h)]; 2—过氧化物酶Peroxidase[gallnut μg/(g·h)]; 3—蔗糖酶Invertase[glucose μg/(g·d)]; 4—脲酶urease[NH4-N μg/(g·d)]; 5—酸性磷酸单酯酶Acid phosphomonoesterase[p-Np μg/(g·h)]. 柱上不同字母表示不同栽培模式间差异达5%显著水平Different letters above the bars are significant different among cultivation modes at the 5% level.}
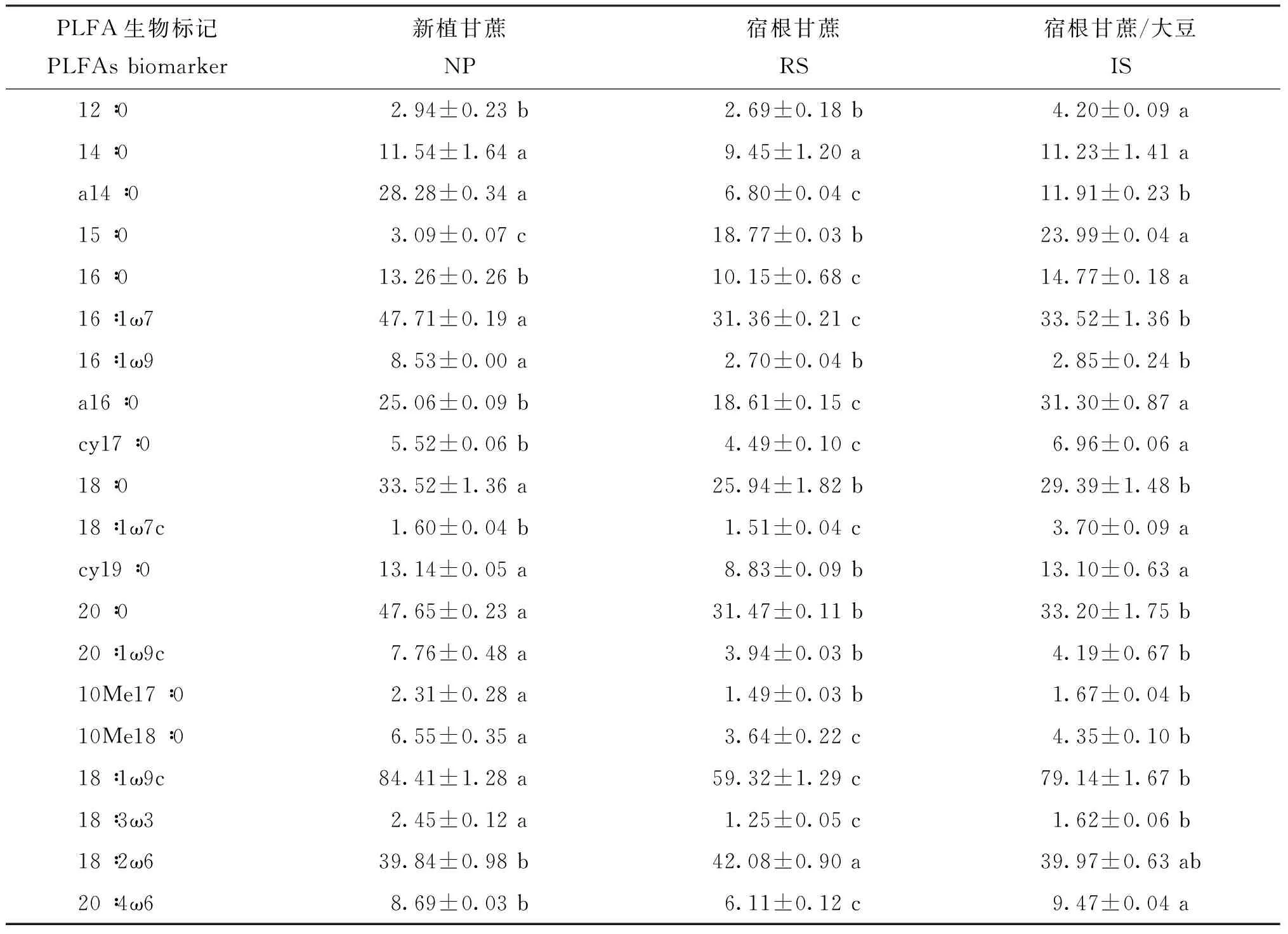
PLFA生物标记 PLFAsbiomarker 新植甘蔗NP宿根甘蔗RS宿根甘蔗/大豆IS12∶02.94±0.23b2.69±0.18b4.20±0.09a14∶011.54±1.64a9.45±1.20a11.23±1.41aa14∶028.28±0.34a6.80±0.04c11.91±0.23b15∶03.09±0.07c18.77±0.03b23.99±0.04a16∶013.26±0.26b10.15±0.68c14.77±0.18a16∶1ω747.71±0.19a31.36±0.21c33.52±1.36b16∶1ω98.53±0.00a2.70±0.04b2.85±0.24ba16∶025.06±0.09b18.61±0.15c31.30±0.87acy17∶05.52±0.06b4.49±0.10c6.96±0.06a18∶033.52±1.36a25.94±1.82b29.39±1.48b18∶1ω7c1.60±0.04b1.51±0.04c3.70±0.09acy19∶013.14±0.05a8.83±0.09b13.10±0.63a20∶047.65±0.23a31.47±0.11b33.20±1.75b20∶1ω9c7.76±0.48a3.94±0.03b4.19±0.67b10Me17∶02.31±0.28a1.49±0.03b1.67±0.04b10Me18∶06.55±0.35a3.64±0.22c4.35±0.10b18∶1ω9c84.41±1.28a59.32±1.29c79.14±1.67b18∶3ω32.45±0.12a1.25±0.05c1.62±0.06b18∶2ω639.84±0.98b42.08±0.90a39.97±0.63ab20∶4ω68.69±0.03b6.11±0.12c9.47±0.04a
注(Note): NP—新植蔗Newly planted cane; RS— 一年宿根蔗1st-year ratoon cane; IS— 一年宿根蔗套种大豆1st-year ratoon cane intercropped with soybean. i、 a、 cy和Me分别表示异丙基、 反异丙基、 环丙基和甲基分支脂肪酸;ω表示双键的位置(甲基端起); c、 t分别表示顺式及反式脂肪酸i, a, cy and Me refer to iso-,anteiso-,cyclopropyl and methyl branching fatty acids, respectively; ω refers to the position of double bonds(from the methyl end); c and t refer to the cis-configuration and trans-configuration, respectively. 同行数据后不同字母表示每种磷脂脂肪酸在不同处理间差异达5%显著水平Values followed by different letters in a row are significant different among treatments at the 5% level.
3种供试土壤的 20种微生物标记性脂肪酸的主成份分析结果表明, NP栽培模式位于主成份 1的正端,主成份 2的负端; RS位于主成份 1的负端,主成份 2的负端;IS位于主成份 1的负端,主成份 2的正端(图 2),同时对主成份1的得分系数进行方差分析显示,主成份1的得分系数差异显著,可见主成份 1、 主成份 2能够区分不同栽培模式下甘蔗根际土壤微生物群落特征,分别解释变量方差的62.12%、 37.88%,且3种不同栽培模式下甘蔗根际土壤微生物群落特征差异显著,其中 NP和 IS栽培模式下的土壤有较相似的微生物群落结构。
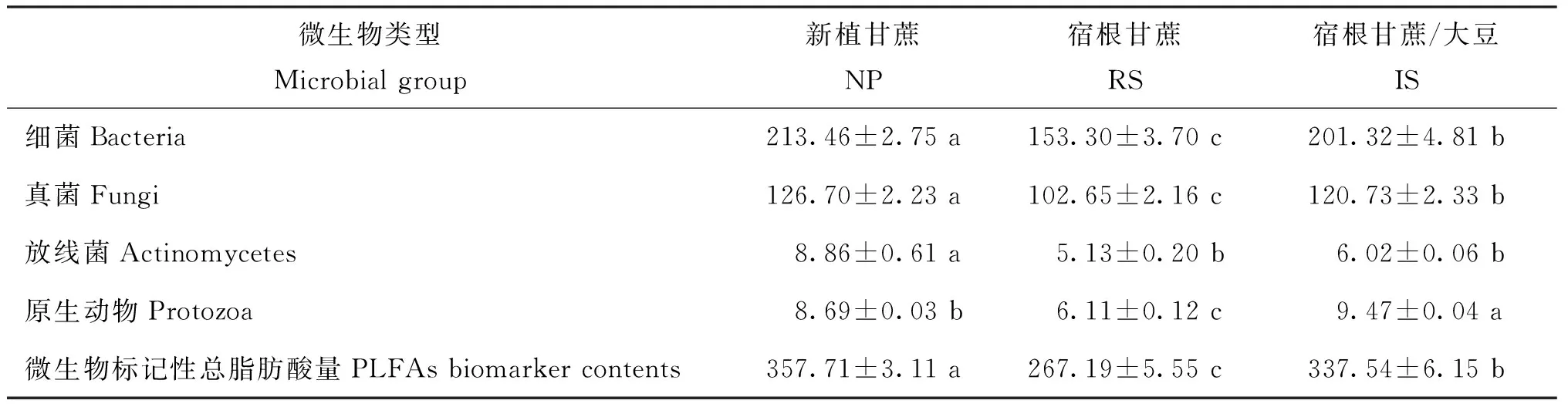
表4 估算不同栽培模式下甘蔗根际土壤微生物量(nmol/g)
注(Note): NP—新植蔗Newly planted cane; RS— 一年宿根蔗1st-year ratoon cane; IS— 一年宿根蔗套种大豆1st-year ratoon cane intercropped with soybean.同行数据后不同字母表示不同处理间差异达5%显著水平Values followed by different letters in a row are significant differences among treatments at the 5% level.
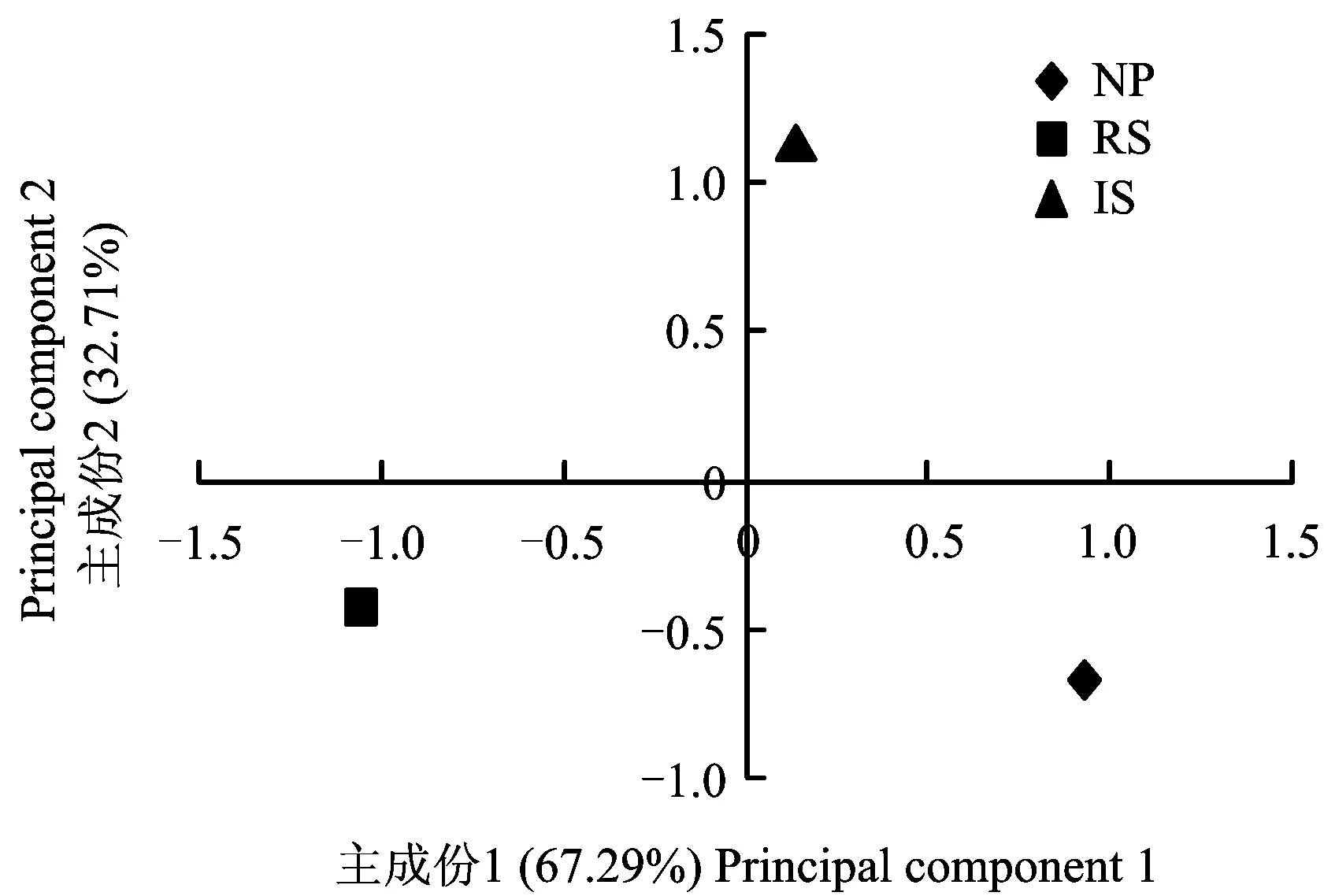
图2 不同栽培模式下甘蔗根际土壤微生物标记性磷脂脂肪酸的主成份分析Fig.2 Analysis of microbial PLFAs principal components in sugarcane rhizosphere soils under different cultivation modes
由表4还可以看出,3种栽培模式下土壤中细菌、 真菌、 放线菌、 原生动物的生物量均有显著性差异。 NP、 RS、 IS栽培模式下土壤中细菌/真菌比例分别为 1.68、 1.49、 1.67, NP和IS的细菌/真菌比例相当, RS最低。说明单一化宿根栽培会导致甘蔗根际土壤微生物中细菌/真菌比例降低,但宿根蔗/大豆套作可以提高甘蔗根际土壤中的细菌/真菌比例,达到新植蔗土壤的水平。相应的3种栽培模式下的土壤中放线菌总生物量占微生物总量的比例分别为2.48%、 1.92%、 1.78%,原生动物分别为 2.43%、 2.29%、 2.81%, IS栽培模式下土壤放线菌比例较 RS、 NP偏低,但原生动物比例明显高于 RS和 NP。
3 讨论与结论
综上所述,在不同栽培模式下,甘蔗有效茎数、 茎径呈现出显著性差异。在新植蔗条件下,甘蔗有效茎数最高,产量也最高,但宿根连作栽培下,甘蔗有效茎数、 茎径均明显降低,产量显著下降,但宿根蔗套种大豆栽培模式下,宿根甘蔗可通过增加其茎粗而增加产量,使其与新植蔗产量持平,且额外增收大豆(鲜毛豆) 5550 kg/hm2。究其原因,主要与不同栽培模式下甘蔗根际微生态环境呈现出显著性差异有关。对供试土壤的 20种微生物标记性脂肪酸进行主成份分析表明,不同栽培处理对甘蔗根际土壤微生物群落特征有显著影响。单一化宿根连作栽培导致甘蔗根际土壤细菌/真菌比例降低,即 RS
[1] 刘文秀. 浅谈我国糖料蔗收获质量现状及标准[J].甘蔗生产机械化, 2009, (3): 5-7. Liu W X. A brief introduction in present situation and standard of sugarcane harvest quality[J]. Mechaniz. Sugarcane Prod., 2009, (3): 5-7.
[2] 林文雄, 陈婷, 周明明. 农业生态学的新视野[J].中国生态农业学报, 2012, 20(3): 253-264. Lin W X, Chen T, Zhou M M. New dimensions in agroecology[J]. Chin. J. Eco-Agric., 2012, 20(3): 253-264.
[3] 吴凤芝, 孟立君, 王学征.设施蔬菜轮作和连作土壤酶活性的研究[J].植物营养与肥料学报, 2006, 12(4): 554-558. Wu F Z, Meng L J, Wang X Z. Soil enzyme activities in vegetable rotation and continuous cropping system of under shed protection[J]. Plant Nutr. Fert. Sci., 2006, 12(4): 554-558.
[4] 龚恒亮, 安玉兴.中国糖料作物地下害虫[M]. 广州: 暨南大学出版社, 2010. Gong H L, An Y X. Underground insects of sugar crops in China[M].Guangzhou: Jinan University Press, 2010.
[5] Zhu Y Y, Chen H R, Fan J Hetal. Genetic diversity and disease control in rice[J]. Nature, 2000, 406(6797): 718-722.
[6] Li L, Li S M, Sun J Hetal. Diversity enhanced agricultural productivity via rhizosphere phosphorus facilitation on phosphorus-deficient soils[J]. Proc. Nat. Acad. Sci., 2007, 104(27): 11192-11196.
[7] Fang S, Gao X, Deng Yetal. Crop root behavior coordinates phosphorus status and neighbors: from field studies to three-dimensional in situ reconstruction of root system architecture[J]. Plant Physiol, 2011, 155(3): 1277-1285.
[8] 王鉴明.中国甘蔗栽培学[M]. 北京: 农业出版社, 1985. Wang J M. Sugarcane cultivation in China[M].Beijing: Agriculture Press, 1985.
[9] 陈怀珠, 孙祖东, 杨守臻.早熟大豆品种与甘蔗间作的适应性研究[J]. 广西农业科学, 2001, (6): 293-295. Chen H Z, Sun Z D, Yang S Z. The adaptability study in intercropping early-maturing soybean with sugarcane[J]. J. Guangxi Agric. Sci., 2001, 6: 293-295.
[10] Kennydy A C, Smith K L. Soil microbial diversity index and the sustainability of agricultural soils[J]. Plant Soil, 1995, 170: 75-86.
[11] Bollag J M, Senesi N, Huang P M. Interactions between soil minerals and microorganisms: Impact on the terrestrial ecosystem[M].New York: Marcel Dekker, 1992. 307-379.
[12] Schutter M E, Sandeno J M, Dick R P. Seasonal, soil type, alternative management influences on microbial communities of vegetable cropping systems[J]. Biol. Ertil. Soils, 2001, 34: 397-410.
[13] Yao H, He Z, Wilson M J, Campbell C D. Microbial biomass and community structure in a sequence of soils with increasing fertility and changing land use[J]. Microb. Ecol., 2000, 40: 223-237.
[14] 李阜棣. 土壤微生物学[M]. 北京: 中国农业出版社, 1996. Li F L. Soil microbiology[M]. Beijing: China Agriculture Press, 1996.
[15] Latz E, Eisenhauer N, Rall1 B Cetal. Plant diversity improves protection against soil-borne pathogens by fostering antagonistic bacterial communities[J]. J. Ecol., 2012, (1): 1365-2745.
[16] Roscher C, Schumacher J, Baade Jetal. The role of biodiversity for element cycling and trophic interactions: an experimental approach in a grassland community[J]. Basic Appl. Ecol., 2004, 5: 107-121.
[17] Yu X Z, Wu S C, Wu F Yetal. Enhanced dissipation of PAHs from soil using mycorrhizal ryegrass and PAH-degrading bacteria[J]. J. Hazard Mater, 2011, 186(2-3): 1206-1217.
[18] Wang Q Y, Zhou D M, Cang L. Microbial and enzyme properties of apple orchard soil as affected by long-term application of copper fungicide[J]. Soil Biol. Biochem., 2009, 41(7): 1504-1509.
[19] Carine F, Capowiez Y, Stéven C. Enzyme activities in apple orchard agroecosystems: How are they affected by management strategy and soil properties[J]. Soil Biol. Biochem., 2009, 41(1): 61-68.
[20] 刘波, 胡桂萍, 郑雪芳, 等. 利用磷脂脂肪酸(PLFAs)生物标记法分析水稻根际土壤微生物多样性[J]. 中国水稻科学, 2010, 24(3): 278- 288. Liu B, Hu G P, Zheng X Fetal. Analysis on microbial diversity in the rhizosphere of rice by phospholipid fatty acids biomarkers[J]. Chin. J. Rice Sci., 2010, 24(3): 278- 288.
[21] Christopher T, Green, Kate M S. Analysis of phospholipid fatty acids(PLFA) to characterize microbial communities in aquifers[J]. J. Hydrogeol., 2000, 8: 126-141.
[22] Kimura M, Asakawa S. Comparison of community structures of microbiota at main habitats in rice field ecosystems based on phospholipid fatty acid analysis[J]. Biol. Fert. Soils, 2006, 43: 20-29.
[23] Ohansen A, Olsson S. Using phospholipid fatty acid technique to study short term effects of the biological control agentPseudomonasfluorescensDR54 on the microbial microbiota in barley rhizosphere[J]. Microb. Ecol., 2005, 49: 272-281.
[24] Miethling R, Wieland G, Backhaus Hetal. Variation of microbial rhizosphere communities in response to crop species, soil origin, and inoculation with Sinorhizobium meliloti L33[J]. Microb. Ecol., 2000, 41: 43-56.
[25] Bāāth E, Anderson T H. Comparison of soil fungal/bacterial ratios in a pH gradient using physiological and PLFA based techniques[J]. Soil Biol. Biochem., 2003, 35: 955-963.
[26] McKinleya V L, Peacock A D, White D C. Microbial community PLFA and PHB responses to ecosystem restoration in tallgrass prairie soils[J]. Soil Biol. Biochem., 2005, 37: 1946-1958.
[27] 齐鸿雁, 薛凯, 张洪勋. 磷脂脂肪酸谱图分析方法及其在微生物生态学领域的应用[J]. 生态学报, 2003, 23(8) : 1577-1579. Qi H Y, Xue K, Zhang H X. Phospholipid fatty acid analysis and its applications in microbial ecology[J]. Acta Ecol. Sin., 2003, 23(8): 1577-1579.
[28] Joergensen R G, Potthoff M. Microbial reaction in activity, biomass and community structure after long-term continuous mixing of a grassland soil[J]. Soil Biol. Biochem., 2005, 37: 1249-1258.
[29] Yu S, He Z L, Huang C Y. Advances in their search of soil microorganisms and their mediated processes under heavy metal stress[J]. J. Appl. Ecol., 2003, 14: 618-622.
[30] Wang H B, Zhang Z X, Li Hetal. Characterization of metaproteomics in crop rhizospheric soil[J]. J. Proteome Res., 2011, 10(3): 932-940.
[31] Wu L K, Wang H B, Zhang Z Xetal. Comparative metaproteomic analysis on consecutively Rehmannia glutinosa monocultured rhizosphere soil[J]. PLoS ONE, 2011, 6(5): e20611.
[32] Li Z F, Yang Y Q, Xie D Fetal. Identification of autotoxic compounds in fibrous roots of Rehmannia(Rehmannia glutinosa Libosch.)[J]. PLoS ONE, 2012, 7(1): e28806.
[33] Boerner R E J, Brinkman J A, Smith A. Seasonal variations in enzyme activity and organic carbon in soil of a burned and unburned hardwood forest[J]. Soil Biol. Biochem., 2005, 37: 1419-1426.
Effectsofdifferentcultivationpatternsonmicroorganismofsoilrhizosphereinsugarcanefields
ZHANG Ai-jia1, 2, ZHOU Ming-ming1, LIN Wen-xiong1 *
(1InstituteofAgroecology,FujianAgricultureandForestUniversity,Fuzhou350002,China; 2InstituteofBioengineeringofPutianCity,Putian,Fujian351100,China)
2013-05-10接受日期2013-06-29
国家重点基础研究发展计划“973计划”(2012CB126309) 项目资助。
张爱加(1965—),男,莆田城厢人,博士研究生,主要从事作物生理生态学研究。E-mail: zaj333@sohu.com 周明明与第一作者同等贡献。E-mail: mmzhou0609.163.com * 通信作者 E-mail: wenxiong181@163.com
S566.1;S154
A
1008-505X(2013)06-1525-08
