“薄浅湿晒”灌溉稻田土壤微生物量碳、氮和酶活性研究
2013-10-16梁燕菲张潇潇李伏生
梁燕菲, 张潇潇, 李伏生
(广西大学农学院,南宁 530005)
“薄浅湿晒”灌溉稻田土壤微生物量碳、氮和酶活性研究
梁燕菲, 张潇潇, 李伏生*
(广西大学农学院,南宁 530005)

灌溉方式; 微生物量碳、 氮; 土壤酶活性; 硝化细菌; 水稻土
Abstract: A pot experiment was carried out to study effects of the “thin-shallow-wet-dry” irrigation method on microbial biomass carbon(MBC), microbial biomass nitrogen(MBN), the numbers of nitrification bacteria and denitrification bacteria and enzyme activities in soils at the jointing, booting and milky stages of rice under different nitrogen(N) levels, and to explore variation of soil microbe activities under the irrigation method. There were two irrigation methods, conventional irrigation(CIR) and “thin-shallow-wet-dry” irrigation(TIR), and three N levels, low N(0.10 g/kg soil), middle N(0.15 g/kg soil) and high N(0.2 g/kg soil). Compared to the CIR treatments, the TIR treatments increase soil MBC by 13%-240%, and decrease soil MBN by 6.5%-47.3%. At the high N level, the TIR treatment increases the number of soil nitrification bacteria at three growth stages slightly, and increases the number of soil denitrification bacteria by 0.7 to 3 times at the milky stage and decreases the number of soil denitrification bacteria by 12.1% to 61.2% at the jointing and booting stages. At the low and middle N levels, the TIR treatments reduce the activity of soil nitrate reductase by 63.8% and 43.3% at the booting stage. Under the same irrigation method, compared to the low N level, the middle N level increases soil MBC and MBN, the numbers of nitrification bacteria and denitrification bacteria, and the activities of catalase, urease and invertase, while the high N level reduces soil MBN and the activities of catalase, urease and nitrate reductase. Thus TIR can effectively improve microbial biomass carbon and the activities of catalase, urease and invertase under the middle N level.
Keywords: Irrigation method; microbial biomass carbon and nitrogen; soil enzyme activity; nitrification bacteria; paddy soil


土壤酶直接参与土壤中各种生物化学过程,其活性可以间接地反映氮、 磷等养分的转化与供给状况[9]。过氧化氢酶活性在一定程度上可以表征土壤生物氧化过程的强弱[10],脲酶活性可以反映土壤有机氮向有效氮的转化能力和土壤无机氮供应能力[11],转化酶活性可以用来表征土壤的熟化程度和肥力水平[10],与土壤中腐殖质、 水溶性有机质和粘粒含量以及微生物数量呈正相关。反硝化细菌是产生含氮气体化合物的微生物,是导致厌氧土壤氮素损失的主要作用者。在硝酸还原酶和亚硝酸还原酶及羟氨还原酶的作用下,土壤中硝态氮还原为氨,因此,它们的活性可以反映土壤氮素转化作用的强弱[12]。不同灌溉方式和土壤水分含量影响土壤微生物数量和酶活性,如刘宇锋等[13]发现,控制灌溉和间歇灌溉土壤酶活性和微生物数量一般高于常规灌溉。余江敏等[14]认为,根区局部灌溉在其湿润区能提高土壤微生物数量和酶活性。朱同彬等[15]研究发现,不同施肥处理土壤中不同种酶活性变化情况不一样,当土壤田间持水量高于70%时会显著抑制土壤脲酶、 过氧化氢酶和碱性磷酸酶活性。周礼恺[10]研究表明,土壤干旱时土壤酶活性下降,重新湿润时又能稍许提高酶活性。但是关于“薄、 浅、 湿、 晒”灌溉方式对土壤微生物量碳、 氮和酶活性影响的研究较少,本文在不同氮肥水平下,研究“薄、 浅、 湿、 晒”灌溉对水稻拔节期、 孕穗期和乳熟期土壤中微生物量碳、 氮,硝化细菌和反硝化细菌数量以及土壤酶活性的影响,以探讨该灌溉模式下水稻土微生物活性的变化规律,为改善农田土壤生态环境和生产实践提供依据。
1 材料与方法
1.1 试验材料
盆栽试验在广西大学农学院网室大棚中进行。供试土壤为采自本校农业教学基地的第四纪红色粘土发育的水稻土,经风干、 碾碎,过10 mm筛,称取15 kg于盆中(上部直径35 cm、 下部直径26 cm、 高29 cm)。供试土壤pH为6.07、 碱解氮87.6 mg/kg(1 mol/L NaOH碱解扩散法)、 速效磷40.3 mg/kg (0.5 mol/L NaHCO3浸提法)、 速效钾72.9 mg/kg(1 mol/L 中性NH4Ac浸提法)。供试水稻品种为中浙优8号(浙审稻2006002)。
1.2 试验设计

水稻于2012年3月11日播种,水稻催芽露白后培育至3叶期,选取长势较一致的幼苗进行移栽,4月9日移栽至盆内,每盆种植2株,水稻秧苗移栽前提前3天泡水,且使盆内土壤均保持浅水层(约25 mm),两种灌水方式从4月20日水稻返青后进行,灌水控制在各自设定的范围内,用量筒量取灌水量,并记录各处理灌水量,试验期间其他管理措施一致。2012年8月10日全部收获,全生育期143 d。
1.3 样品采集和测定方法
试验分3次采样,即6月1日(拔节期)、 7月5日(孕穗期)、 8月1日(乳熟期),每次采样时间为灌水处理后第2 d上午,分别采集不同处理0—16 cm土层土壤并混匀,其中一部分土壤鲜样用于测定硝化细菌和反硝化细菌,另一部分土样风干后过1 mm筛,用于测定土壤酶活性。
太子丹与秦王之关系,其实既复杂也可玩味。《史记》记载:“燕太子丹者,故尝质于赵,而秦王政生于赵,其少时与丹欢。及政立为秦王,而丹质于秦。秦王之遇燕太子丹不善,故丹怨而亡归。”[2]两人同处异国,身为孤独的质子,结为玩伴,而时过境迁,则一为“质于秦”的太子,一为国君。境遇不一,命运则殊异,致使太子丹沦为秦王施虐的对象。从“少时与丹欢”至“遇之无礼”,史书留下了大量空白,难以测度。
微生物量碳、 氮用氯仿熏蒸—0.5 mol/L硫酸钾浸提[16],浸提液用浓硫酸重铬酸钾氧化、 硫酸亚铁滴定法测定微生物量碳,结果以单位质量干土中土壤微生物量碳(MBC)表示。计算公式为MBC=Ec/0.38, 式中, Ec为熏蒸土样和未熏蒸土样有机碳量之差; 0.38为转换系数。
微生物量氮用比色法测定: 浸提液在280 nm
下用紫外分光光度计测定吸光度[16-17],用单位土壤中的吸光度增量表示,微生物量氮(MBN)=(abs熏/G熏)-(abs未/G未),其中, abs代表紫外光下的吸光度;G代表烘干土质量。
硝化细菌和反硝化细菌采用MPN法计数[12]测定。
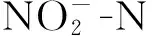
1.4 数据处理
试验数据用SPSS17.0分析软件进行统计分析,多重比较用Duncan法,差异显著性水平为P<0.05。
2 结果与分析
2.1灌溉方式和氮肥水平对水稻土微生物量碳、氮的影响
从表1可以看出,与常规灌溉(CIR)相比,除乳熟期在F1时“薄、 浅、 湿、 晒”灌溉(TIR)土壤微生物量碳(MBC)降低34.7%外,其他情况下TIR处理的土壤MBC均明显增加。相同灌水方式下,3个时期土壤MBC一般随着氮肥用量的增加而增加。

表1 灌溉方式和氮肥水平对土壤微生物量碳、 氮的影响(mg/kg)
注(Note): CIR—常规灌溉 Conventional irrigation; TIR—“薄、 浅、 湿、 晒”灌溉 “Thin-shallow-wet-dry” irrigation; F1—低氮 Low N; F2—中氮 Middle N; F3—高氮 High N. 同列数据后不同字母表示处理间差异达5%显著水平 Values followed by different letters in a column are significant among treatments at the 5% level.
与CIR相比,拔节期在F2时TIR处理土壤MBN降低31.9%,孕穗期在F3时TIR土壤MBN降低20.0%,而乳熟期在F1和F3时TIR土壤MBN分别降低47.3%和40.0%。拔节期CIR处理,F2土壤MBN比F1增加1.2倍,而TIR处理F2土壤MBN比F1增加57.7%;孕穗期相同灌溉方式时,F3和F2处理土壤MBN与F1差异不明显。乳熟期CIR和TIR处理土壤MBN F2比F1分别增加14.7%和109.6%,而F3土壤MBN分别比F1降低32.3%和22.5%。
2.2灌溉方式和氮肥水平对水稻土硝化细菌和反硝化细菌数量的影响
表2表明,与CIR相比,拔节期和孕穗期在F3时TIR处理土壤硝化细菌数量分别增加1.8倍和1.5倍;而在F2时TIR处理土壤硝化细菌数量分别降低57.6%和41.6%,F1时孕穗期降低69.2%。乳熟期在F1和F2处理分别增加121.8%和85.5%。CIR条件下,拔节期和孕穗期F2处理土壤硝化细菌数量比F1分别增加3倍和55.3%。TIR条件下,孕穗期F2和F3土壤硝化细菌数量比F1分别增加2倍和4倍;而乳熟期F3土壤硝化细菌数量比F1降低55.3%,其他处理土壤硝化细菌数量变化不明显。
与CIR处理相比,拔节期和孕穗期3种氮肥水平下TIR土壤反硝化细菌数量均降低,其中孕穗期F1、 F2和F3土壤反硝化细菌数量分别降低45.1%、 23.5%和33.9%,而拔节期降低不明显;乳熟期F1、 F2和F3土壤反硝化细菌数量分别增加1.9倍、 0.8倍和2.9倍。CIR条件下,3个时期的F2处理土壤反硝化细菌比F1分别增加94.7%、 91.8%和105.9%。TIR条件下,拔节期和孕穗期的F2土壤反硝化细菌比F1增加3.4倍和1.5倍。

表2 灌溉方式和氮肥水平对土壤硝化细菌和反硝化细菌数量的影响
注(Note): CIR—常规灌溉 Conventional irrigation; TIR—“薄、 浅、 湿、 晒”灌溉 “Thin-shallow-wet-dry” irrigation; F1—低氮 Low N; F2—中氮 Middle N; F3—高氮 High N. 同列数据后不同字母表示处理间差异达5%显著水平 Values followed by different letters in a column are significant among treatments at the 5% level.
2.3 灌溉方式和氮肥水平对水稻土酶活性的影响
从表3可以看出,与CIR相比,F3时TIR处理拔节期土壤硝酸还原酶活性增加1倍;F1和F2时TIR处理孕穗期土壤硝酸还原酶活性分别降低63.8%和43.3%。CIR时,拔节期和乳熟期F2处理土壤硝酸还原酶活性比F1分别增加1.5倍和1.2倍,而孕穗期F3土壤硝酸还原酶活性比F1降低44.1%,总体上3个时期土壤硝酸还原酶活性随着氮肥用量的增加表现出先增后减的趋势,其中孕穗期F2处理土壤硝酸还原酶活性最高。TIR时,拔节期和乳熟期F3处理土壤硝酸还原酶活性比F1分别增加90%和2.0倍,3个时期土壤硝酸还原酶活性随着氮肥用量的增加而增加,最大值出现在F3时拔节期。
表3还显示,3个时期TIR处理土壤亚硝酸还原酶活性与CIR相比变化不明显(表3)。CIR时,土壤亚硝酸还原酶活性随着氮肥用量的增加变化不明显。TIR时,3个时期土壤亚硝酸还原酶活性随着氮肥用量的增加而增加,其中拔节期和孕穗期F3土壤亚硝酸还原酶活性比F1分别增加34.4%和122.7%。
注(Note): CIR—常规灌溉 Conventional irrigation; TIR—“薄、 浅、 湿、 晒”灌溉 “Thin-shallow-wet-dry” irrigation; F1—低氮 Low N; F2—中氮 Middle N; F3—高氮 High N. 同列数据后不同字母表示处理间差异达5%显著水平 Values followed by different letters in a column are significant among treatments at the 5% level.
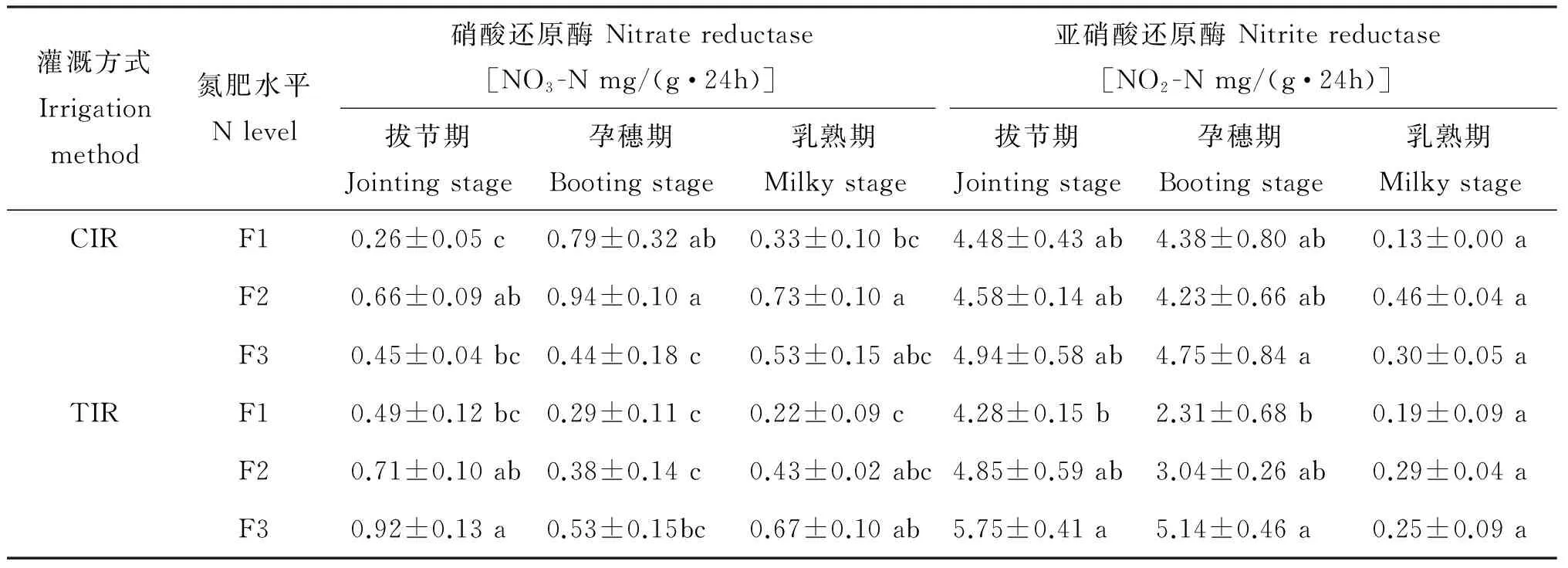
过氧化氢酶在F1时,孕穗期和乳熟期TIR比CIR处理土壤过氧化氢酶活性分别提高12.5%和15.4%(表4);其他条件下TIR处理土壤过氧化氢酶活性变化不显著。CIR时,与F1相比,F2处理乳熟期土壤过氧化氢酶活性提高10.3%,而拔节期和孕穗期过氧化氢酶活性提高不显著;F3处理拔节期、 孕穗期和乳熟期土壤过氧化氢酶活性均有所提高。TIR时,与F1相比,F2和F3处理拔节期过氧化氢酶活性分别增加17.1%和4.9%,孕穗期均下降11.1%,乳熟期F3下降8.9%。
表4还显示,与CIR处理相比,在F1时,3个时期TIR土壤转化酶活性变化不明显;F2时,拔节期TIR土壤转化酶活性提高20.1%;F3时,拔节期和乳熟期TIR土壤转化酶活性分别提高49.6%和10.1%。CIR时,与F1相比,F2拔节期、 孕穗期和乳熟期土壤转化酶活性分别提高13.3%、 15.1%和2.0%,F3分别提高16.9%、 18.2%和15.5%。TIR时,与F1相比,F2拔节期土壤转化酶活性提高29.8%,F3拔节期和乳熟期分别提高61.8%和23.0%。
与CIR处理相比,TIR土壤脲酶活性拔节期和孕穗期有所提高,而乳熟期有所下降(表4)。CIR时,与F1相比,F2和F3在3个采样时期土壤脲酶活性均有所提高;TIR时,与F1相比,F2在3个采样时期土壤脲酶活性也有所提高,F3拔节期和孕穗期有所降低,而乳熟期有所上升。
3 讨论与结论


土壤酶主要来自微生物细胞和动植物残体,土壤酶活性与土壤健康及土壤养分转化等有很大的关系。在一定含水量范围内,土壤酶活性随土壤含水量增加而增加,合理的施肥制度也会提高土壤酶活性,但高量的尿素或者铵态氮肥对土壤脲酶有抑制作用[25]。本研究结果表明,不同灌水方式和氮肥水平会影响土壤酶活性,但对不同土壤酶活性的影响不同。硝酸还原酶和亚硝酸还原酶是反硝化过程的2种主要主导酶,其中由亚硝酸还原酶诱导,将亚硝酸还原成一氧化氮的反应是将硝酸还原成气体第一步。CIR处理的高氮水平有利于降低土壤中的硝酸还原酶活性。与CIR相比,TIR处理土壤孕穗期F1和F2时TIR土壤硝酸还原酶活性分别降低63.8%和43.3%。在CIR和TIR处理下,增加氮肥用量一般会提高土壤中硝酸还原酶和亚硝酸还原酶活性。土壤中过氧化氢酶、 转化酶和脲酶活性的最大值均出现在TIR方式,可见TIR在一定程度上有利于提高土壤中过氧化氢酶、 转化酶和脲酶活性。相同灌水方式下,土壤转化酶活性随氮肥用量的增加而增加,最大值均出现在F3处理的拔节期;过氧化氢酶和脲酶活性随着氮肥用量的增加一般先增后减,最大值均出现在F2处理的孕穗期,这可能是因为施用氮肥有助于土壤微生物的代谢。
[1] 徐红, 张学龄. 水稻节水灌溉技术的应用与推广[J]. 内蒙古水利, 2003, (3): 38-40. Xu H, Zhang X L. Application and extension of rice water-saving irrigation technology[J]. Inner Mongolia Water Cons., 2003, (3): 38-40.
[2 ] 苏永春, 勾影波, 王立新. 农田土壤动物和微生物与生物化学动态关系的研究[J]. 生态学杂志, 2004, 23(3): 134-137. Su Y C, Gou Y B, Wang L X. Relationship between soil fauna and microorganisms and the development of biochemistry characters in farmlands[J]. Chin. J. Ecol., 2004, 23(3): 134-137.
[3] 胡曰利, 胡晓芙. 土壤微生物生物量作为土壤质量生物指标的研究[J]. 中南林学院学报, 2002, 22(3): 112-115. Hu Y L, Hu X F. Discussion on soil microbial biomass as a bio-indicator of soil quality for latosol earth[J]. J. Cent. South For. Univ., 2002, 22(3): 112-115.
[4] 张海燕, 肖延华, 张旭东. 土壤微生物量作为土壤肥力指标的探讨[J]. 土壤通报, 2006, 37(3): 422-425. Zhang H Y, Xiao Y H, Zhang X D. Microbial biomass as an indicator for evaluation of soil fertility properties[J]. Chin. J. Soil Sci., 2006, 37(3): 422-425.
[5] Nsabimana D, Haynes R J, Wallis F M. Size activity and catabolic diversity of the soil microbial biomass as affected by land use[J]. App. Soil Ecol., 2004, 26(2): 81-92.
[6] 张奇春, 王光火, 方斌. 不同施肥处理对水稻养分吸收和稻田土壤微生物生态特性的影响[J]. 土壤学报, 2005, 42(1): 116-121. Zhang Q C, Wang G H, Fang B. Influence of fertilization treatment on nutrients uptake by rice and soil ecological characteristics of soil microorganism in paddy field[J]. Acta Pedol. Sin., 2005, 42(1): 116-121.
[7] 张奇春, 王雪芹, 时亚南, 王光火. 不同施肥处理对长期不施肥区稻田土壤微生物生态特性的影响[J]. 植物营养与肥料学报, 2010, 16(1): 118-123. Zhang Q C, Wang X Q, Shi Y N, Wang G H. Effects of different fertilizer treatments on ecological characteristics of microorganism in chemical fertilizer omission paddy soil[J]. Plant Nutr. Fert. Sci., 2010, 16(1): 118-123.
[8] 陈安磊, 王凯荣, 谢小立. 施肥制度与养分循环对稻田土壤微生物生物量碳氮磷的影响[J]. 农业环境科学学报, 2005, 24(6): 1094-1099. Chen A L, Wang K R, Xie X L. Effects of fertilization systems and nutrient recycling on microbial biomass C, N and P in a reddish paddy soil[J]. J. Agro-Environ. Sci., 2005, 24(6): 1094-1099.
[9] 孙瑞莲, 赵秉强, 朱鲁生, 等. 长期定位施肥对土壤酶活性的影响及其调控土壤肥力的作用[J]. 植物营养与肥料学报, 2003, 9(4): 406-410. Sun R L, Zhang B Q, Zhu L Setal. Effects of long-term fertilization on soil enzyme activities and its role in adjusting and controlling soil fertility[J]. Plant Nutr. Fert. Sci., 2003, 9(4): 406-410.
[10] 周礼恺. 土壤酶活性[J]. 土壤学进展, 1980, 8(4): 9-15. Zhou L K. Soil enzyme activity[J]. Prog. Soil Sci., 1980, 8(4): 9-15.
[11] 张为政,祝廷成. 作物茬口对土壤酶活性和微生物的影响[J]. 土壤肥料, 1993, (5): 12-14. Zhang W Z, Zhu T C. Effect of crop rotation on soil enzyme activities and microorganisms[J]. Soil Fert., 1993, (5): 12-14.
[12] 李振高, 骆永明, 滕应. 土壤与环境微生物研究法[M]. 北京: 科学出版社, 2008. 397-413. Li Z G, Luo Y M, Teng Y. Research methods for soil and environmental microbiology[J]. Beijing: Science Press, 2008. 397-413.
[13] 刘宇锋, 邓少虹, 梁燕菲, 李伏生. 灌溉方式与有机无机氮配施对水稻土壤微生物活性的影响[J]. 华中农业大学学报, 2012, 4(31): 428-435. Liu Y F, Deng S H, Liang Y F, Li F S. Effects of irrigation method and combined application of organic and inorganic N on microorganism activity of paddy soil[J]. J. Huazhong Agric. Univ., 2012, 4(31): 428-435.
[14] 余江敏, 李伏生, 农梦玲. 根区局部灌溉和有机无机氮比例对种植玉米土壤酶活性的影响[J]. 植物营养与肥料学报, 2010, 16(2): 334-340. Yu J M, Li F S, Nong M L. Effect of partial root-zone irrigation and ratio of organic and inorganic N on the enzyme activity in maize-planting soil[J]. Plant Nutr. Fert. Sci., 2010, 16(2): 334-340.
[15] 朱同彬, 诸葛玉平, 刘少军, 娄燕宏. 不同水肥条件对土壤酶活性的影响[J]. 山东农业科学, 2008, (3): 74-78. Zhu T B, Zhuge Y P, Liu S J, Lou Y H. Effects of different fertilizer treatments and water regimes on soil enzyme activities[J]. Shandong Agric. Sci., 2008, (3): 74-78.
[16] 林启美, 吴玉光, 刘焕龙. 熏蒸法测定土壤微生物量碳的改进[J]. 生态学杂志, 1999, 18(2): 63-68. Lin Q M, Wu Y G, Liu H L. Modification of fumigation extraction method for measuring soil microbial biomass carbon[J]. Chin. J. Ecol., 1999, 18(2): 63-68.
[17] 黄熬梅, 安韶山, 曲东, 李盟军. 两种测定土壤微生物量氮方法的比较初探[J]. 植物营养与肥料学报, 2005, 11(6): 830-835. Huang A M, An S S, Qu D, Li M J. Comparison between two methods of determination soil microbial biomass nitrogen[J]. Plant Nutr. Fert. Sci., 2005, 11(6): 830-835.
[18] 关松荫, 张德生, 张志明. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986. Guan S Y, Zhang D S, Zhang Z M. Soil enzyme and its research methods[M]. Beijing: Agriculture Press, 1986.
[19] Turner B L, Bristow A W, Haygarth P M. Rapid estimation of microbial biomass in grassland soil by ultraviolet absorbance[J]. Soil Biol. Biochem., 2001, 33(5): 913-919.
[20] Vig K, Megharaj M, Sethunathan N, Naidu R. Bioavailability and toxicity of cadmium to microorganisms and their activities in soil: a review[J]. Adv. Environ. Res., 2003, 8(1): 121-135.
[21] 王继红, 刘景双, 于君宝, 王金达. 氮磷肥对黑土玉米农田生态系统土壤微生物量碳、 氮的影响[J]. 水土保持学报, 2004, 18(l): 35-38. Wang J H, Liu J S, Yu J B, Wang J D. Effect of fertilizing N and P on soil microbial biomass carbon and nitrogen of black soil corn agro-ecosystem[J]. J. Soil Water Cons., 2004, 18(l): 35-38.
[22] Shen S M, Hart P B S, Powlson D S, Jenkinson D S. The nitrogen cycle in the Broadbalk wheat experiment:15N-labelled fertilizer residues in soil and in the soil microbial biomass[J]. Soil Biol. Biochem., 1989, 21(4): 529-533.
[23] 仇少君, 彭佩钦, 刘强, 荣湘民. 土壤微生物生物量氮及其在氮素循环中作用[J]. 生态学杂志, 2006, 25(4): 443-448. Chou S J, Peng P Q, Liu Q, Rong X M. Soil microbial biomass nitrogen and its role in nitrogen cycling[J]. Chin. J. Ecol., 2006, 25(4): 443-448.
[24] 殷永娴, 李玉祥, 彭春华, 江曙. 水稻根际硝化作用的生态与生物反硝化[J]. 土壤, 1996, 28(3): 123-127. Yin Y X, Li Y X, Peng C H, Jiang S. Ecology of nitrification in rice rhizosphere and biological denitrification[J]. Soils, 1996, 28(3): 123-127.
[25] 李成芳, 曹凑贵, 徐拥华, 等. 稻鸭与稻鱼生态系统土壤微生物量氮和土壤酶活性动态[J]. 生态学报, 2008, 28(8): 3905-3912. Li C F, Cao C G, Xu Y Hetal. Dynamics of soil microbial biomass N and soil enzymes activities in rice-duck and rice-fish ecosystems[J]. Acta Ecol. Sin., 2008, 28(8): 3905-3912.
Soilmicrobialbiomasscarbonandnitrogenandenzymeactivitiesinpaddy
soilunder“thin-shallow-wet-dry”irrigationmethod
LIANG Yan-fei, ZHANG Xiao-xiao, LI Fu-sheng*
(CollegeofAgriculture,GuangxiUniversity,Nanning530005,China)
2013-06-24接受日期2013-08-06
国家“863”计划(2011AA100504);国家科技支撑计划项目课题(2012BAD05B03);中国科学院战略性先导科技专项子课题(XDA05070403)资助。
梁燕菲(1986—), 女, 广西南宁人, 硕士研究生,主要从事水土资源利用与环境研究。E-mail: 534760079@qq.com * 通信作者 Tel: 0771-3235314-806, E-mail: zhenz@gxu.edu.cn; lpfu6@163.com
S154;S511.071
A
1008-505X(2013)06-1403-08
