1-苯基吲哚的合成
2013-10-11冯筱晴王瑞瑞王羚竹宋国强
冯筱晴,唐 龙,王瑞瑞,王羚竹,宋国强
(1常州大学制药与生命科学学院,江苏 常州 213164;2常州市药品制造与质量控制工程重点实验室,江苏 常州 213164)
吲哚类化合物是杂环化合物中的一个重要分支,因其具有各种各样的生理活性,所以被广泛用作为医药、农药、香料、染料和其它精细化工产品的中间体[1]。1-苯基吲哚不仅是制备其它吲哚类衍生物的重要原料,还是合成医药中间体亚氨基芪的重要原料[2-5](亚氨基芪是合成抗癫痫药卡马西平、奥卡西平及抗抑郁药丙咪嗪的重要中间体[6])。
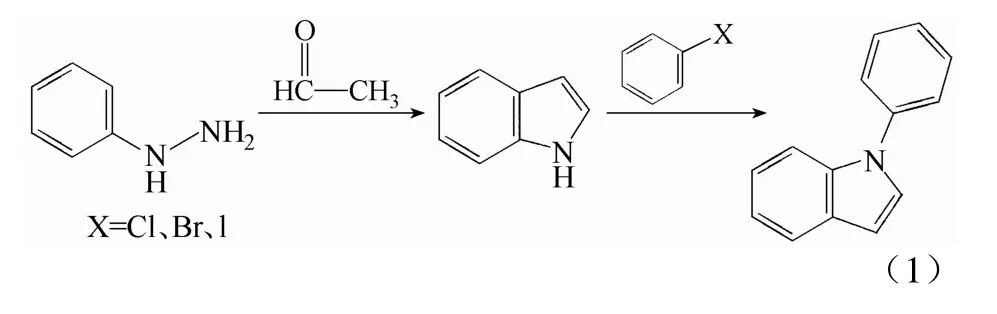
1-苯基吲哚及类似物的合成已有多篇文献及专利报道[7-23],其中比较经典的就是Fischer吲哚合成法,其基本原理是以脂肪族醛、酮类及苯肼衍生物为原料,缩合成相应的苯腙衍生物,再在酸催化作用下经重排及脱氮环化等过程,最后形成吲哚及其衍生物[7-10]。吲哚与卤代苯在无机碱或有机碱为缚酸剂,铜及铜类化合物为催化剂,DMSO、DMF等作溶剂体系中反应3~24 h制得1-苯基吲哚[11-18,20](反应式 1)。此合成路线有如下不足:①Fischer吲哚合成有两个缺点,分别为产率低和区域选择性低,其中产率低是长期存在的问题,严重制约着此方法的使用范围;②合成吲哚用的醛是乙醛,酸是丙酮酸,乙醛极易挥发,蒸气与空气可形成爆炸性混合物,丙酮酸价格昂贵,不易获得,原料苯肼也不稳定,易被氧化;③取代反应中缚酸剂如碳酸铯等,催化剂如碘化亚铜等价格昂贵,不易获得;④得到纯的1-苯基吲哚都需要柱层析,复杂繁琐,不符合工业化大生产条件[6-9]。本研究以二苯胺和乙二酰氯为起始原料,经偶联、酰化、还原反应三步得到1-苯基吲哚,通过对反应温度、催化剂用量、投料比等影响因素的考察,改进工艺以较高收率和纯度得到1-苯基吲哚。本合成路线采用的原料和试剂价廉易得,反应后处理简单,无需柱层析,具有较好的工业化前景,经实验优化后,产品结构经1HNMR、MS和显微熔点仪分析表征确认。
1 实验部分
1.1 仪器和试剂
Bruker DRX400 型核磁共振仪(瑞士 Bruker公司),LC-MS液质色谱仪(日本岛津),SGW X-4B型显微熔点仪(上海仪电物理光学仪器有限公司),液相色谱仪LC-10ATVP(日本岛津)。
二苯胺、乙二酰氯、无水三氯化铝等均为工业级试剂,无水乙醇、盐酸、硼氢化钠、氯化锌、氢氧化钠、苯、二氯乙烷、无水乙醇、环己烷、四氢呋喃、N,N-二甲基乙酰胺、二氯甲烷、甲苯、乙酸乙酯、石油醚、氯化钙、氯化锌、无水硫酸钠等均为分析级试剂,含量均≥98%。
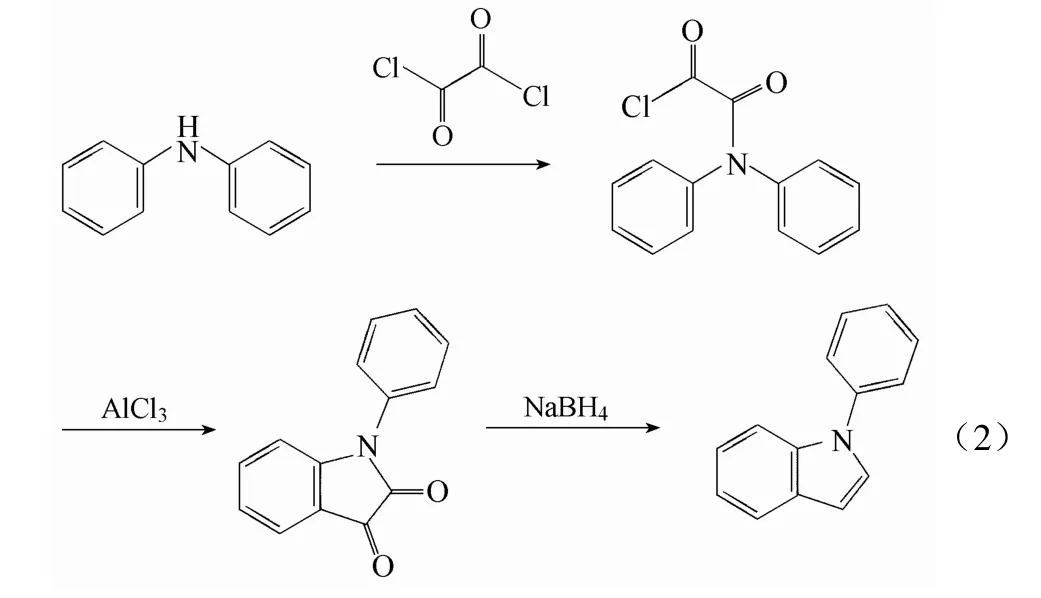
1.2 合成原理
由二苯胺合成 1-苯基吲哚路线如反应式(2)所示。
1.3 实验过程
1.3.1N,N-二苯基-2-氯-2-氧代乙酰胺的制备
在250 mL四口烧瓶中加入乙二酰氯17 g(0.4 mol),冰盐浴保护,搅拌,缓慢加入二苯胺22.56 g(0.13 mol)。加毕,保持温度20~25 ℃,反应2.5 h后减压旋蒸除去过量的乙二酰氯得到N,N-二苯基-2-氯-2-氧代乙酰胺粗品,用无水乙醇重结晶得到白色固体29.49 g,HPLC纯度97.68%,收率98.02%。检测数据如下。熔点:140.3~142.8℃;ESI-MS(m/z):260 [M+1]+。1H NMR(400MHz,DMSO,TMS,δ):7.51~7.63(m,6H,Ar-H),7.82~7.92(m,4m,Ar-H)。
1.3.2 1-苯基靛红的制备
氩气保护,在250 mL四口烧瓶中依次加入N,N-二苯基-2-氯-2-氧代乙酰胺20 g(0.077 mol),甲苯110 mL,保持温度10 ℃,搅拌,分批加入无水三氯化铝30.80 g(0.23 mol)。加毕,常温反应2 h后缓慢倒入34 mL 2 mol/L的冰盐酸中,析出固体,抽滤,用水洗涤固体3次,干燥,得到1-苯基靛红粗品。最后,用无水乙醇重结晶得到类白色固体14.94 g,HPLC纯度98.45%,收率86.76%。检测数据如下。熔点 121.5~123.2 ℃。ESI-MS(m/z)224[M+1]+。1H NMR(400MHz,DMSO,TMS,δ):6.89~6.92(m,1H,Ar-H),7.15~7.21(m,1H,Ar-H),7.41~7.60(m,6H,Ar-H),7.68~7.72(m,1H,Ar-H)。
1.3.3 1-苯基吲哚的制备
氩气保护,在250 mL四口烧瓶中加入甲苯200 mL,升高温度至90 ℃,蒸出甲苯的前馏分。完毕,冷却至室温,加入1-苯基靛红7.56 g(0.04 mol),氯化锌0.27 g(0.002 mol)冰盐浴保护,保持温度0 ℃,搅拌,分批加入硼氢化钠4.55 g(0.12 mol)。加毕,保持温度110 ℃,继续反应12 h后缓慢加入15 mL水,15 mL 10%氢氧化钠溶液,再加入45 mL水,过滤,滤液用无水硫酸镁干燥,过滤,滤液减压旋蒸得到黄色黏稠液体 5.59 g,HPLC纯度98.14%,收率72.41%。检测数据如下。ESI-MS(m/z)194[M+1]+。1H NMR(300MHz,DMSO,TMS,δ):6.70~6.72(d,1H,J=6.0Hz),7.11~7.15(m,1m),7.18~7.22(m,1H),7.39~7.42(m,1H),7.55~7.59(m,5H),7.65~7.67(m,2H)。
1.4 产物分析色谱条件
液相色谱:Shim-pack CLC-ODS 6.0 mm×150 mm,1.0 mL/min流速,柱温25 ℃,流动相90%甲醇/水,检测波长254 nm。
2 结果与讨论
2.1 N,N-二苯基-2-氯-2-氧代乙酰胺的合成分析
(1)反应原料摩尔比对反应的影响 理论上二苯胺与乙二酰氯发生反应的摩尔比为1∶1,但是由于乙二酰氯不稳定等因素,所以乙二酰氯的加入量一般是过量的。但是,乙二酰氯的加入量并不是越多越好,因此,为了准确考察不同原料摩尔比对反应的影响,反应中选定温度20~25 ℃,反应2.5 h,考察不同原料摩尔比对反应收率的影响,结果见表1。由表 1可看出,当n(二苯胺)∶n(乙二酰氯)在一定范围(1∶1~1∶3)变化时,产品的收率也随之增加,但是当摩尔比再增加时,产品收率增加缓慢,所以从节约原料与对环境友好的角度考虑,最佳投料比为:n(二苯胺)∶n(乙二酰氯)=1∶3。
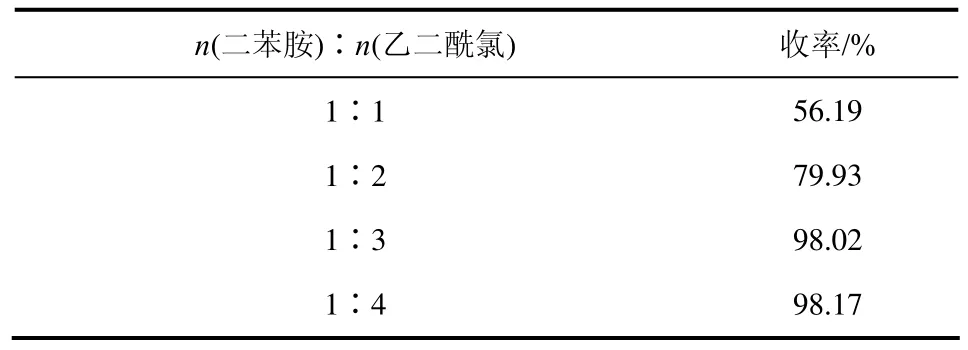
表1 反应原料摩尔比对反应的影响
(2)反应时间对反应的影响 探索不同的反应时间对反应产物收率的影响,实验结果见表2。

表2 反应时间对反应的影响
由表2可以看出,随着反应时间的增加,反应产物收率也增加,在反应2.5 h时较高。,而当反应时间达到3 h,产品收率却降低,因此选择反应时间2.5 h。
2.2 1-苯基靛红的合成方法分析
(1)反应溶剂对反应的影响 酰化反应中溶剂的选择十分重要,最好是自身的酰氯就是反应溶剂,但是综合考虑成本、环保及安全等因素,选择了甲苯、二氯甲烷和N,N-二甲基乙酰胺等作为溶剂考察反应情况。在n(N,N-二苯基-2-氯-2-氧代乙酰胺)∶n(无水AlCl3)=1∶3,反应温度为10 ℃,反应时间为2 h,探索反应溶剂种类对反应的影响,实验结果见表 3。

表3 溶剂种类对反应的影响
由表3可看出,采用二氯乙烷作溶剂,反应收率最高。但因二氯乙烷是国家明确规定应避免使用,且能对人体和环境造成较大伤害的溶剂,所以综合来看,选择甲苯为最佳反应溶剂。
(2)催化剂用量对反应的影响 路易斯酸的催化作用主要是离子聚合的引发作用,路易斯酸按由强到弱的顺序有BF3、AlCl3、TiBr4、SnCl4、ZnCl2等。从反应类型、经济和安全角度综合考虑选用AlCl3为催化剂。催化剂的用量十分重要,增加催化剂用量可提高反应速率或收率,但增加程度与用量之间不是线性关系[24]。因此,为了较好的优化工艺,提高反应速率或收率,在二氯乙烷为反应溶剂,其它条件不变的情况下,考察AlCl3与N,N-二苯基-2-氯-2-氧代乙酰胺的不同摩尔比对 1-苯基靛红收率的影响,实验结果见表 4。

表4 催化剂用量对反应的影响
由表4看出,随着催化剂用量增加,产物的收率也增加,但是当n(N,N-二苯基-2-氯-2-氧代乙酰胺)∶n(AlCl3)=1∶4时,收率增加的较少,所以从催化剂的经济性来看,应选择n(N,N-二苯基-2-氯-2-氧代乙酰胺)∶n(AlCl3)=1∶3为最佳反应条件。
2.3 1-苯基吲哚的合成方法分析
(1)还原剂对反应的影响 络合金属氢化物是一类选择性较高的羰基还原剂,常见的还原剂有硼氢化钠、氢化铝锂和异丙醇铝等。其中氢化铝锂是最强的络合金属氢化物还原剂,硼氢化钠和异丙醇铝相对较弱,但是,当有催化剂参与反应时,有时也能达到很强的还原效果。实验结果见表5。

表5 还原剂对反应的影响
由表 5可以看出,氢化铝锂的还原效果最好,收率最高,硼氢化钠还原只有痕量产品,异丙醇铝不反应。实验中还分别考察了3种还原剂在加入催化剂氯化锌、氯化铝、氯化钙时的反应情况,结果是硼氢化钠在加入氯化锌时反应效果最好,1-苯基吲哚的收率可达到70%以上,而氢化铝锂和异丙醇铝在加与不加3种催化剂时结果变化不大。综合分析来看,反应较好的有氢化铝锂和硼氢化钠氯化锌体系,虽然氢化铝锂收率最高,但是由于氢化铝锂的价格比硼氢化钠的价格贵的多,所以选择硼氢化钠为最佳的还原剂。
(2)还原剂用量对反应的影响 选用甲苯作溶剂,n(1-苯基靛红)∶n(氯化锌)=1∶0.05,反应温度110 ℃,反应时间12 h,考察不同还原剂的加入量对反应的影响。实验结果见表 6。

表6 硼氢化钠加入量对反应的影响
由表 6可以看出,当n(1-苯基靛红)∶n(硼氢化钠)在1∶1到1∶5之间变化时,产品的收率呈现增大的规律,但当n(1-苯基靛红) ∶n(硼氢化钠)大于1∶3时,收率增加不大,所以从节能减排等角度考虑,选择n(1-苯基靛红)∶n(硼氢化钠)=1∶3为最佳反应条件。
(3)反应溶剂对反应的影响 硼氢化钠还原常用醇类或醚类溶剂,有甲醇、乙醇、四氢呋喃等。为了准确考察溶剂种类对反应收率的影响,在n(1-苯基靛红)∶n(硼氢化钠)=1∶3,1-苯基靛红与氯化锌的摩尔比为1/20 mol,1-苯基靛红与溶剂的摩尔体积比为1 mol/5000 mL,反应温度为回流温度,反应时间12 h,探索不同溶剂对反应的影响,实验结果见表 7。
由表7可看出,采用乙醇和石油醚作溶剂,反应不能进行,甲苯作溶剂,产物收率相对较高。所以,选择甲苯为最佳反应溶剂。
(4)反应时间对反应的影响 探索不同的反应时间对反应产物收率的影响,实验结果见表 8。
由表 8可以看出,当反应时间增加时收率先增加后减少,当反应时间为12 h,收率最高,而当反应时间为14 h,收率反而降低,说明反应时间过长,反应中的副反应增多,即副产物增多,影响了目标产品的收率,所以,选择反应时间为12 h。

表7 溶剂种类对反应的影响
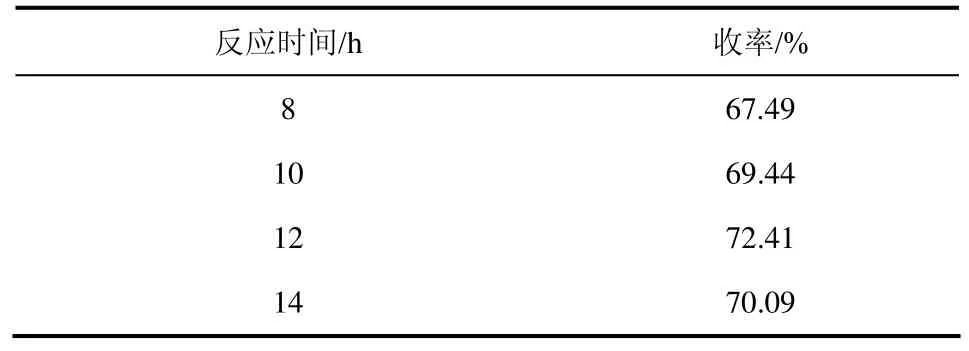
表8 反应时间对反应的影响
3 结 论
(1)以二苯胺和乙二酰氯为原料合成N,N-二苯基-2-氯-2-氧代乙酰胺,结果表明,n(二苯胺) ∶n(乙二酰氯)=1∶3,反应温度20~25 ℃,反应2.5 h,产品HPLC纯度97.68%,收率98.02%。
(2)产品1-苯基靛红的较优合成工艺条件为:以N,N-二苯基-2-氯-2-氧代乙酰胺为原料,二氯乙烷为溶剂,n(N,N-二苯基-2-氯-2-氧代乙酰胺)∶n(无水AlCl3)=1∶3,反应温度10 ℃,反应时间为2 h,产品HPLC纯度98.45%,收率为86.76%。
(3)产品1-苯基吲哚的较优合成工艺条件为:以1-苯基靛红为原料,甲苯为溶剂,n(1-苯基靛红)∶n(硼氢化钠)=1∶3,n(1-苯基靛红)∶n(氯化锌)=1∶0.05,反应温度110 ℃,反应时间为12 h,产品HPLC纯度98.14%,收率为72.41%。
[1]何光洪,党亚固.吲哚类化合物的合成研究[D].成都:四川大学,2007-05-10.
[2]Lim Y H,Duong H A,Johannes C W.Direct conversion of indoles to 3,3-difluoro-2-oxindolesviaelectrophilic fluorination[J].Organic Letters,2012,14(22):5676-5679.
[3]Duan X G,Rees C W.One-step syntheses of pyrrolo-and indolo-1,2,5-thiadiazoles and pyrrolobis[1,2,5]thiadiazoles[J].J.Chem.Soc.,Perkin Trans.1,1997(18):2695-2700.
[4]Wang M Z,Zhou C Y,Wong M K.et al.Ruthenium-catalyzed alkylation of indoles with tertiary amines by oxidation of a sp3C—H bond and lewis acid catalysis[J].Chem.Eur.J.,2010,16:5723-5735.
[5]Bhaskar G,Saikumar C,Perumal P T.Indium(Ⅲ)bromide-catalyzed hydroarylation of alkynes with indoles[J].Tetrehedron Lett.,2010,51:3141-3145.
[6]戴立言,胡卫雅.BTC参与的亚氨基芪的合成研究[D].杭州:浙江大学,2008.
[7]蒋金芝,王艳.Fischer吲哚合成法的研究进展[J].有机化学,2006,26(8):1025-1030.
[8]Dhakshinamoorthy A,Pitchumani K.Facile clay-induced fischer indole synthesis: A new approach to synthesis of 1,2,3,4-tetrahydroca-rbazole and indoles[J].Appl.Catal A:General,2005,292:305-311.
[9]Chaskar A,Deokar H,Padalkar V,et al.One-pot fischer indole[J].J.Korean Chem.Soc.,2010,54(4):411-413.
[10]Bratulescu G.A new and efficient one-pot synthesis of indoles[J].Tetrahedron Lett.,2008,49:984-986.
[11]Ahmadi S J,Sadjadi S,Hosseinpour M,et al.Granulated copper oxide nano-catalyst:A novel and efficient catalyst for C—N cross-coupling of amines with iodobenzene[J].Monatsh.Chem.,2011,142(8):801-806.
[12]徐杰,黄义争,苗虹.温和条件下无配体简单铜化合物催化的N-芳基化方法:中国,101463010[P].2009-06-24.
[13]Huang H,Yan X H,Zhu W L,et al.Efficient copper-promotedn-arylation of aryl halides with amines[J].J.Comb.Chem.,2008,10:617-619.
[14]Zhang Q,Luo J,Wei Y Y.Efficient and reusable catalytic system of CUI-PEG forn-arylation of imidazoles[J].Synth.Commun.,2012,42:114-121.
[15]Elliott E C,Bowkett E R,Maggs J L,et al.Convenient syntheses of benzo-fluorinated diben[b,f]azepines:Rearrangements of isatins,acridines,and indoles[J].Org.Lett.,2011,13(20):5592-5595.
[16]Kidwai M,Mishra N K,Bhardwaj S,et al.Cu nanoparticles in PEG:A new recyclable catalytic system forn-arylation of amines with aryl halides[J].ChemCatChem,2010,2:1312-1317.
[17]Deng W,Wang Y F,Zhang C,et al.CuI/Proline-catalyzedn-arylation of nitrogen heterocycles[J].Chin.Chem.Lett.,2006,17(3):313-316.
[18]Suramwar N,Thakare S R,Karade N N,et al.Green synthesis of(111)facet CuO nanoparticles:Heterogeneous and recyclable catalyst forn-arylation of indoles[J].J.Mol.Catal.A:Chem.,2012,359:28-34.
[19]Cano Rafael,Ramon D J,Yus M.Transition-metal-freeO-,S-,andn-arylation of alcohols,thiols,amides,amines,and related heteroc-ycles[J].J.Org.Chem.,2011,76:654-660.
[20]Reddy K H V,Catish G,Ramesh K,et al.An efficient synthesis ofn-substituted indoles from indoline/indoline carboxy acidviaaromatization followed by C—N cross-coupling reaction by using nano copper oxide as a recyclable catalyst[J].Tetrahedron Lett.,2012,53:3061-3065.
[21]Beller M,Breindl C,Riermeier T H,et al.Synthesis of 2,3-dihydroindoles,indoles,and anilines by transition metal-free amination of aryl chlorides[J].J.Org.Chem.,2001,66:1403-1412.
[22]Nishio T,Oka M.Synthesis of indole derivatives by[2+2]photocycloaddition of indoline-2-thiones with alkenes and photodesulfurization of indoline-2-thiones[J].Helv.Chim.Acta,1997,80(2):388-397.
[23]Nishida T,Tokuda Y,Tsuchiya M.Synthesis of 1-substituted indoles by the vapour phase reaction ofn-substituted anilines with glycols and epoxides over a solid catalyst and a vapour phase dealkylation of 1-alkylindoles[J].J.Chem.Soc.,Perkin Trans.2,1995(4):823-830.
[24]赵德明,张谭,竺三奇,等.4,6-二乙氧基间苯二胺的合成[J].化工进展,2012,31(3):649-653.
