用于燃烧前二氧化碳捕集的固体吸附剂研究进展
2013-10-09王文举
王文举,邢 兵,王 杰
(南京理工大学能源与动力工程学院,江苏 南京, 210094)
化石燃料的燃烧引起了CO2排放量的大幅增加,大气中的CO2浓度从工业革命前的270 μg/g增加到现今的390μg/g[1]。CO2作为温室气体的一种,其在大气环境中浓度的增加,在一定程度上造成了全球气候异常和极端自然灾害的发生。因此,CO2的捕集、利用和封存已成为化石能源高效清洁利用的热点,目前的研究主要着眼于高效低成本的CO2捕集技术。CO2捕集技术主要包括燃烧前捕集、富氧燃烧、燃烧后捕集三种不同的系统方案。其中,燃烧前CO2捕集技术具有以下技术特点:压力2~7MPa,温度250~450℃,CO2浓度高达15%~60%(干基)[2],富集的CO2压力0.3~4.2MPa[2],CO2的高压和高浓度可以显著减少捕集装置的尺寸和投资,并为CO2捕集后续的运输和埋存提供了便利条件。
燃烧前CO2捕集主要有吸附法、吸收法、膜分离法和低温分离法等[2]。其中,吸附分离法利用固体吸附剂对混合气中CO2的选择性可逆吸附来分离CO2,具有操作条件温和、可再生能力强、吸附速率快等优点[3]。吸附过程为在低温(或高压)下吸附CO2,CO2的解吸依靠升温(或降压)进行,通过降温/升温或升压/降压循环连续操作,实现CO2的分离。目前,吸附法捕集CO2工艺过程日趋成熟,而高效低成本吸附剂的开发是决定该技术应用的关键因素之一,因此研究具有高吸附性能的固体吸附剂具有重要意义。
可用于燃烧前CO2捕集的固体吸附剂按吸附温度范围分为两类:低温吸附剂、中高温吸附剂。它们之间的界限是相对的、没有严格限定,因为即使是同一种类的吸附剂,在改性后它的吸脱附温度会有较大波动。低温吸附剂包括活性炭、沸石分子筛、硅胶、硅藻土和固态胺等,吸附温度都在200℃以下[4];中高温吸附剂包括水滑石、CaO、硅酸锂等,其吸脱附温度则在400℃以上[4]。
1 低温固体吸附剂
1.1 活性炭
活性炭是一种常见的吸附材料,它具有很高的比表面积和丰富的微孔结构[5],是典型的物理吸附,如图1。
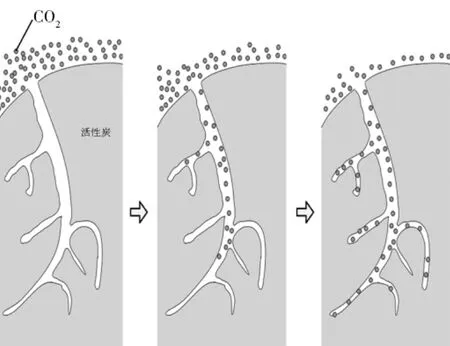
图1 活性炭表面吸附CO2原理示意
活性炭的表面特性及其孔隙结构是影响其CO2吸附能力的重要因素,而由于改性活性炭表面上的官能团稳定性较差,官能团数量随吸/脱附循环的进行而下降,从而使吸附效率逐渐下降。官能团虽然可以增强吸附能力,但却使脱附性能下降。因此,从吸/脱附工作循环的综合效果角度,研究活性炭孔隙结构对CO2吸附的影响具有重要意义[6]。一般来说,比表面积和孔容较大的活性炭具有较大的CO2吸附容量;同一种活性炭,吸附量与压力成正比,与温度成反比;活性炭的吸附热比较低,所以吸附的气体分子比较容易解吸附,因此再生能耗相对较低。
张双全等[5]以无烟煤为原料、NH4NO3和K2CO3混合物为添加剂制备了变压吸附分离CO2用活性炭,采用该法制备出的活性炭已经成功应用于变压吸附法提纯氢气的工业装置,氢气的纯度达到99.999%。Lee等[7]将K2CO3浸渍到活性炭表面进行改性,通过调控K2CO3和H2O的比例使其维持一定的相对湿度,使改性后的活性炭在50~70℃发挥出了很好的性能。陈建宇等[8]研究认为碳酸钾浸渍后尽管会堵塞活性炭的一部分微孔,但是K+的加入可能使材料中形成更多的活性位点,有利于CO2的吸附。Aroua等[9]用棕榈壳活性炭作为前驱体,研究了用不同浓度聚乙烯亚胺(PEI)修饰的活性炭吸附性能,各种气体的最大吸附容量排序为:CO2>CH4>O2>N2。何平等[10]对活性炭进行了改性,发现氧化、胺化后的改性活性炭对CO2的吸收能力有所增强。Drage等[11]发现在3MPa下活性炭对CO2的吸附质量分数高达58%(13mmol/g),而在43MPa下活性炭对H2的吸附质量分数只有0.3%,选择性良好。
活性炭吸附以物理吸附为主,它的内表面积优于其他吸附剂,具有很强的吸附能力。为了提高活性炭的吸附分离能力,建议对其改性,对于不同的气体组分,可以选择不同的活性炭前驱体,并采取措施控制活性炭的孔径、孔容等孔结构指标。活性炭对水分的吸附优先于CO2,因此应用于燃烧前CO2捕集时,应尽量脱除水分,以减轻水分对CO2吸附性能的不利影响。这就增加了燃烧前CO2捕集的能耗和成本。
1.2 硅 胶
硅胶是SiO2粒子的三维凝聚多孔体的总称,是无定形结构的硅酸干凝胶,具有较大比表面和多孔结构,是一种高活性吸附剂,属非晶态物质,其化学分子式为mSiO2·nH2O[12]。硅胶作为CO2吸附剂的特点是吸附性能高、热稳定性好、化学性质稳定、有较高的机械强度等。
张辉等[13]采用廉价的工业硅胶,通过三塔八步工业试验,对燃煤烟道气中低浓度CO2进行了吸附捕集。研究表明,采用工业硅胶可以在保证产品气流量的情况下,将产品气浓度提高至74%以上,有利于进一步降低CO2减排成本。梅华等[14]发现,大的比表面、孔径分布趋向细孔化有利于硅胶对CO2的吸附,而适当的孔分布则有利于减小扩散阻力的结论。任德刚[15]认为应当选用细孔硅胶作为CO2吸附剂。有机胺能够提高硅胶的CO2吸附性能,不同有机胺的最佳涂渍浓度不同,对CO2的吸附量和吸附选择性随温度的升高而下降。因此,硅胶不适宜在较高温度下作为CO2吸附剂使用。Song等[16]通过在硅胶的表面引入醋酸钙盐或者经过在含有酒精的溶液中使用硅胶凝胶法合成后,硅胶表面经过改性其碱性位得到改善,CO2很容易在硅胶表面的氧化钙上得到化学吸收,表明在一定量的CO2进行了化学吸收以后吸附-解吸过程就形成了可逆的循环,从而改善了CO2的吸附。
总之,硅胶的吸附也以物理吸附为主,需要采取一定的措施提高其孔径、孔容,增强对CO2的吸附。此外,通过化学方法,采用浸渍等方法在硅胶表面引入碱性基团以增强对CO2的吸收的方法,在增强吸附率的同时也提高了脱附的难度。另外硅胶对CO2的吸附量和吸附选择性对温度非常敏感。因此,硅胶不适宜在较高温度下作为CO2吸附剂使用。这也要求在硅胶的改性过程中需要有选择性的引入碱性基团。
1.3 分子筛与介孔材料
20世纪40年代,Barrer等成功合成出有序低硅铝比沸石分子筛,为分子筛的应用奠定了基础[17]。分子筛与多孔材料一般作为吸附材料、催化材料与粒子交换材料广泛应用于各工业生产过程。沸石分子筛是极性吸附剂,对极性强和不饱和的分子、易极化的极化率大的非极性分子都有更强的吸附能力。虽然CO2分子的偶极矩为零,但其碳氧键的极性和氧原子孤对电子的存在,使得CO2与沸石分子筛阳离子有强烈作用,所以同为物理吸附的沸石分子筛吸附量高于活性炭[18]。
卞子君等[19]将 MCM-41作为载体,在材料表面进行胺基修饰,提高了MCM-41材料的CO2吸附性能。汤德平等[20]发现弱碱介质(NH3,EDA)有利于提高MCM-41的热稳定性,而采用混合碱介质(三乙醇胺/NaOH)则可在一定程度上改善MCM-41的水热稳定性,但随着三乙醇胺量的增加,材料的孔径会相应的减小。Xu等[21]发现掺入聚乙烯亚胺(PEI)后的介孔材料MCM-41仍保持了原先的结构,PEI均匀地散布在了分子筛的间隙中,在75℃MCM-41-PEI-50对CO2的吸附量高达215mg/g,是 MCM-41介孔材料的24倍,甚至是纯PEI的2倍。CO2的吸附量随着CO2/N2混合气中CO2的浓度增加而增加。赵会玲等[22]将氨丙基三乙氧基硅烷(APTS)和氨乙基氨丙基甲基二甲氧基硅烷(AEAPMDS)分别接枝在 MCM-41和SBA-15的孔道内,表面氨基修饰量约为1.5~2.9mmol/g,表面修饰前后CO2的吸附量从0.67mmol/g提高到2.20mmol/g,其介孔材料的孔道仍高度有序,但比表面积减小。王林芳等[23]以3-丙胺基三乙氧基硅烷(APTES)为硅烷化试剂,分别采用后修饰法和一步嫁接法将其嫁接到SBA-15的孔内,形成了功能化的介孔分子筛用于CO2吸附,有利于较低分压下CO2的吸附脱除。
分子筛和介孔材料与活性炭和硅胶一样,也属于多孔类吸附剂,因此也具有多孔类吸附剂的共性特点,均是以物理吸附为主,孔径分布和比表面积对其吸附性能有巨大的影响,通过改性引入碱性基团可以增加其吸收效果,如图2所示。分子筛和介孔材料也具有强烈的吸湿性,所以在CO2捕集时,应尽量脱除水分,以减轻水分对CO2吸附性能的不利影响。
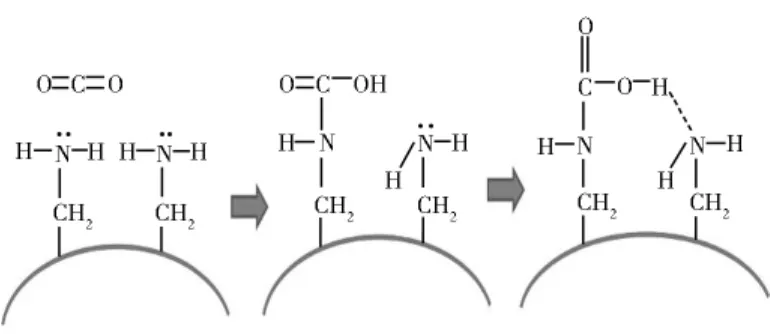
图2 表面修饰后的介孔材料化学吸附CO2的原理示意
1.4 树脂
固态胺是聚苯乙烯经氯甲基化后再接技二乙撑三胺或三乙烯四胺而成的含有胺或胺的活性基团的树脂,是具有大量微孔和较大的比表面积的高分子聚合物。按基本结构分类,可分为非极性、中极性、极性和强极性四种类型。具有适应性大、应用范围广、吸附选择性好、稳定性高等优点。在180℃空气中放置数天基本无氧化分解反应发生,在100℃饱和水蒸气中连续蒸煮70d其性能无变化,不产生氧化分解、不产生二次污染。
树脂经氯甲基化后再接技二乙撑三胺或三乙烯四胺而成的含有胺或胺的活性基团的胺修饰树脂具有弱碱性的胺基,对CO2、H2S、HCl、SO2等酸性气体有吸收作用,该吸收反应是可逆的化学反应,吸收是放热反应,温度升高时则发生脱吸反应,常压下反应平衡温度为57℃。胺修饰树脂吸收CO2的一般反应温度应控制在20~30℃。在常温常压下胺修饰树脂含水量为25%~30%时吸收CO2能力最强。脱吸是吸热反应,吸收了CO2的胺修饰树脂被加热后将会把CO2释放出来。常压下床层温度达60℃以上时胺修饰树脂将开始脱吸,当温度达85℃以上时脱吸速率加快,温度越高脱吸越快越彻底,但温度太高将给装置结构和工艺带来难度,通常控制床层温度达90~100℃为宜[24]。
周旭等[25]采用丙烯酸酯类为单体,二乙烯苯为交联剂,悬浮聚合制备大孔交联共聚物基质,胺解制备了一种吸收二氧化碳活性高,寿命长的新型胺修饰树脂——聚丙烯酰多乙烯多胺型树脂;此外,他们还制备了新型的CO2固体吸附剂——丙烯酸系弱碱性阴离子树脂[26]。陈兆文等[27]认为固态胺损失的原因主要有氧化、分解损失、中毒损失和物理机械损失。Goeppert等[28]制备了胺修饰的白炭黑,用于捕集空气中的CO2,发现它可有效吸附低浓度的CO2。Hoshino等[29]报道了一种新型温度响应的胺修饰凝胶颗粒,可显著降低CO2收集的能耗。
胺修饰树脂在干态和湿态下均可反应吸收CO2,但在水蒸气的参与下其解吸反应需要的能量更少,CO2的脱吸更容易发生。同时由于胺修饰树脂的吸水溶胀作用,在湿态下孔道变大有利于CO2的内扩散,便于其吸收CO2。但是当胺修饰树脂的水含量超过一定值时会在孔道内形成水膜反而影响CO2的内扩散。因此在实际应用过程中要合理控制胺修饰树脂的含水率。
2 中高温固体吸附剂
2.1 水滑石
水滑石类混合物(HTlcs)是由水滑石、类水滑石和插层水滑石构成的一大类带阴离子的碱性黏土,也叫层状双金属氢氧化物(LDHs),其通式可表示为:{[(OH)2]·(An-)x/n·mH2O]},其中 M2+=Mg2+、Ni2+、Zn2+、Cu2+、Co2+、Mn2+;M3+= Al3+、Fe3+、Co3+、Cr3+;An-=、NO-3、Cl-、OH-;x 通常为0.17~0.33[30]。不同的水滑石化合物的热稳定性不同,但基本相似。以MgAl-LDHs为例,在空气氛围中加热温度低于220℃时仅失去层间水;当加热到250~450℃时层板羟基脱水同时伴有碳酸根离子的分解;在450~550℃时生成比较稳定的镁铝双金属氧化物(LDO),组成是Mg3AlO4(OH)。LDO在一定条件下可以恢复形成LDHs,即所谓的“记忆”功能;当加热温度超过600℃时,生成具有尖晶石结构的产物,表面积大大降低,碱性减弱,而且其结构也无法恢复[30]。冯健等[31]发现通过浸渍法将适量的碳酸钾负载于水滑石孔道及层状结构中,其吸附容量较未修饰的水滑石提高近50%。
经过化学或结构改性的类水滑石化合物适合用于作为变压吸附法中的吸附剂分离空气预热器出口烟气的CO2,但是随着吸附/解吸循环次数增加其吸附能力下降[32-33]。在实际使用过程中,由于类水滑石化合物既具有物理吸附性能又具有化学吸附性能,尽管在350~500℃高温时以化学吸附性能为主,有较高的选择吸附性能,但是仍然难以避免类水滑石化合物对其他气体的部分吸附,造成脱附过程产生的CO2浓度下降,影响CO2压缩和封存,增加后续处理过程的难度。这些均是类水滑石化合物在工业应用中需要改进之处。
2.2 钙基吸附剂
CO2是酸性气体,容易吸附在略带碱性的CaO表面,而且反应生成的碳酸盐在煅烧温度下又能够重新分解成CO2和CaO,实现固体吸附剂的循环利用[34-35],如图3。CaO的优点是具有良好的CO2吸收能力,对CO2的吸附速率及吸附量很高,原料来源广泛、成本低,制备工艺简单,被视为CO2高温吸收剂的首选材料,一直受到关注[36]。但是CaO颗粒与CO2反应时,颗粒外层的CaO转化为CaCO3,其摩尔体积(36.9cm3/mol)大于CaO摩尔体积(16.9cm3/mol),因而易引起产物层微孔的堵塞,CO2难以扩散到颗粒内部与CaO进一步反应,导致CaO转化率下降。反应完全的吸收剂在800~900℃煅烧,CaCO3分解为CO2和CaO,实现吸收剂的再生,从而可以循环使用。但是在800~900℃煅烧温度下CaO颗粒容易烧结,引起表面积和孔隙率减少,导致吸收剂的转化率下降,影响其CO2吸收能力[37]。

图3 CO2和CaO反应机理示意
普通CaO(或石灰石)吸收转化率随循环次数的增加会急剧降低,即使采用含有部分氧化镁的白云石作为吸收剂,其活性也有较大幅度的降低,但多次循环后,吸收剂活性会维持在较低的水平不再发生变化。对于钙基吸附剂的缺点,主要的研究方向是:钙基吸收剂动力学特性、钙基吸收剂循环碳酸化转化率的变化规律和对钙基吸收剂的改性以及基于钙基链式循环的双流化床反应器的设计与实现3个方面[38]。在对钙基吸收剂的改性方面主要包括结构改性、掺杂改性、包硅改性和稀土改性等方向。蔡宁生等[38]指出应研究气固反应临界产物层的形成与生长规律,研制高循环反应活性、稳定性和机械强度且价廉及环境友好的吸收剂,开展钙基吸收剂CCCR法综合特性、与燃煤电厂系统组合与优化方案及其技术经济分析。李英杰等[39]研究发现,在相同的吸附剂流率下,用醋酸溶液改良的石灰石在平均碳化转换率、CO2捕集效率和能耗上比天然的吸附剂更占优势。在相同的CO2捕集效率下,使用改良石灰石的焙烧炉能耗比使用天然吸附剂的要更低。虽然电厂煤炭的含硫量很小,但硫化作用能造成焙烧炉能耗的增加,所以很有必要从烟气中过滤掉SO2以减少能耗。李振山等[40]利用Al(NO3)3·9H2O 和 CaO 粉末,形成 CaO/Ca12Al14O33。该吸收剂具有较高的孔隙率、表面积和抗烧结能力。Yi等[41]将具有氧空位的添加剂添加到高温CO2吸附剂中能够提高其循环稳定性,随着Ce/Zr比率的增加钙基吸附剂循环稳定性也随之提高,CaO/Ce0.8Zr0.2O2(质量比为3∶1)具有最佳的循环稳定性;另外,经Mg掺杂改性后的铝酸镧比起只添加铝酸镧具有更好的循环稳定性。这也说明了如果添加剂能够提供更多的氧空位就能获得更好的循环稳定性。由此可见,具有氧空位的材料易于CO2的扩散。黄绍兰等[42]采用共沉淀法以CaAc2·H2O作为CaO前驱体,制备了锆改性钙基高温二氧化碳吸收剂。改性后,吸收剂中掺杂ZrO2形成了良好的介孔结构,可维持较高的碳酸化转化率,提高吸收剂的循环热稳定性。且吸收剂在多次循环吸收反应后仍保持较高的碳酸化转化率,不产生团聚现象,呈现良好的分散性。
目前对钙基吸附剂的研究,依然是寻求一种循环稳定性能较好的吸附剂,主要途径还是使CaO中形成耐烧结的骨架结构以支撑CaO,避免CaO循环使用过程中的烧结作用,维持CaO始终具有较高的孔隙率和比表面积。在制备研究中,如果能参考类水滑石的制备方法制备出具有阴离子柱形式的钙基吸附剂,提高孔隙率和比表面积,并引入能起到加强支撑的骨架结构,则可以同时解决钙基吸附剂的改性和抗烧结问题,促进钙基吸附剂的进一步应用。但是在提高循环稳定的同时也要兼顾吸附剂的单次吸附容量。如果单次吸附容量过低,实际应用中进行吸附/解吸切换过于频繁,则不能满足高浓度烟气分离的需要[43]。
2.3 锂基吸附剂
锂基吸附剂具体包括铁酸锂、镍酸锂、钛酸锂、锆酸锂、锗酸锂和硅酸锂,其中,锆酸锂(Li2ZrO3)和硅酸锂(Li4SiO4)的CO2吸脱附性良好,远高于氧化铝和水滑石等吸附剂,受到研究者们得关注重视。锂盐和CO2发生反应如下:
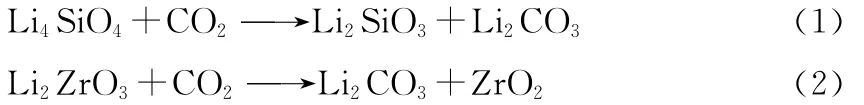
Kato等[44]采用碳酸锂和二氧化硅加入10%的K2CO3制备而成硅酸锂,其吸附量达到6.36 mmol/g,理论最大吸附量为8.33mmol/g。Fauth等[45]研究了Li2ZrO3在掺入不同盐改性后吸附性能的变化,发现500℃时K2CO3/MgCO3改性的Li2ZrO3吸附速率大于用K2CO3/Li2CO3改性的吸附剂,并且将KF/Li2CO3引入Li2ZrO3时可获得最快的吸附速率,在500℃下KF/Li2CO3-Li2ZrO3的吸附速率是纯Li2ZrO3的32.5倍,其原因是共熔的碳酸盐层有利于气相CO2的迁移;在 600 ℃ 时三相K2CO3/NaF/Na2CO3-Li2ZrO3可以获得最快的吸附速率;700℃时可以获得最大的CO2吸附量。王银杰等[46-48]研究发现:用固相合成法合成的硅酸锂具有很快的吸附速率和较高吸附量,CO2分压越大,吸收速度越快、吸收量越大;不同结构ZrO2制备的和不同方法制备的锆酸锂试样吸收性能明显不同;还发现掺杂Na、K等金属元素后,硅酸锂的吸附性能有明显的提高,吸附速率提高了大约30倍,吸附量也有所增加。主要原因是锂元素与掺杂的金属元素竞争,使吸附材料结构出现缺陷有助于提高吸附活性,从而提高了吸附速率和吸附量。另有研究表明[49],通过液相法可以制取得到Li6Zr2O7和Li8ZrO6,如图4,而且Li含量越高,其CO2吸附能力越强。
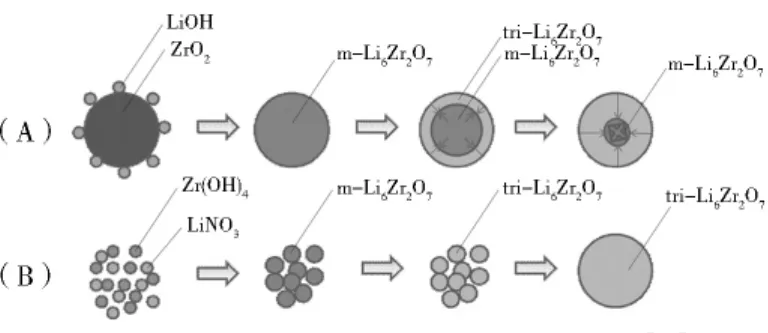
图4 液相法制备单斜相Li6Zr2O7示意[43]
锆酸锂吸附CO2生成的Li2CO3会在锂盐的外表面形成壳层阻碍CO2向Li6Zr2O7的扩散,见图5。Li2CO3的熔点约为710℃,因此这两种锂盐的吸附速率随温度的升高超过710℃均有较大的提高。不过由于氧化锂在较低的温度下即可挥发,因此在制备Li6Zr2O7和Li8ZrO6的过程中均需要加入过量的锂元素,造成了锂的浪费。同时在CO2的吸附和脱附过程中也会因为挥发造成锂元素的流失而使锂基吸附剂的循环吸附性能下降。此外,相对于其他吸附剂,锂盐的价格较高。这些因素均制约了锂基吸附剂在工业上的大规模应用。
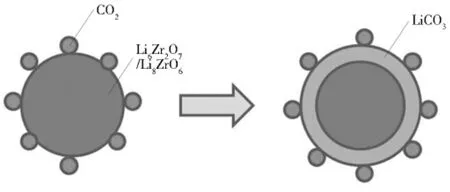
图5 反应生成的Li2CO3壳层阻碍吸收CO2示意
3 结束语
在今后相当长的一段时间内,化石燃料仍将是全球能源的主要组成部分,CO2作为造成温室效应的主要气体,主要产生于化石燃料的燃烧过程,控制CO2的排放关系到人类社会可持续发展的问题,目前主要依靠CO2的分离与捕集技术。吸附法利用固体吸附剂分离CO2,因具有操作方法简单、可再生能力强、吸附速率快等特点,受到了国内外学者的广泛关注。低温吸附剂由于能耗低、选择性好、吸附量高,具有很好的应用前景。提高活性炭和硅胶的表面特性和孔隙结构,增加分子筛与介孔材料的碱性吸附位,或对其嫁接功能团,能提高吸附剂的吸附速率和吸附量。对于固态胺树脂,开发新的胺类修饰剂有利于提高吸附活性。水滑石吸附剂在较高温度下具有较好的吸附能力,但随着循环次数增加其吸附能力下降,未来应努力提高持续循环能力。钙基吸附剂和锂盐吸附剂作为高温吸附剂,可通过改性、掺杂与合成,提高循环性能,同时兼顾吸附速率和吸附量。
近年来,一方面由于性能优良的新型吸附剂的出现及其品质的不断改善,为吸附技术的应用推广打下了良好的基础,另一方面随着吸附工艺的发展,使吸附工艺已经成为连续操作的大型工业化过程。但是合成吸附剂的成本高,制备方法复杂,阻碍了吸附法捕集CO2的大规模应用。开发新型高效廉价、合成方法简单的吸附剂,必将对吸附法捕集CO2的发展和工业应用起到巨大的推动作用。
[1]Solomon S,Qin D,Manning M,et al.Climate change 2007:the physical science basis,the fourth assessment report of the intergovernmental panel on climate change[M].New York:Cambridge University Press,2007.
[2]绿色煤电有限公司.挑战全球气候变化-二氧化碳捕集与封存[M].北京:中国水利水电出版社,2008.
[3]胡林.基于多孔介质的CO2吸脱附特性的实验研究[D].重庆大学,2009.
[4]李莉,袁文辉,韦朝海.二氧化碳的高温吸附剂及其吸附过程[J].化工进展,2006,25(8):918-922.
[5]解强,张香兰,李兰廷.活性炭孔结构调节:理论、方法与实践[J].新型碳材料,2005(2):93-96.
[6]张双全,马蓉,朱文魁,等.用于吸附分离CO2的活性炭研究[J].中国矿业大学学报,2004,33(6):683-686.
[7]Lee S C,Chae H J,Choi B Y,et al.The effect of relative humidity on CO2capture capacity of potassium-based sorbents[J].Korean Journal of Chemical Engineering,2011,28(2):480-486.
[8]陈建宇,刘资文,李平,等.改性蜂窝状活性炭吸附二氧化碳和氮气的热力学[J].化工学报,2012,63(10):3017-3026.
[9]Aroua M K,Wan D M A,Yin C Y.Adsorption capacities of carbon dioxide,oxygen,nitrogen and methane on carbon molecular basket derived from polyethylene mine impregnation on micmporens palm shell activated carbon[J].Separation and Purification Technology,2008,62(3):609-618.
[10]何平,张忠良,金君素.胺接枝活性炭的制备及其对CO2的吸附性能[J].北京化工大学学报,2010,37(3):5-11.
[11]Drage T C,Kozynchenko O,Pevida C,et al.Developing activated carbon adsorbents for pre-combustion CO2Capture[J].Energy Procedia,2009(1):599-605.
[12]Ralph Kiler.The Chemistry of Silica[M].New York:Wiley Interscience,1989.
[13]张辉,刘应书,刘文海,等.烟气中低浓度二氧化碳吸附捕集中试试验研究[J].低温与特气,2009,27(1):9-13.
[14]梅华,陈道远,姚虎卿.硅胶的二氧化碳吸附性能及其与微孔结构的关系[J].天然气化工,2004(5):23-26.
[15]任德刚.多孔CO2吸附剂研究进展[J].电力科技与环保,2010,26(5):23-27.
[16]Song H K,Cho K W,Lee K H.Adsorption of carbon dioxide on the chemically modified silica adsorbents[J].Journal of Non-Crystalline Solids,1998,242:69-80.
[17]Davis M E.Ordered porous Materials for emerging applications[J].Nature,2002,417:813-821.
[18]Burchell T D,Judkins R R,Rogersm I L,et a1.A novel process and material for the separation of carbon dioxide and hydrogen sulfide gas mixtures[J].Carbon,1997,35(9):1279-1294.
[19]卞子君,唐圣杰,夏岩,等.CO2吸附剂的研究[J].大连理工大学学报,2011,51(S1):15-18.
[20]汤德平,汪尚兵,李湘祁,等.不同碱介质对合成硅基MCM-41的影响[J].硅酸盐通报,2004,6:48-51.
[21]Xu X C,Song C S,John M,et al.Novel Polyethylenimine-Modified Mesoporous Molecular Sieve of MCM-41 Type as High-Capacity Adsorbent for CO2Capture[J].Energy &Fuels 2002,16,1463-1469.
[22]赵会玲,胡军,汪建军,等.介孔材料氨基表面修饰及其对CO2的吸附性能[J].物理化学学报,2007,23(6):801-806.
[23]王林芳,马磊,王爱琴,等.氨基硅烷修饰的SBA-15用于CO2的吸附[J].催化学报,2007(9):59-64.
[24]赵燕山.固态胺清除二氧化碳技术研究[J].舰船科学技术,2001(3):23-28.
[25]周旭,龚峻松,郭强.新型固态胺二氧化碳吸收剂的制备及性能[J].舰船科学技术,2008,30(6):218-222.
[26]周旭,龚峻松,郭强.固态胺吸附解吸CO2的性能研究[J].舰船科学技术,2008,30(6):279-283.
[27]陈兆文,徐文国,管迎梅,等.潜艇舱室固态胺CO2清除技术的基础理论分析[J].舰船科学技术,2006,28(4):86-90.
[28]Goeppert A,Czaun M,May R B,et al.Carbon dioxide capture from the air using apolyamine based regenerable solid absorbent[J].Journal of the American Chemical Society,2011,133:20164-20167.
[29]Hoshino Y,Imamura K,Yue M,et al.Reversible absorption of CO2triggered by phase transition of amine-containing micro-and nanogel particles[J].Journal of the A-merican Chemical Society,2012,134:1817718180.
[30]杜以波,Evans D G,孙鹏,等.阴离子型层柱材料研究进展[J].化学通报,2000,5:20-28.
[31]冯健,郭瓦力,刘思乐,等.碳酸钾修饰水滑石吸附二氧化碳工艺条件研究[J].离子交换与吸附,2012,28(1):70-77.
[32]Yong Z,Mata V,Rodrigues A E,et a1.Adsorption of carbon dioxide onto hydrotalcite like compounds(HTlcs)at high temperatures[J].Industrial & Engineering Chemistry Research,2001,40:204-209.
[33]Hutson N D.Structural effects on the high temperature adsorption of CO2on a synthetic hydrotalcite[J].Chemical Materials,2004,16:4135-4143.
[34]邬剑明,于丽雅,晏泓.高温CO2化学吸收剂的最新研究进展[J].碳酸盐通报,2012,31(1):99-105.
[35]Yong Z,Mata V,Rodrigues A E.Adsorption of carbon dioxide at high temperature:a review[J].Separation and Purification Technology,2002,26:195-205.
[36]Blamey J,Anthony E J,Wang J,et al.The calcium looping cycle for large-scale CO2capture[J].Progress in Energy and Combustion Science,2010,36:260-279.
[37]黄煜煜,李振山,蔡宁生.高温CO2吸附/吸收剂的研究进展[J].热能动力工程,2005,20(6):557-561.
[38]蔡宁生,房凡,李振山.钙基吸收剂循环煅烧/碳酸化法捕集CO2的研究进展[J].中国电机工程学报,2010,30(26):35-43.
[39]Li Y J,Zhao C S,Chen H C,et al.CO2capture efficiency and energy requirement analysis of power plant using modified calcium-based sorbent looping cycle[J].Energy,2011,36:1590-1598.
[40]Li Z S,Cai N S,Huang Y Y,et al.Synthesis,Experimental Studies,and Analysis of a New Calcium-Based Carbon Dioxide Absorbent[J].Energy & Fuels,2005,19:1447-1452.
[41]Yi K B,Ko C H,Park J H,et al.Improvement of the cyclic stability of high temperature CO2absorbent by the addition of oxygen vacancy possessing material[J].Catalysis Today,2009,146:241-247.
[42]黄绍兰,童华,王京刚.钙基CO2吸收剂的锆改性研究[J].环境科学与技术,2011,34(2):85-90.
[43]马聪.改性钙基CO2高温吸附剂的研究[D].西安:西北大学,2010.
[44]Kato M,Yoshikama S,Nakagawa K.Carbon dioxide absorption by lithium orthosilicate in a wide range of temperature and carbon dioxide concentrations[J].Journal of Materials Science Letters,2002,21:485-487.
[45]Fauth D J,Frommell E A,Hoffman J S,et al.Eutectic salt promoted lithium zirconate:Novel high temperature sorbent for CO2capture[J].Fuel Processing Technology,2005,86:1503-1521.
[46]王银杰,其鲁.Li2ZrO3材料吸收CO2性能的进一步研究[J].无机化学学报,2004,7(20):770-774.
[47]王银杰,其鲁,江卫军.高温下硅酸锂吸收CO2的研究[J].无机化学学报,2006,2(22):268-272.
[48]王银杰,其鲁,江卫军.K的掺杂对硅酸锂吸收CO2性能的影响[J].北京理工大学学报,2006,26(5):458-460.
[49]尹先升.锆酸锂材料的设计、合成及高温CO2吸附性能[D].上海:华东理工大学,2010.
