4-羟基-2,2,6,6-四甲基哌啶氮氧自由基合成与精制新工艺研究
2013-10-09郑亚飞杨基和林富荣
郑亚飞,杨基和,林富荣,孙 伟
(常州大学江苏省精细石油化工重点实验室,江苏 常州 213164)
4-羟基-2,2,6,6-四甲基哌啶氮氧自由基能有效的抑制烯烃单体的自由基聚合,阻止低碳烯烃混合馏分聚氧化物的生成以及管线和设备的堵塞[1]。
目前比较公认的氮氧自由基阻聚机理如下。偶合反应:
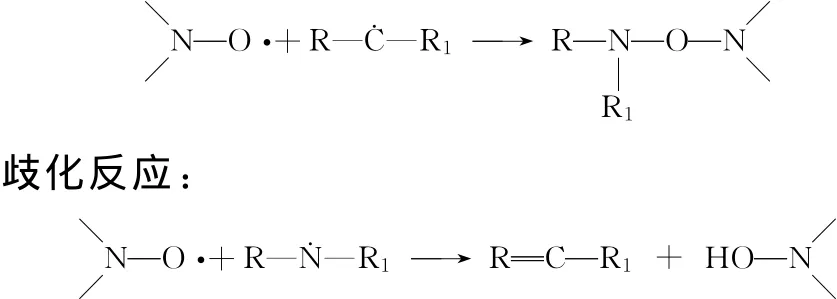
在偶合反应和歧化反应中,氮氧自由基均作为自由基捕捉体,不但不与单体产生活性链,还能有效捕捉活性链上的自由基,从而起到阻聚作用,稳定性比传统阻聚剂反应生成的自由基稳定性高。在少量的空气或氧气存在的情况下,氮氧自由基可显著增强硝酰化合物的抑制活性[2]。4-羟基-2,2,6,6-四甲基哌啶氮氧自由基,是一种稳态的高活性自由基,一旦遇到聚合或由于热和氧所产生的各种自由基R·或ROO·等时,迅速与其结合成为稳定的分子,消灭反应产生的各种自由基,彻底抑制聚合反应的正常进行。氮氧自由基由于它的孤对电子在氮氧键之间产生离域效应使其非常稳定,可以长久保存而不变质[3]。
氮氧自由基阻聚剂与传统的叔丁基邻苯二酚(TBC)相比,毒性小,对皮肤刺激作用小[4]。美国纳尔科、埃克森耐源化学品公司、德国默克公司均有生产和应用,国内应用该剂主要为进口,或者使用非自由基阻聚剂,而对于自由基型阻聚剂的研究和使用报道较少[5]。
4-羟基-2,2,6,6-四甲基哌啶氮氧自由基在实验室中以三丙酮胺为原料氧化再还原制得。有报道称,在钨酸钠-过氧化氢-甲烷体系中制得,但反应时间长[6-7];采用钨酸钠-过氧化氢-乙二胺四乙酸二钠盐体系氧化,但产率低[8]。为获得高产率的2,2,6,6-四甲基-4-羟基哌啶氮氧自由基,笔者采用氧化镁-过氧化氢体系作为氧化剂氧化2,2,6,6-四甲基哌啶醇,可获得高产率(97%以上)的4-羟基-2,2,6,6-四甲基哌啶氮氧自由基。
1 实验部分
1.1 主要原料和试剂
4-羟基-2,2,6,6-四甲基哌啶,工业级;30%双氧水,上海凌峰化学试剂有限公司;碱土金属化合物,化学纯,上海新宝精细化工厂。
1.2 实验步骤
取4-羟基-2,2,6,6-四甲基哌啶10g溶于一定量的去离子水中,加热至一定温度,保持恒温并搅拌,待原料充分溶解后,加入少量催化剂,滴加双氧水,滴加完后反应数小时,再补加双氧水继续反应;反应结束后,降温、抽滤除去固体杂质,滤液减压旋蒸去除溶剂,旋蒸后的固体经干燥得到粗产物,留待结晶精制;由于在加热减压环境中未反应的双氧水会分解,有爆炸的危险,因此,旋蒸前先加少量过渡金属氧化物使双氧水在常压条件下分解(抽滤的过程会除去过渡金属氧化物)。
粗产物中有少量未反应的原料,用结晶的方法精制。将粗产物加热、搅拌溶于其中一种溶剂,刚好溶解后,慢慢加入产物沉淀剂至出现浑浊态,再加溶剂使沉淀刚好消失,停止加热和搅拌,让溶液慢慢冷却到室温结晶,过滤出晶体,并用预冷的沉淀剂洗涤晶体,干燥即可得到符合德国默克公司指标要求的高纯产物。
合成反应式:

1.3 分析方法
熔点采用X-4数字显微熔点仪测定;红外光谱分析采用美国Nicolet460型傅里叶变换红外光谱;产率采用GC-950气相色谱仪内标法测定。
2 结果与讨论
2.1 合成条件的优化
2.1.1 氧化剂滴加速率
实验开始时,采用一次性加入氧化剂的方法。由于此反应是强放热反应,过程产生大量热,温度瞬间增加20℃左右,双氧水分解加速,产率仅为69.77%,所以氧化剂加入速率对过程的影响至关重要,过快会造成“飞温”,且氧化剂分解;过慢反应不完全。因此,实验采用氧化剂滴加的方法来控制。滴速对产率的影响如图1。
由图1可见:滴加速率过慢,反应不彻底,产率低;随着氧化剂滴速的增加,产率不断提高,但当滴加速率增大到15mL/h时,产率达到最大;再增加滴速,反应速率加快,放热量增加,加速了双氧水分解,不利于反应进行,产率不断下降;所以氧化剂滴加速率取15mL/h,产率为95.7%。

图1 氧化剂滴加速率对产率的影响反应时间7.5h,反应温度65℃,催化剂30mg,氧化剂30mL,下同。
2.1.2 反应温度
对于放热反应来说,低温有利于反应的进行,但必须超过反应活化能的温度,温度对产率的影响如图2。

图2 反应温度对产率的影响
由图2可见:反应温度对反应的影响较大,当反应温度低于55℃时,没有达到所需活化能,反应物分子不激活,产物产率较低;当反应温度在55~75℃时,产率逐渐增加,并达到最大值96.5%;当温度大于85℃时,由于双氧水分解加剧,产物产率下降,不利于反应的进行,因此,温度应选择在70~80℃为宜。
2.1.3 反应时间
考察反应时间对产率的影响,结果如图3。由图3可见:随着反应时间的增加,产物产率逐渐增加,当反应时间超过8.5h后,产率基本保持不变,增加时间,相应的产率并没有明显提高。因此,反应时间选择8.5h。
2.1.4 催化剂用量
催化剂的用量对产率的影响,结果如图4。
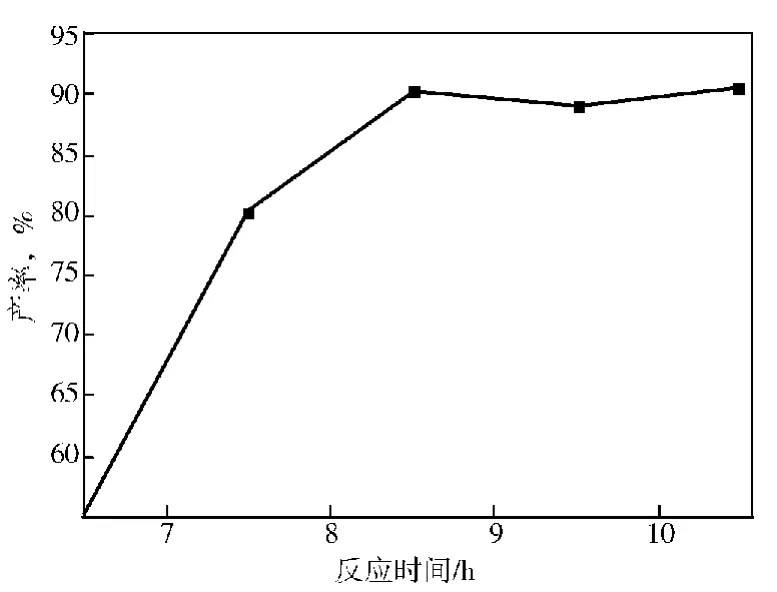
图3 反应时间对产率的影响
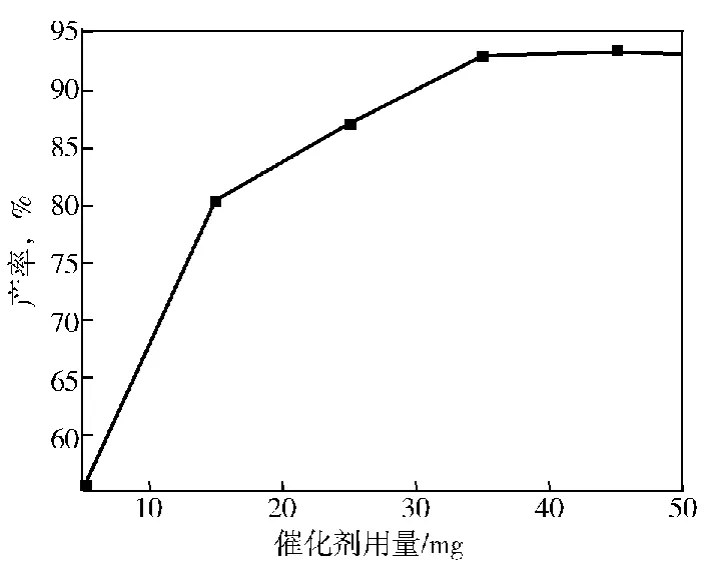
图4 催化剂用量对产率的影响
由图4可见:随着催化剂的增加,产物产率显著增加,当催化剂的用量大于35mg后,产率基本保持稳定,因此,最佳催化剂的用量35mg。
2.1.5 氧化剂用量
氧化剂用量对产率的影响见图5。
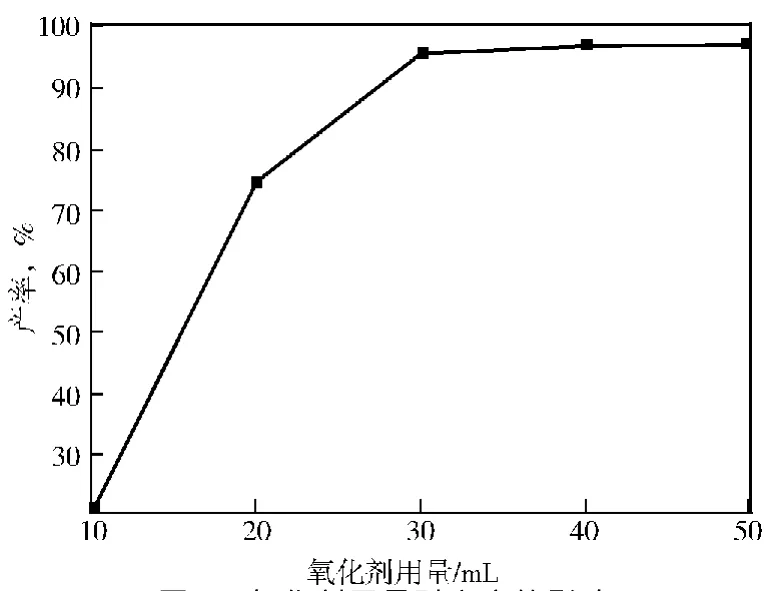
图5 氧化剂用量对产率的影响
由图5可见:氧化剂用量在10~30mL,产率迅速增加;当用量在30~40mL,产率略微增加;当用量超过40mL后,产率基本保持稳定。因此,氧化剂应控制在35mL为宜。
2.2 过程安全性控制
以上合成的粗产物需加热减压旋蒸除去水分,在此环境中未反应的双氧水会分解,有爆炸的危险。为消除安全隐患,旋蒸前先加还原剂使双氧水在常压条件下还原分解。经反复筛选,确定过渡金属氧化物为还原剂。还原剂为固体、生成的产物和合成的溶剂一样,可以在旋蒸和过滤时一起除去,既不影响目标产物的质量又不增加工序。
2.3 产物精制
精制过程分两步:1)过滤固体催化剂、旋蒸去除水分;2)结晶。结晶过程中,溶剂的选择是关键,很难选择一种适宜的单一溶剂,使产物的收率很高,因此,考虑选用混合溶剂。混合溶剂要求两种溶剂相互溶解,产物易溶于其中一种溶剂,而另一种为其沉淀剂。
通过对原料和产物在不同溶剂中溶解度的测量,正己烷对产物和原料都不溶,沸点适中,选择作为沉淀剂;易溶溶剂选择和正己烷互溶,对产物溶解度较大的二氯乙烷,通过结晶得到精产物的气相色谱见图6。

图6 精制产物气相色谱
由图6可知:成品气相结果呈现溶解成品的溶剂峰和产物峰,没有其他杂峰。
2.3 精制产物红外表征
对产物进行红外谱图分析,结果如图7所示。

图7 原料、标样和产物红外谱
图7中,σ/cm-1:3163处有—NH的吸收峰;3254为—OH强吸收峰;反应后,原料中—NH的吸收峰消失,—OH的吸收峰保留;1167和1240处明显出现N—O·的吸收峰。产物和标样红外谱图基本一致,因此所得到的产物为目标产物。
2.4 最终产物性质
实验所得产物性质和德国默克公司的产品标准对比见表1。

表1 最终产物性质和德国默克公司生产的产物标准对比
由表1比较可知:所生产的产物的主要性质指标达到要求,并且与标样在外观和红外谱图上一致。
3 结 论
a.经过工艺优化,最佳合成条件:反应温度75℃,反应时间8.5h,氧化剂滴加时间1.5h,原料和氧化剂质量比约为1∶4,催化剂用量为原料的0.35%,溶剂选择去离子水,溶剂用量为刚好溶解原料为宜;最终产率达97.3%。
b.通过对溶剂的选择,采用二氯乙烷和正己烷进行结晶,产物纯度达到99.8%。
[1]马红燕,钱仁渊,仝艳,等.阻聚剂在裂解碳五馏分分离过程中的应用进展[J].化工进展,2009,28(8):1513-1517.
[2]Winter R A E,Ahn V H.Method for inhibiting premature polymerization of vinyl aromatic monomers:US,5545782[P].1996-08-13.
[3]刘玲,赵月昌,刘彩华,等.Mg-Al水滑石催化合成立体受阻胺类氮氧自由[J].化工进展,2008,27(8):1234-1239.
[4]胡高飞,严宝珍.三种受阻胺氮氧自由基光稳定剂的合成工艺研究[J].北京化工大学学报,2003,30(6):107-109.
[5]吴星林,史铁钧,刘晖,等.苯乙烯精馏阻聚剂的研究进展[J].石油化工,2010,39(5):570-574.
[6]张自义.2,2,6,6-四甲基-4-羟基哌啶氮氧自由基的制备[J].兰州大学学报:自然科学版,1980(2):112.
[7]严宝珍.氮氧自由基光阻聚剂的研究[J].北京化工大学学报,2001,28(2):95-96.
[8]白丽丽,郭燕文,余从煊.4-羟基-2,2,6,6-四甲基哌啶氮氧自由基的制备[J].化学试剂,2002,24(6):357-358.
