电化学理论建立的概念基础探究
2013-10-09张菊芳
张菊芳
(大同大学 大同师范分校,山西 大同 037039)
一、化学概念及其特征
化学概念是有关物质组成、结构、性质、变化的本质属性及其规律在人们头脑中的科学反映,是将化学现象、化学事实经过比较、综合、分析、归纳等方法抽象出来的理性知识。化学概念是化学学科基本结构中非常重要的一部分,是化学知识网络中的骨架。它具有基础性、抽象性和阶段性的明显特征。
电化学理论也是化学学科中的一个核心概念单元,它是研究化学能与电能之间相互转化及在这种转化过程中出现的有关现象的学科。它既是中学化学学科理论的重要组成部分,也是大学物理化学中的重要内容。它从化学的角度促使学生了解电能和化学能是可以相互转化的,引导学生认识电化学现象的本质。更为重要的是,电化学理论是建立在诸多其他化学概念知识的基础之上的,其中涉及到能量转化与守恒、氧化还原反应、金属性质的比较、物理学的基本电学知识(闭合回路)、电子守恒、氧化还原反应的拆分与合并、离子方程式的书写,等等。
二、电化学理论建立的化学概念基础
1.电化学理论的能量转化基础
电化学中最基本的概念是原电池与电解池,大多数教材都是从能量转化的角度对这两个概念进行定义的。所以电化学理论涉及的第一个概念基础是能量转化与守恒定律:化学反应过程必然伴随着能量的变化,而且不同形式的能量之间是可以相互转化的,只要有能量转化,就一定服从能量守恒的规律。化学变化总是伴有能量的改变,这是化学变化的能量特征。
电化学中对原电池和电解池的概念一般是这样定义的:原电池是把化学能转变成电能的装置,电解池是把电能转变成化学能的装置。原电池是通过化学反应使闭合电路中产生电子流动,从而产生电流的。其电化学反应是不可逆的,只能将化学能转换为电能。而电解池则是在外加电流的作用下,在电解池的阴、阳两极上发生氧化还原反应,从而产生化学能。
这两大概念之间的共同点:都是通过发生氧化还原反应来实现化学能与电能之间的相互转化,只不过转化的方式正好相反。但无论是原电池将化学能转化成电能还是电解池将电能转化成化学能都是化学变化中能量转化的两种基本形式,故在这两种能量的转化过程中都遵循着能量守恒的定律。所以说电化学理论首先是建立在能量转化和守恒定律的基础之上的。
2.电化学理论的本质是氧化还原反应
氧化还原反应的本质是在反应物之间有电子的转移。但是在通常情况下,氧化还原反应不能获得电流,也不能实现能量间的相互转化。那么在原电池和电解池中能量的转化究竟是怎样实现的呢?
(1)原电池的工作原理。原电池的构成条件有四个:有活泼性不同的材料做电极;有电解质溶液;形成闭合回路;有能自发进行的氧化还原反应。原电池反应虽然是氧化还原反应,但又不同于一般的氧化还原反应。一般的氧化还原反应中,电子转移是通过氧化剂和还原剂之间直接接触实现的;而原电池中的氧化还原反应是还原剂在负极上失去电子被氧化;电子通过外电路转移到正极上,氧化剂在正极上得到电子被还原,从而实现还原剂与氧化剂之间电子的转移。在原电池中,溶液中的离子在两极之间做定向移动和外部导线中电子的定向移动构成了闭合回路,两个电极反应能够不断进行,从而产生电流实现化学能向电能的转化。这样从能量转化角度看,原电池是将化学能转化为电能的装置;而从化学反应角度看,原电池的原理是氧化还原反应中还原剂失去的电子经外接导线传递给氧化剂,使氧化还原反应分别在两个电极上进行。
(2)电解池的工作原理。电解池的构成条件也有四个:构成闭合回路;有电解质溶液;有两个电极;有直流电源。在电解池中,通电前电解质溶液中存在着自由移动的离子。通电时在电极的作用下,原先自由移动的离子改做定向运动:阴离子趋向阳极,阳离子趋向阴极。当这些离子到达电极时就失去或获得电子,发生氧化还原反应,这个过程叫做放电:即把电能转化为化学能。其中,阴离子在阳极上失电子发生氧化反应;阳离子在阴极上得电子发生还原反应。总之,无论是原电池还是电解池,它们之所以能够实现能量的相互转化,其本质原因是在这两种装置中都发生了氧化还原反应。因此,电化学理论又是建立在氧化还原反应的概念基础之上的,并进一步延伸了氧化还原反应概念的相关知识。
电化学中的氧化还原反应是一个复杂的过程,学生在学习中一般都不容易理解。但是在电化学的教材中通常会在电子转移与氧化还原反应之间为学生建立一座合适的桥梁——氧化还原半反应,这样学生在理解和掌握时就容易多了。
(3)氧化还原反应的拆分与合并。氧化还原反应是由氧化反应、还原反应两个半反应组成的,二者相加即得总反应。反过来,一个完整的氧化还原反应方程式也可以拆开写成两个半反应式,一个是氧化反应式,一个是还原反应式。在电化学中共有两类氧化还原反应,一类是可以自发进行的反应,就是原电池反应;另一类是不能自发进行的,必须通过电解来实现,就是电解池的反应。但它们的本质是一样的,都是可以拆分与合并的氧化还原反应。在原电池中,以Cu-Zn原电池(带盐桥)为例,其中锌和锌盐溶液组成锌半电池,铜和铜盐溶液组成铜半电池,中间通过盐桥连接起来。在正、负两极上发生的是氧化、还原半反应,分别为:
负极(锌):Zn-2e-=Zn2+(氧化反应)(1)式
正极 (铜):Cu2++2e-=Cu(还原反应)(2)式
将两个半反应式(1)式(2)相加可得总反应为:Zn+Cu2+=Zn2++Cu
在电解池中也是如此。在这两种电化学装置中,将这两类电化学反应进行拆分,使学生先认识半反应中的电子的得失,再进一步理解整个电化学反应的本质其实就是氧化还原反应,只不过是把一个完整的氧化还原反应拆分成两个半反应而已。任何一个氧化还原反应都可以拆分成氧化、还原两个半反应,且拆分时都遵循得失电子守恒的原理。
(4)涉及电子守恒定律。电子守恒是指在氧化还原反应中,还原剂失电子的总数与氧化剂得电子的总数相等。上述Cu-Zn原电池中,从正、负极的半反应式(1)、(2)可以看到,正、负极上得失的电子总数是相等的;同理,在所有电解池的两个半反应式中也可以看到这点。所以在电化学的反应中,因为发生的是氧化还原反应,所以遵循着电子守恒的原理,特别是在书写电极反应时,必须要遵守得失电子数目相等的规则。
3.电化学理论涉及了金属的活动性顺序
在电化学理论中,无论是研究原电池、电解池的反应机理或判断它们的电极反应,还是研究与之有关的金属腐蚀与防腐等问题,都离不开电极。通常充当电极的材料可以是金属与金属或金属与导电的非金属,在电极上会有电子的得失,而电子的得失即金属的活泼性。根据电化学反应装置中电极的材料,金属活动性的强弱在电化学反应中的具体应用表现为:
(1)根据金属的活动性强弱来判断原电池的正负极。原电池中的负极是失电子的一极,一般活动性强的金属才容易失去最外层上的电子。正极和负极之间必须有电势差,电子才能定向移动,所以正极和负极不能用同种材料,正极材料的活动性一般不如负极强。因此根据这一特点,可以判断原电池的正负极:较活泼的金属为负极,较不活泼的金属或能导电的非金属为正极。反过来,也可以利用原电池的反应原理,判断不同金属(或阳离子)的还原性(或氧化性)的相对强弱。在原电池中做负极的金属失电子,在电极上失去电子发生氧化反应,故活泼性较强;氧化性强的阳离子在正极上获得电子,发生还原反应,故正极材料不活泼。
(2)由金属的放电顺序判断电解池的电极产物和电极反应。在电解池中,与电源的正极相连的电极称为阳极。阳极吸附阴离子,阴离子在阳极上失去电子发生氧化反应。与电源的负极相连的电极称为阴极。阴极吸附阳离子,阳离子在阴极上得到电子发生还原反应。通常,根据金属的放电顺序可以判断电解时电极的产物。
第一,阳极产物的判断:当阳极的电极材料为金属(Pt或Au除外)时,通电后做电极的金属失去电子变成金属离子,进入到电解质溶液中,溶液中的阴离子就不能失电子;当阳极的电极材料是惰性物质(如Au、Pt或石墨)时,通电后溶液中的阴离子在阳极上失去电子。当溶液中同时存在多种阴离子时,还原性强的离子先失去电子发生氧化反应。常见阴离子的还原性由强到弱的顺序是:活性电极>S2->I—>Br—>Cl->OH->含氧酸根离子(如-、NO3-等)>F-。Cl-和OH-在电解时的电极反应式分别是:
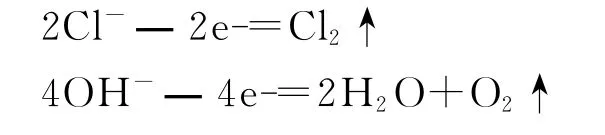
因为水电离能够产生OH-,所以电解含氧酸盐溶液时,在阳极上是OH-放电生成氧气,而含氧酸根离子不发生变化。
第二,阴极产物的判断:在阴极上发生还原反应的是溶液中的阳离子。当溶液中存在多种阳离子时,按金属活动性顺序,越不活泼的金属,其阳离子的氧化性越强,越容易被还原。阳离子放电顺序为:Ag+>Fe3+>Cu2+>H+。在水溶液中,铝之前的金属的阳离子不可能被还原。
(3)利用金属活动性的强弱不同,对金属的蚀腐进行防治。金属腐蚀的本质就是金属原子失去电子而被氧化的过程。金属腐蚀有化学腐蚀和电化学腐蚀两大类型。人们认识到金属发生电化学腐蚀的原因是在金属表面形成了原电池。而且,总是作为原电池负极(阳极)的金属被腐蚀,作为正极(阴极)的金属被保护。活泼性不同的两种金属,活泼性差别越大,腐蚀越快。如果能让被保护的金属成为正极(阴极),则该金属就不会被腐蚀。因此就有了牺牲阳极的阴极保护法和外加电流的阴极保护法两种金属的电化学防护措施。而这也正是利用了金属的活动性强弱的性质。
三、结束语
以上即为电化学理论建立的三大主要概念基础。从中可以看出:首先,电化学理论并不是一个独立的概念体系,相反,它是建立在能量转化与守恒定律、氧化还原反应原理以及金属的活动性、离子反应等一系列知识体系的基础之上,是这些知识体系的综合运用和延伸,并与它们共同结合,进一步形成了完整的化学知识体系。同时它还蕴涵着跨学科的综合知识点,涉及电化学与物理学中电学知识的综合理解和运用,是培养学生创新思维与综合能力的切入点。其次,使学生完整地了解电化学理论建立的概念基础,是使学生深入理解电化学理论的本质的重要手段,同时也是使学生在学习的过程中自主建构化学基本概念体系、提高学习效率、培养学生自主能力的有效途径。
[1]2012年高考化学二轮专题考点复习教案[EB/OL].(2012-04-01).http://www.5ykj.com/.
[2]李丹.高中化学课堂教学研究性学习的研究[D].石家庄:河北师范大学,2006.
[3]胡胜利,周爱华.化学概念心理表征的初步研究[J].心理科学,2006,(2).
