奥沙利铂联合替吉奥用于胃癌术后辅助化疗的安全性分析
2013-10-09高红霞
高红霞
(陕西省延安市博爱医院消化内科,陕西延安,716000)
胃癌是中国常见的恶性肿瘤,5年生存率低于20%[1],而如何提高胃癌患者的生存率及生存质量是亟待解决的世界难题。胃癌病理类型以腺癌为主,对于最常见的腺癌,手术切除能提供最大的治疗机会,但术后复发和转移是胃癌患者死亡的主要原因。近年来有报道[2-6]指出采用奥沙利铂联合替吉奥进行胃癌术后化疗疗效肯定。本研究通过分析2008年1月—2012年12月于本院手术治疗的52例中晚期胃腺癌术后化疗患者的临床资料,探讨奥沙利铂联合替吉奥用于胃癌术后辅助化疗的疗效及安全性,现报告如下。
1 资料与方法
1.1 研究对象
选取2008年1月—2012年12月本院收治的胃癌术后患者52例,其中男36例,女16例,男/女比为 2.25∶1;年龄 34~71岁,平均 56.4岁。所有患者均经手术病理证实为腺癌,均给予奥沙利铂联合替吉奥的胃癌术后辅助化疗方案。所有病例参照AJCC7.0分期。见表1。

表1 患者一般资料情况
1.2 毒性评估
化疗相关毒性按Common Toxicity Criteria-Adverse Events Version 3.0(CTC-AE V3.0)标准评估。化疗延期7 d及以上参照化疗延期的标准[7]。
1.3 随访
化疗后通过门诊、电话、短信或QQ等即时通信随访,随访截至2013年4月10日,由于患者死亡等各种原因,3例失访,随访率94.2%。失访者按截尾数据进行生存分析。中位随访时间10.3个月。
1.4 统计学方法
数据分析采用SPSS19.0统计软件进行分析,不良反应发生率的比较用卡方检验进行分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 一般情况
全部胃癌术后患者共行262周期的辅助化疗,平均(5.00±3.83)个周期,其中 5例(9.6%)化疗1~2周期,11例(21.15%)化疗 3~4周期,31例(59.62%)化疗 5~6周期,5例(9.6%)化疗6周期以上。
17例患者采用奥沙利铂每双周给药一次的方案进行化疗,其中奥沙利铂的中位剂量为85 mg/m2(70~110 mg/m2),第1天,14 d为一个周期,替吉奥的剂量为60mg/m2每天(52~76 mg/m2每天),第1~14天,21 d为一个周期。
54例患者接受三周方案进行化疗,奥沙利铂中位剂量为120 mg/m2,(100~140 mg/m2),其中11例患者奥沙利钼剂量为100~110 mg/m2,替吉奥的剂量为每天65 mg/m2(50~80 mg/m2每天)。
2.2 不良反应
胃癌术后辅助化疗最常见的不良反应为恶心、呕吐(73.2%),食欲下降(65.1%),中性粒细胞降低(63.4%),白细胞降低(67.7%),血红蛋白降低(65.6%)及血小板降低(43.9%)。见表2 、3 、4 。

表2 全部患者的不良反应[n(%)]
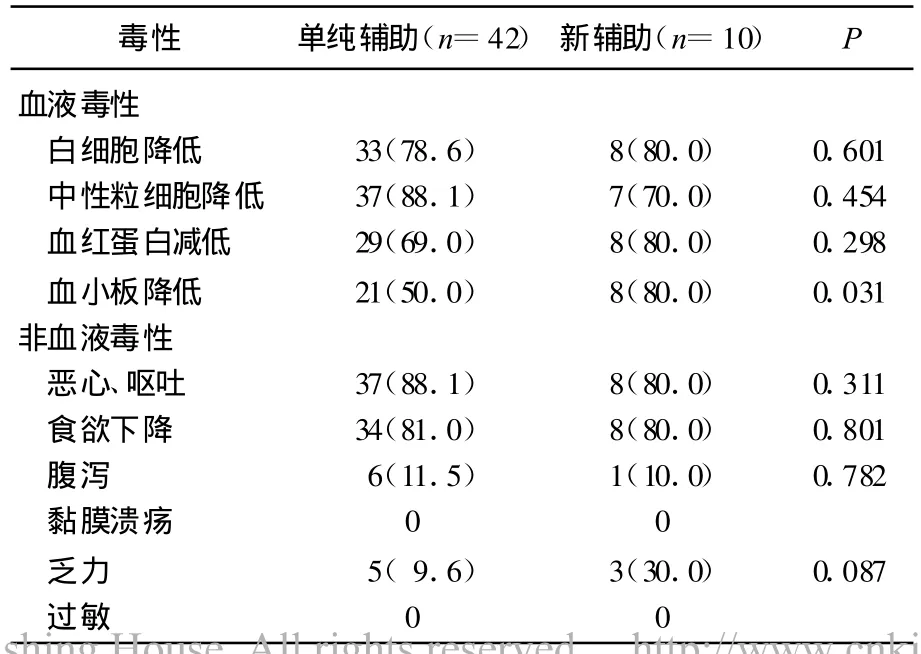
表3 单纯辅助及新辅助化疗患者的治疗相关不良反应[n(%)]

表4 行新辅助及单纯辅助化疗患者的3~4度治疗相关不良反应[n(%)]
2.3 生存情况
截至2013年4月10日,33例无复发生存,5例带瘤生存,14例患者死亡,其中10例因肿瘤进展死亡,1例死于化疗后感染,3例其他原因死亡。1年生存率81%,1年无复发生存率77.2%。
3 讨 论
手术治疗是目前胃癌治疗疗效最为肯定的手段[8]。但近2/3的胃癌患者确诊时已属晚期,只能进行姑息治疗[9-10]。过去的数十年,人们进行了大量的临床试验,试图通过各种综合治疗来减少复发和转移,提高胃癌的远期生存。其中术后辅助化疗研究吸引了广泛的关注目光。越来越多的研究关注到胃癌术后辅助化疗的治疗方案优化及疗效评估。文献[11-12]报道奥沙利铂联合替吉奥化疗在胃癌晚期患者治疗中疗效确切并且患者耐受性好,但是其在胃癌术后辅助化疗的疗效及安全性尚缺乏足够的报道和评估。基于这样的背景,本研究探讨分析奥沙利铂联合替吉奥化疗在胃癌术后辅助化疗中的疗效及安全性。
与以往的报道[11,13]相似,本研究52例新化疗方案的患者中,10例术前接受了平均3.5周期的新辅助化疗。但由于术后的耐受差而不得不停止化疗,术后化疗的中位周期为3周期,术后辅助化疗中骨髓抑制率明显增高,高于术前新辅助化疗患者,血小板的减低最明显成为了停止化疗的原因。这样的结果在以往的文献里也有报道,解释为胃癌患者术后一般较术前耐受性差。因此对于奥沙利铂联合替吉奥用于术后的辅助化疗,应当密切关注化疗过程中不良反应的变化,尤其是骨髓的抑制。其余42例未接受术前新辅助化疗的患者中,3~4度的血液毒性为中性粒细胞下降(15.9%)和血小板降低(9.5%)。相比于顺铂联合替吉奥[14]用于术后辅助化疗的研究,3~4度的血液毒性明显减轻。Sumpter等[15]将1002例不能手术的胃食管腺癌随机分为接受ECF(表阿霉素、顺铂和 5-FU,civ)方案、EOF(表柔比星、奥沙利铂和 5-FU,civ)方案、ECX(表柔比星、顺铂和卡培他滨)方案EOX(表柔比星、奥沙利铂和卡培他滨)方案作比较,发现EOX方案较好,无论在中位生存时间,一年生存率还是骨髓抑制等不良反应方面,EOX组明显好于其他3组,肯定了奥沙利铂替代顺铂的优势。
检测错配修复蛋白[16-17](MMR)广泛存在生物体中,是机体DNA的一种重要的修复机制,在防止基因突变、维持基因稳定性和DNA复制高保真的过程中起着关键作用。MMR基因缺陷导致细胞DNA错配修复功能的丧失,增加细胞自发突变的频率,使细胞内癌基因、抑癌基因以及其他肿瘤相关基因的突变不断积累,最终导致肿瘤的发生。奥沙利铂通过促进肿瘤细胞内的MMR基因缺陷[18-19],使其不能识别奥沙利铂—DNA复合物,避免了肿瘤细胞对奥沙利铂的耐药。因此,奥沙利铂替代顺铂已经成为治疗结直肠癌的为数不多的重要化疗药物之一。
总之,奥沙利铂联合替吉奥新化疗方案用于晚期胃腺癌术后辅助化疗虽可提高患者生存率,但应注意新方案中术后化疗的耐受性和不良反应。
[1]任建松,李倩,关鹏,等.中国2008年消化道常见恶性肿瘤发病、死亡和患病情况的估计及预测[J].中华流行病学杂志,2012,33(10):1052.
[2]BangY J,Kim Y W,Yang H K,et al.Adjuvant capecitabine and oxaliplatin for gastric cancer after D2 gastrectomy(CLASSIC):a phase 3 open-label,randomised controlled trial[J].Lancet,2012,379(9813):315.
[3]Kim G M,Jeung H C,Rha S Y,et al.A randomized phase II trial of S-1-oxaliplatin versus capecitabine-oxaliplatin in advanced gastric cancer[J].Eur J Cancer,2012,48(4):518.
[4]Sasako M,Sakuramoto S,Katai H,et al.Five-year outcomes of a randomized phaseⅢ trial comparing adjuvant chemotherapy with S-1 versus surgery alone in stageⅡorⅢgastric cancer[J].J Clin Oncol,2011,29(33):4387.
[5]de Gramont A,Van Cutsem E,Schmoll H J,et al.Bevacizumab plus oxaliplatin-based chemotherapy as adjuvant treatment for colon cancer(AVANT):a phase 3 randomised controlled trial[J].Lancet Oncol,2012,13(12):1225.
[6]Sanoff H K,Carpenter W R,Freburger J,et al.Comparison of adverse events during 5-fluorouracil versus 5-fluorouracil/oxaliplatin adjuvant chemotherapy for stageⅢcolon cancer:a population-based analysis[J].Cancer,2012,118(17):4309.
[7]Schmoll H J,Cartwright T,Tabernero J,et al.PhaseⅢtrial of capecitabine plus oxaliplatin as adjuvant therapy for stageⅢcolon cancer:a planned safety analysis in 1,864 patients[J].J Clin Oncol,2007,25(1):102.
[8]Gill R S,Al-Adra D P,Nagendran J,et al.Treatment of gastric cancer with peritoneal carcinomatosis by cytoreductive surgery and HIPEC:a systematic review of survival,mortality,and morbidity[J].J Surg Oncol,2011,104(6):692.
[9]Matharu G,Tucker O,Alderson D.Systematic review of intraperitoneal chemotherapy for gastric cancer[J].Br J Surg,2011,98(9):1225.
[10]Koizumi W.Chemotherapy for advanced gastric cancer:review of global and Japanese status[J].Gastrointest Cancer Res,2007,1(5):197.
[11]周一.胃癌术后辅助化疗的安全性分析及临床获益[D].北京协和医学院,中国医学科学院,北京协和医学院,清华大学医学部,中国医学科学院,2012.
[12]李元方,周志伟,李威,等.卡培他滨联合洛铂对比联合奥沙利铂用于进展期胃癌D2术后辅助化疗[J].广东医学,2012,33(9):1324.
[13]Cunningham D,Allum W H,Stenning S P,et al.Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer[J].N Engl J Med,2006,355(1):11.
[14]Takahari D,Hamaguchi T,Yoshimura K,et al.Feasibility study of adjuvant chemotherapy with S-1 plus cisplatin for gastric cancer[J].Cancer Chemother Pharmacol,2011,67(6):1423.
[15]Sumpter K,Harper-Wynne C,Cunningham D,et al.Report of two protocol planned interim analyses in a randomised multicentre phaseⅢstudy comparing capecitabine with fluorouracil and oxaliplatin with cisplatin in patients with advanced oesophagogastric cancer receiving ECF[J].Br J Cancer,2005,92(11):1976.
[16]Devaud N,Gallinger S.Chemotherapy of MM R-deficient colorectal cancer[J].Fam Cancer,2013,(29):Epub ahead of print.
[17]Liu D,Wu H Z,Zhang Y N,et al.DNA repair genes XPC,XPG polymorphisms:relation to the risk of colorectal carcinoma and therapeutic outcome with Oxaliplatin-based adjuvant chemotherapy[J].Mol Carcinog,2012,51(Suppl 1):E83.
[18]Amarantidis K,Xenidis N,Chelis L,et al.Docetaxel plus oxaliplatin in combination with capecitabine as first-line treatment for advanced gastric cancer[J].Oncology,2011,80(5/6):359.
[19]Lin R B,Fan N F,Guo Z Q,et al.A phaseⅡ study of 5-fluorouracil/leucovorin in combination with paclitaxel and oxaliplatin as first-line treatment for patients with advanced gastric cancer[J].J Chemother,2008,20(6):744.
