一株猪肺炎支原体HN0613株的分离鉴定
2013-10-09廖永洪张许科孙进忠胡东波谷世江白朝勇
廖永洪,张许科,孙进忠,胡东波,谷世江,刘 栓,白朝勇
(1.国家兽用药品工程技术研究中心生物制品研究所,河南洛阳 471003;2.普莱柯生物工程股份有限公司,河南洛阳 471003)
猪肺炎支原体(Mycoplasma hyopneumoniae,Mhp)可引起猪支原体肺炎,又称地方流行性肺炎,是猪的一种慢性消耗性呼吸道病,临床感染率极高。其主要症状为咳嗽和气喘,以高发病率和低死亡率为特点。猪群一旦感染Mhp,便难以清除,不仅严重影响猪群的生长发育,用药量增加,而且容易继发感染PRRSV、PCV等,从而导致多种疫苗接种失败[1-2]。猪肺炎支原体作为猪呼吸道病综合征的重要病原之一,直接或间接对养猪业造成了巨大的经济损失。猪肺炎支原体体外培养对生长条件要求苛刻,营养要求高且生长速度缓慢,分离过程中受猪的其他支原体(如猪鼻支原体)的影响,导致猪肺炎支原体分离鉴定难度较大。本研究通过采集河南各地猪场疑似猪肺炎支原体感染猪病变肺脏,进行了猪肺炎支原体的分离、培养,得到一分离株,命名为HN0613株,并对其进行了生物学特性研究,包括PCR、测序分析、生化鉴定、生长抑制和致病性试验。
1 材料与方法
1.1 材料
1.1.1 病料来源 2006年从河南省各地采集疑似猪支原体肺炎病变肺脏,共16份。
1.1.2 培养基 猪肺炎支原体Friis培养基,BD公司;猪血清,GIBCO公司;酚红指示剂,美国AMRESCO公司。
1.1.3 生化试剂 化学试剂,国药集团化学试剂有限公司;细菌基因组DNA提取试剂盒,TIANGEN公司;狄氏染色试剂盒,重庆庞通医疗器械有限公司;生化鉴定试剂,杭州天和微生物试剂有限公司。
1.1.4 阴性、阳性血清 兔抗猪肺炎支原体J株特异性血清,由普莱柯生物工程股份有限公司制备。未免兔血清作为阴性血清。
1.1.5 实验动物 1~2周龄健康仔猪(经IDEXX试剂盒检测其血清中Mhp及PRRSV抗体,均为阴性),由河南省伊川县某猪场提供。
1.1.6 仪器与设备 生物安全柜(苏州安泰,BHC-1300ⅡA2)、CO2培养箱(德国 Thermo,Heracell 240Ⅰ)、显微镜(Leica,DM750)、PCR 仪(墨西哥BIORAD,PTC0200)。
1.2 方法
1.2.1 病料处理 取疑似支原体肺炎病变肺脏,在超净台内用无菌手术剪刀剪取发病部位边缘组织,放入无菌平皿,将病肺组织剪成1~2 mm3碎块,接种Friis肉汤,37℃培养,每日观察培养液的pH值变化。培养液变色时,取第一代经0.45μm过滤器过滤的培养物0.5 mL接种到1.5 mL含青霉素2000 U/mL的Friis肉汤培养基中,37℃继续培养,培养基变黄后直接取培养物进行移植传代。
1.2.2 形态学观察
1.2.2.1 纯化 取0.2 mL培养物涂布于 Friis平板固体培养基表面,置37℃、5%CO2条件下培养,每日观察是否有支原体样菌落。取支原体样单个菌落接种于 Friis肉汤,培养基颜色变黄后取0.2 mL培养物涂布于Friis平板固体培养基表面置37℃,5%CO2条件下进行纯化培养,如此进行纯化培养2次。将最后一次纯化培养生长的支原体样菌落接种Friis液体培养基所得的颜色变黄培养物保存于-70℃备用。
1.2.2.2 镜检 取培养基变黄的培养物和单个菌落进行涂片,分别做革兰氏染色和瑞氏染色,镜检。
1.2.2.3 菌落形态观察 按参考文献[3]进行,采用无菌方法从固体培养基上切下菌落,放到载玻片上,在两边垫上竹签,滴上狄氏染色液后再盖上一块玻片,置于4℃染色30 min后,低倍镜下观察结果。
1.2.3 PCR鉴定及测序分析 用细菌基因组DNA提取试剂盒提取DNA模板。PCR引物参考文献进行合成[4]。FSp36,5’- GGGCCGATGAAACCTATTAAAATAGCT-3’Rsp36,5’-GCCGCGAAATTAAATATTTTTAATTGCATCCTG-3’,上海生工合成。PCR 反应体系:超纯水 34.5μL、10×PCR Buffer 5 μL、dNTP 4 μL、引物各2 μL、模板2 μL、TaqDNA聚合酶0.5μL。按下列参数进行PCR反应:预变性94℃ 3 min;94℃ 30 s,53℃退火30 s,72℃延伸90 s,35个循环后;72℃终延伸10 min。扩增结束后取上述产物琼脂糖凝胶电泳检测。直接将有特异性条带的PCR产物及引物提交至上海生工进行测序分析。
1.2.4 生化试验 生化试验参考文献[3]进行。主要进行洋地黄皂甙敏感性试验、尿素酶试验、葡萄糖分解试验、精氨酸水解试验、三苯基氯化四氮唑(TTC)还原试验、七叶甙水解试验、甘露醇分解试验、薄膜和斑点形成试验。
1.2.5 生长抑制试验(GIT)Friis平板接种0.1 mL对数生长期的分离株培养物,将未稀释的抗血清25μL吸附于灭菌的6 mm滤纸片,将吸有血清的滤纸片贴附于平板表面,培养至菌落可见。正常兔血清处理的纸片作为阴性对照。培养观察圆纸片周围有无菌落抑制环的产生。抑制宽度达1 mm以上时,判为猪肺炎支原体阳性[3]。
1.2.6 代谢抑制试验(MIT) 在10支小管中分别加入1 mL Friis肉汤,于第1支小管内加入1 mL兔抗猪肺炎支原体J株特异性血清,混匀后取1 mL于第2支小管,如此进行2倍梯度稀释至第8支小管,混匀后弃去1 mL。取对数生长期分离株培养物,用Friis肉汤10000倍稀释,在第1~9支小管内分别加入1mL稀释培养物,第10支管内加入1 mL阳性血清,置37℃培养,每天观察培养液的颜色变化,当菌液对照管颜色变黄时,小管中培养液颜色未变黄的血清最高稀释度的倒数即为抑制价。取正常兔血清,按以上程序进行操作,作为代谢抑制试验的对照。
1.2.7 分离菌株的致病性 将分离菌株培养物经气管注射1~2周龄健康易感猪3头,每头5mL(108CCU)。另设3头条件相同的对照猪,各气管注射培养基5 mL,作为对照。试验猪、对照猪隔离饲养。攻毒后按常规饲养,饲料中无抗生素。观察28 d,每日测体温。注射28 d后剖检,根据猪支原体肺炎肺病变指数记分标准对试验猪的肺病变进行记分。试验组与对照组进行肺病变指数差异分析。对试验猪及对照猪按1.2.1项进行猪肺炎支原体的分离,对分离株按1.2.3项方法进行PCR鉴定。
2 结果
2.1 培养结果 16份病料中仅有1份病料接种的培养基7 d后变黄色,过滤接种后5 d培养液变黄,培养液均匀混浊,转接于含青霉素的Friis培养基,6 d后培养液变色,取培养液转接于固体培养基后,菌落生长入培养基内部。菌落呈典型煎荷包蛋状,与支原体菌落形态相符,命名为HN0613株猪肺炎支原体。
2.2 形态学观察 革兰氏染色未发现细菌,瑞氏染色发现有支原体样菌体。将固体培养基上菌落经狄氏染色后在低倍镜下观察,菌落被染成不褪色的中心深蓝色菌落(图1),与支原体菌落染色特性相符。
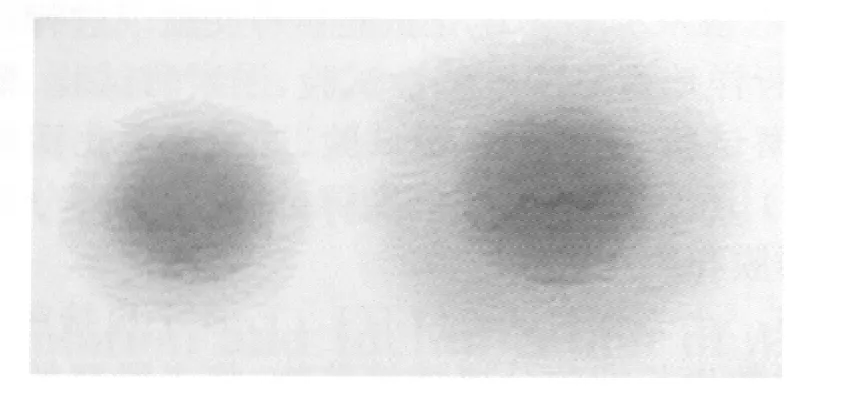
图1 Friis固体培养基猪肺炎支原体菌落狄氏染色后形态图
2.3 PCR鉴定及测序分析 所提取的分离培养物模板经PCR扩增后,再经琼脂糖凝胶电泳检测,待检病料或培养物均在750~1000 bp之间接近1000 bp的位置有一条带,与预期948 bp相符(图2)。将PCR扩增产物测序结果与GenBank中Mhp部分序列进行同源性比较,结果显示,HN0613分离菌株P36基因序列与NCBI中公布的Mhp P36基因序列相应序列同源性为98%以上。

图2 PCR鉴定结果
2.4 生化试验 分离菌株生化反应与猪肺炎支原体生化特性相符(表1)。
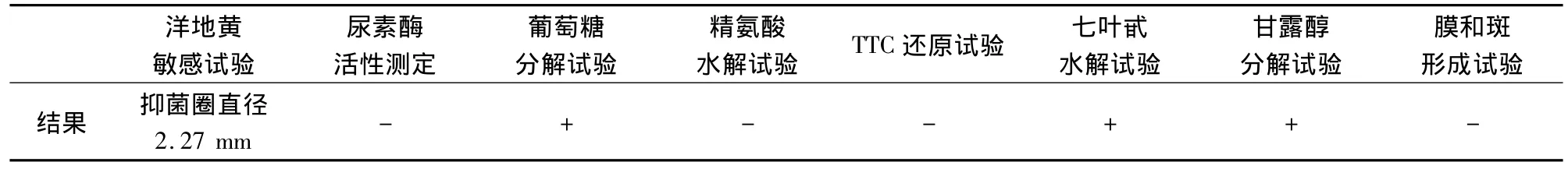
表1 HN0613分离株生化试验结果表
2.5 生长抑制试验 分离株HN0613在吸有抗血清的滤纸片周围出现了直径为2.38 mm的抑菌环,而正常兔血清处理的滤纸片周围无抑菌环。
2.6 代谢抑制试验 培养至第5天时,菌液对照管及代谢抑制试验对照管的培养液均变为黄色,血清对照管培养液颜色无变化,加有抗血清的第6~8支小管内的培养液变为黄色,即其代谢抑制价为64。2.7 分离菌株的致病性试验 将菌株培养物经气管内注射10日龄健康易感猪(IHA抗体<1∶5),10 d后均相继出现咳嗽和气喘等猪支原体肺炎症状。28 d后剖检可见轻度肺病变,病变指数在9~15之间。而对照组均未出现上述症状及病变,剖检猪肺部未见异常。临床观察和肺部病变结果见表2。

表2 HN0613分离株对仔猪感染情况
对试验组3头猪进行猪肺炎支原体分离,对其变色液体培养物按1.2.3项步骤进行PCR检测,结果在略小于1000bp处出现特异性条带(图2泳道3),目的条带大小为948bp,证明分离病原为猪肺炎支原体。
3 结论
从猪支原体肺炎典型病例的病肺中分离到了疑似猪肺炎支原体的微生物,经各项鉴定具有猪肺炎支原体的特性,生长抑制试验、代谢抑制试验、PCR及测序鉴定结果表明该微生物属于猪肺炎支原体,命名为猪肺炎支原体HN0613株。猪肺炎支原体HN0613在Friis培养基中培养含量可达108CCU/mL,对健康易感猪具有一定的毒力,可致其产生运动后咳嗽、气喘、呼吸困难等支原体肺炎典型的临床症状及肺部肉变。因此该菌株可作为疫苗候选株进一步研究。
[1] 金升藻.猪支原体肺炎的诊断与综合防治[J].上海畜牧兽医通讯,2008,(3):52 -53.
[2] 沈青春,宁宜宝,覃青松.猪肺炎支原体的研究进展[J].中国兽药杂志,2003,37(6):26 -30.
[3] 曹澍泽.兽医微生物学及免疫学技术[M].北京:北京农业大学出版社,1992:49-50.
[4] JCaron,MOuardani,SDea.DiagnosisandDifferentiationof MycoplasmahyopneumoniaeandMycoplasmahyorhinisInfections inPigsbyPCRAmplificationofthep36andp46Genes[J].JournalofClinicalMicrobiology,2000,38(4):1390 -1396.
