锦鲤疱疹病毒-CJ株ORF124基因的克隆及生物信息学分析
2013-10-09周井祥吕文亮李新伟
周井祥,王 好,吕文亮,李新伟
(吉林农业大学动物科技学院,长春 130118)
锦鲤疱疹病毒病(Kio herpesvirus disease,KHVD)是由锦鲤疱疹病毒(Kio herpesvirus,KHV)引起锦鲤、鲤鱼及其普通变种如框镜鲤发病的一种具有高度传染性和致死性的疾病。该病于1998年首次在以色列的 Magan Michael地区和美国爆发[1],2000年该病在中国广东省锦鲤疑似发生本病[2]。该病在我国的鲤鱼养殖中发病较多,造成鲤鱼的大量死亡,给鲤鱼养殖业带来了巨大经济损失。KHV是线形双股DNA病毒,是鱼类疱疹病毒属中基因组最大的病毒[3]。目前,Genbank已经公布了三株分别来自日本、美国和以色列锦鲤疱疹病毒的基因序列[4],基因组大小为295 kbp,并含有22 kbp的末端同向重复序列;有156个开放性阅读框(ORF),8个末端重复序列。KHV的156个ORF的功能只有少数已经确定其功能。研究较多的ORF25、ORF81和ORF83基因主要在细胞质中表达[5],可以诱导产生中和抗体。研究还对ORF25、ORF81和ORF83基因进行了生物信息学分析[6-8];Agus Sunarto 等[9]克隆了编码白细胞介素-10(ORF134基因)并对其功能进行了分析;Takashi Aoki等[10]制备了针对 KHV ORF68 基因的单克隆抗体;Murwantoko等克隆了KHV膜糖蛋白基因ORF124并对其进行了表达,同时对其进行了部分生物学信息分析,ORF124基因预测分析表明:主要表达膜糖蛋白,可具有良好的免疫原性,产生中和性抗体,可作为制备疫苗的候选基因[11]。
研究以实验室在国内首次分离到的锦鲤疱疹病毒吉林株(KHV-CJ株)基因组为模板,克隆KHV膜蛋白ORF124基因,并分析其生物学信息,旨在为我国锦鲤疱疹病毒的基因背景信息,发病机理,分子流行病学及基因工程疫苗的研究奠定基础。
1 材料与方法
1.1 细胞与病毒 锦鲤疱疹病毒中国吉林株(KHV-CJ株)由吉林农业大学动物生产及产品质量安全教育部重点实验室分离保存[12];锦鲤疱疹病毒尾鳍原代细胞由吉林农业大学动物生产及产品质量安全教育部重点实验室繁殖保存。
1.2 菌株与载体 pMD18-T载体购自大连宝生物工程有限公司,E.coli DH5α,北京全式金生物技术有限公司。
1.3 主要试剂 新生牛血清(批号1076962)、M199培养基(批号 1098911),GBICO公司;Ex Taq DNA聚合酶、限制性内切酶Bam HⅠ和Eco RⅠ、10×ExBuffer(批号 AA7701A)、dNTP Mix(批号BG8601A)、DNA Marker,大连宝生物工程有限公司;DNA胶回收试剂盒(批号I8110),天跟生化有限公司;质粒小提试剂盒(批号20100916),北京索来宝科技有限公司。
1.4 引物的设计及合成 根据GenBank上登录的锦鲤疱疹病毒 ORF124基因序列,利用 Primer Premier 5.0软件设计1对引物,P1:5'-GAATTCATGGGACCTTTGACCATCTA -3',P2:5'-GGATCCTCACTTGAGCTCGCC -3',分别引入 Eco RⅠ和Bam HⅠ限制性酶切位点(划线部位),由上海生工生物工程技术服务有限公司合成。
1.5 KHV-CJ株ORF124基因的 PCR扩增 按照 Hasegawa[13]和 Neukirch[14]的方法培养细胞。将实验室保存的KHV-CJ株病毒液反复冻融三次后,取1 mL与MFC细胞单层在22℃的条件下共培养。逐日观察细胞病变情况,收集细胞病变达70%80%的细胞及上清液,用碱裂解法提取病毒DNA,用于PCR特异性扩增。采用25μL反应体系进行PCR,反应条件如下:95℃5 min;94℃40 s,59 ℃30 s,72 ℃1 min,35 个循环,72 ℃10 min,反应结束后4℃保存。
1.6 KHV-CJ株ORF124基因的克隆及鉴定 用凝胶回收试剂盒将目的片段纯化回收后,与pMD18-T载体连接,转化至DH5α感受态细胞,在含有氨苄青霉素的LB琼脂平板上筛选单菌落,接种于含0.1 mg/mL氨苄青霉素的LB培养基中,200 r/min振荡培养过夜,提取重组质粒,以Eco RⅠ和Bam HⅠ进行双酶切鉴定阳性重组质粒。筛选出的阳性质粒送至上海生工生物工程技术服务有限公司测序。
1.7 KHV-CJ株ORF124基因编码蛋白的生物信息学分析 利用DNAStar软件翻译出ORF25基因的核苷酸序列;利用 SingalPv 3.0(http://www.cbs.dtu.dk/services/SignalP/)软件进行氨基酸序列的信号肽分析;利用 TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)软件进行跨膜区分析;利用 ProtScale(http://www.expasy.ch/tools/protscale.html)软件分析蛋白的疏水性;利用BepiPred 1.0 Server(http://www.cbs.dtu.dk/services/BepiPred/)软件和 DNAStar 6.0(Protean)对ORF124序列编码的蛋白进行抗原表位分析;分别利用 NetNGlyc 1.0(http://www.cbs.dtu.dk/services/NetNGlyc/)和 YinOYang 1.2(http://www.cbs.dtu.dk/services/YinOYang/)在线分析软件进行N-糖基化位点和O-糖基化位点预测,利用NetPhos 2.0(http://www.cbs.dtu.dk/services/Net-Phos/)进行磷酸化位点预测。
2 结果
2.1 ORF124基因的PCR扩增和鉴定 从细胞毒中提取KHV-CJ株总DNA后,经PCR扩增出一条与目的片段大小相符的DNA片段(见图1)。将目的片段纯化回收后,与pMD18-T载体连接,经氨苄青霉素抗性筛选后,将阳性重组质粒用限制性内切酶Eco RⅠ和,Bam HⅠ进行双酶切,获得一段约846 bp的片段(见图2),说明ORF124基因片段已成功克隆至载体中。测序结果表明:KHV-CJ株与日本株、美国株、以色列株同源性均为99%,证明克隆出KHV-CJ株ORF124基因。

图1 锦鲤疱疹病毒KHV-CJ株ORF124基因的PCR扩增
2.2 HV-CJ株ORF124基因的生物信息学分析
2.2.1 锦鲤疱疹病毒 KHV-CJ株 ORF124基因的序列结果和编码蛋白质分子特征 测序结果表明,ORF124基因长846 bp,为一完整的开放阅读框,编码281个氨基酸,预测ORF124基因的理论分子质量为31221.96 Da,等电点为8.158,含有27 个强碱性氨基酸(K、R)、25个强酸性氨基酸(D、E)、93 个疏水氨基酸(A、I、L、F、W、V)、80 个极性氨基酸(N、C、Q、S、T、Y)。

图2 KHV-CJ株ORF124基因的双酶切鉴定
2.2.2 KHV-CJ株ORF124基因的信号肽分析
将测得的ORF124氨基酸序列在丹麦技术大学生物序列分析中心(CBS)的网站 http://www.cbs.dtu.dk/services/SignalP进行在线分析,通过Singal-Pv3.0进行信号肽切割位点的预测。结果显示(图3),信号肽切割部位最可能位于24位的T(苏氨酸)和25位的V(缬氨酸)氨基酸之间。
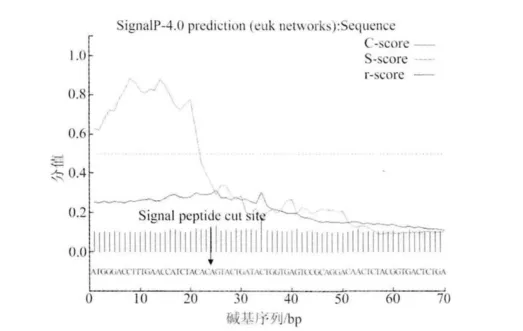
图3 KHV-CJ株ORF124基因的信号肽预测
2.2.3 KHV-CJ株ORF124基因的跨膜区分析
TMHMM预测ORF124没有跨膜区(图4)。
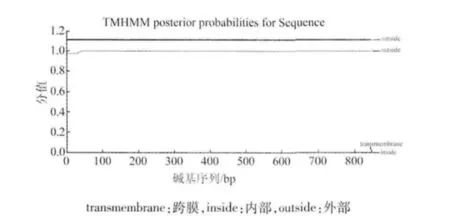
图4 KHV-CJ株ORF124基因的跨膜区分析
2.2.4 KHV-CJ株ORF124基因的疏水性分析
通过ProtScale在线分析,ORF124基因的最大疏水指数为2.189,最小疏水指数为 -0.567,其疏水性分析结果(图5)。
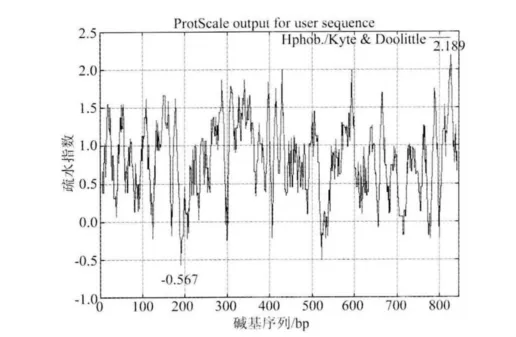
图5 KHV-CJ株ORF124基因的疏水性分析
2.2.5 KHV-CJ株ORF124基因的抗原表位分析
用 http://www.cbs.dtu.dk/services/BepiPred/在线软件及 DNAStar6.0(Protean)对锦鲤疱疹病毒ORF124基因编码的蛋白进行抗原表位分析,得出其抗原表位主要集中在第9~26、43~58、67~73、98 ~112、130 ~165、237 ~253、260 ~294、303 ~361、494~514、571~599、804~833位氨基酸(见图6)。表明该蛋白的表面抗原决定簇位点区域广泛,峰值高。预示KHV-CJ株ORF124基因可作为基因工程疫苗的重要候选基因。
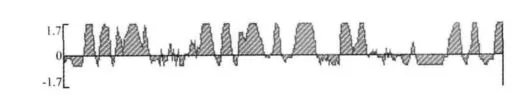
图6 KHV-CJ株ORF124基因的抗原表位分析
2.2.6 KHV-CJ株ORF124糖基化及磷酸化位点的预测 分别通过NetNGlyc 1.0在线分析软件和YinOYang 1.2在线分析软件对 KHV-CJ株ORF124进行N-糖基化位点和O-糖基化位点预测。结果表明,其氨基酸序列不存在潜在的N-糖基化位点,11个潜在的O-糖基化位点。用NetPhos 2.0在线分析软件对 KHV-CJ株ORF124基因进行磷酸化位点进行预测,结果显示,当阈值取0.5时,其氨基酸存在7个潜在的磷酸化位点。
3 讨论
锦鲤疱疹病毒病是由锦鲤疱疹病毒(Kio herpesvirus,KHV)引起的一种传染性疾病,主要病症是引起各生长阶段鲤鱼、框镜鲤、锦鲤因烂鳃而窒息死亡,死亡率高80100%,疫情难以控制,已引起各国的高度关注。2002年开始在我国传播[3],至今已遍布全国各地[5],需要进一步研究有效的疫苗,避免病毒的散播并消除病毒变异的可能,并填补目前国内没有有效疫苗的空白,控制KHV在我国暴发流行。而本研究选用KHV-CJ株ORF124基因进行克隆和生物信息学分析,为进一步研制基因工程疫苗奠定基础。
试验成功获得了长846 bp的ORF124基因,并使用Hidden Markov(HMM)模型对其信号肽进行预测。信号肽是引导翻译出的前体蛋白通过细胞膜分泌到胞外的一段序列,只有切除信号肽序列后前体蛋白才能进入到分泌信号区,变成具有正常功能的成熟蛋白[15],因此预测信号肽切割位点,可以对进行表达研究的引物设计和真核及原核表达载体的构建提供有价值的信息。另外,信号肽负责不同类蛋白质的新生肽链的定位,信号肽的功能已不仅决定一个蛋白质是否是分泌蛋白,而且和蛋白质或其新生肽链在细胞内的全方位定位有关[16],对蛋白质信号肽的分析具有潜在的应用价值。用Net-Phos 2.0在线分析软件对KHV-CJ株ORF124基因进行磷酸化位点进行预测显示,当阈值取0.5时,其氨基酸存在7个潜在的磷酸化位点。蛋白质糖基化是一种重要的翻译后修饰,约有一半以上的蛋白质发生了糖基化,越来越多的数据表明:糖基化作为一种主要的翻译后修饰对蛋白质功能有着重要影响[17],并可提高蛋白基因组的多样性[18],其中N-糖基化作用位点与抗原性和免疫原性有关[19]。
对锦鲤疱疹病毒ORF124基因编码的蛋白进行抗原表位分析,表明该蛋白的表面抗原决定簇位于区域广泛而集中,峰值高。免疫细胞通常难以借助其表面受体识别整个蛋白质抗原分子,而仅识别抗原肽分子上的一个特定部分即表位,又称为抗原决定簇。因而表位代表了抗原分子上的一个免疫活性区,负责与抗体分子或免疫细胞表面的抗原受体结合,也是蛋白质抗原性的基础,正确而详细地绘制蛋白质表位图谱,对定点改造蛋白质分子,设计疫苗分子结构及免疫干预治疗等具有重要意义[20]。抗原表位分析表明:KHV-CJ株 ORF124基因优于 KHV - CJ 株 ORF81、ORF83[9,11],预示KHV-CJ株ORF124基因可作为基因工程疫苗的重要候选基因。
测序结果分析表明:KHV-CJ株ORF124基因与美国株、以色列株、日本株同源性均为99%,仅差一个碱基,但与美国株、以色列株表达氨基酸相同,与日本株不同。分别比对 KHV-CJ株 ORF81、ORF25、ORF83、ORF124 四个基因[9-11],进化树同源性上分析结果一致,进一步说明KHV-CJ株与欧美国家传播的KHV具有同源性。
试验选用KHV的膜糖蛋白基因-ORF124基因作为目的基因,以在我国分离到的锦鲤疱疹病毒中国吉林株的DNA作为模板,成功将其克隆,并采用生物信息学方法对其结构和功能进行了分析,为我国锦鲤疱疹病毒的基因背景信息、发病机理、分子流行病学及基因工程疫苗的研究奠定了基础。
[1] Hedrick R P,Gilad O,Yun S,et al.A herpesvirus associated with massmortality of juvenile and adult koi,a strain of common carp[J].JAquat Anim Health,2000,12(1):44 - 57.
[2] 刘 荭,史秀杰,高隆英,等.进口锦鲤暴发病病原的nested-PCR 鉴定[J].华中农业大学学报,2002,21(5):414-418.
[3] Pikarsky E,Ronen A,Abramowitz J,et al.Pathogenesis of acute viral disease induced in fish by carp in-terstitial nephritis and gill necrosis virus[J].JVirol,2004,78:9544 -9551.
[4] Aoki T,HironoI,Kurokawa K,et al.Genome sequences of three koi herpesvirus isolates representing the expanding distribution of anemerging disease threatening koi and common carp world wide[J].JVirol,2007,81:5058 -5065.
[5] 朱 霞,王 好,周井祥,等.锦鲤疱疹病毒病的研究进展[J].中国兽医科学,2011,41(1):106 -110.
[6] 李新伟,周井祥,朱 霞,等.锦鲤疱疹病毒-CJ株ORF83基因的克隆及生物信息学分析[J].中国兽医科学,2011,41(10):1016-1020.
[7] 周井祥,李新伟,朱 霞,等.锦鲤疱疹病毒-CJ株ORF25基因的克隆及生物信息学分析[J].中国兽药杂志,2012,46(3):1-4.
[8] 周井祥,李新伟,王 好,等.锦鲤疱疹病毒-CJ株ORF81基因的克隆及生物信息学分析[J].水产学报,2011,35(12):1780-1786.
[9] Agus Sunarto,Clifford Liongue,Kenneth A McColl,et al.Koi herpesvirus encodes and expresses a functional interleukin-10[J].JVirol,2012,86(21):11512 - 11520.
[10] Takashi Aoki,Tomokazu Takano,Sasimnanas Unajak,et al.Generation of monoclonal antibodies specific for ORF68 of koi herpesvirus[J].Comparative Immunology,Microbiology and Infectious Diseases,2010,11:1 -8.
[11] Murwantoko,Dewi Nur’aeni Setyowati,Rarastoeti Pratiwi,et al.Cloning and expression of ORF124 koi herpesvirus as a vaccine[J].Indonesian Journal of Biotechnology,2012,17(1):42 -50.
[12]朱 霞,王 好,周井祥,等.一株锦鲤疱疹病毒的分离与鉴定[J].中国预防兽医学报,2011,33(5):340 -343.
[13] Hasegawa S,Somamoto T,Nakayasu C,et al.A cell line(CFK)from fin of isogeneic ginbuna crusian carp[J].Fish Pathol,1997,32:127-128.
[14] Neukirch M,Bottcher K,Bunnajirakul S,et al.Isolation of a virus from koiwith altered gills[J].Bull Eur Assoc Fish Pathol,1999,19:221-224.
[15] Schult Z U,Kock J,Schlich T H J,et al.Recombinant duck interferon:a new reagent to study the mode of interferon action against H epatitis B virus[J].Virology,1995,212(2):641 -649.
[16]韦 雪,芳 王,冬 梅,等.信号肽及其在蛋白质表达中的作用[J].生物技术通报,2006,6:38 -42
[17] Haagglund P,BunKenborg J,Elortza F,et al.A new strategy for identification of N-glycosylated proteins and unambiguous assignment of their glycosylation sitesusing HILIC enrichmentand partial deglycosylation[J].JProteome Res,2004,3(3):556.
[18] Weerapana E,Imperiali B.Asparagin e linked protein glycosylation:from eu karyotic to prokaryotic systems[J].G ycobology,2006,16(6):91R -101R.
[19] Gunn P,Sato F,Powell K,et al.Rotavirus neutralizing protein VP7:antigenic det-erminants investigated by sequence analysis and peptide synthesis[J].JVirol,1985,54(3):791 -797.
[20]李海侠,毛旭虎.蛋白质抗原表位研究进展[J].微生物学免疫学进展,2007,35(1):54 -58.
