马立克氏病毒强毒GD0908株感染性克隆的构建
2013-10-09陈瑞爱刘正伟王亚欣
陈瑞爱,罗 琼,郭 凯,刘正伟,王亚欣
(1.广东省兽用生物制品生物技术研究与应用企业重点实验室,广东肇庆 526238;2.华南农业大学兽医学院,广州 510000)
马立克氏病(Marek’s disease,MD)是鸡常见的一种淋巴细胞增生性疾病,该病由马立克氏病病毒(Marek’s disease virus,MDV)引起,具有高度传染性。该病以外周神经、生殖腺、各个脏器、肌肉、皮肤中单核细胞浸润以及由于外周神经肿瘤细胞的集聚而引起的半瘫痪或完全瘫痪为典型特征,引起多种功能障碍并可导致被感染鸡产生肿瘤和死亡,在未免疫鸡群可造成很高的发病率和死亡率[1-2]。
MDV可分为3个血清型,血清Ⅰ型(MDV-1)包括致瘤型的MDV及其一些致弱的疫苗毒株;血清Ⅱ型(MDV-2)为非致瘤性的自然弱毒株;血清Ⅲ型(MDV-3)为最早用作疫苗毒的火鸡疱疹病毒(HVT),无致瘤性[3-5]。目前广泛使用的传统疫苗也存在着许多的不足之处,免疫MD疫苗并不能消除鸡体内的病毒,免疫鸡仍然可以携带强毒并向环境中排毒,据研究,这种情况可能是导致MDV毒力不断增强的重要原因[6-7]。为了更好的了解鸡场中MD的流行规律及病毒的分子特征,对野毒株进行分离鉴定,并对这些致病相关基因进行序列分析是十分必要的。长期以来,MDV基因组研究一直缺乏快速、方便可靠的病毒DNA操作方法,基于细菌人工染色体(Bacterial artificial chromosome,BAC)系统的MDV感染性克隆的成功构建使MDV分子水平上的操作变的简单可行[8-9]。
实验室于2009年在中国广东已经免疫MD疫苗的种鸡场分离了一株MDV,命名为GD0908株并利用BAC技术,构建了GD0908株的感染性克隆rGD0908,为MDV基因组学及其致病机理的研究提供了技术平台。
1 材料与方法
1.1 毒株 GD0908株,于2009年由本实验室分离自广东省某鸡场发生肿瘤的40周龄三黄种鸡,该鸡群已用 CVI988/Rispens株 MDV疫苗免疫,CVI988株为MDV I型弱毒株,颈部皮下免疫1羽份(不低于3000 PFU),仍有超过5%的肿瘤发生率。GD0908株的分离过程如下:无菌操作采集病鸡的全血,加入抗凝剂(3.5%柠檬酸钠)后摇匀,分离外周血淋巴细胞后接种长成单层的鸡胚成纤维细胞(CEF),置37℃ 和5%CO2细胞培养箱中培养68 d后出现明显的MDV蚀斑,鸡胚成纤维细胞(Chicken embryo fibroblast,CEF)同时未发现其它已知病毒。该毒株经噬斑克隆后利用间接免疫荧光[10]证实为 MDVⅠ型病毒,将该毒株命名为GD0908株。通过SPF鸡的人工感染实验确定了GD0908株的致病性,并验证了其毒力(病理组织学病变率为97.5%(39/40))较国内的J-1株强(病理组织学病变率87.5%(35/40))(未发表数据)。
1.2 菌株与质粒 DH10B大肠杆菌用来构建BAC克隆的宿主菌,由本实验室保存。含有BAC骨架用于同源重组的质粒pUS2-BAC-gpt为本实验室保存(图1),重组质粒在MDV US2同源臂序列之间加入了BAC骨架、氯霉素抗性基因及gpt筛选基因。
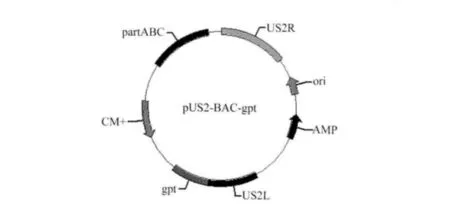
图1 pUS2-BAC-gp t质粒示意图
1.3 相关试剂 DMEM、转染试剂lipofectamine及新生牛血清,Invitrogen公司。PCR反应试剂、限制性内切酶、DL2000、DL15000 marker和 rTaq酶,大连TaKaRa公司;凝胶回收试剂盒、QIAGEN plasmid Mini kit、QIAGEN plasmid Midi kit,QIAGEN 公司;氯霉素及氨苄青霉素,Amresco公司。霉酚酸(MPA)、黄嘌呤(xanthine)、次黄嘌呤(hypoxanthine)、FITC标记的抗鼠IgG二抗,Sigma公司。
1.4 重组病毒的构建
1.4.1 转染 CEF细胞 按常规方法提取感染GD0908的CEF细胞基因组DNA,取1μg上述提取的 DNA与2.5μg pUS2-BAC-gpt质粒 DNA共同转染原代CEF[7],转染后,在37℃﹑5%CO2细胞培养箱培养,等待噬斑出现
1.4.2 接种培养 转染6 d后,将转染出的病变细胞整孔用PBS洗两遍,用0.05%的胰酶消化,接种到含有8×106个CEF的T75细胞瓶中,接种前1 h在上述细胞瓶培养基中加入250μg/mL霉酚酸,50μg/mL黄嘌呤及 100μg/mL次黄嘌呤,37℃,5%CO2细胞培养箱培养,5 d后将感染的CEF消化下来再次接种于含有筛选培养基的CEF中,如此反复进行4次,用以提高发生同源重组产生的MDV的浓度,待出现60%的细胞病变时,将细胞消化,提取细胞基因组 DNA[8]。
1.5 BAC分子克隆化病毒的获得 取1.4中所述收获的感染GD0908株的CEF细胞基因组DNA 1μg与50μL DH10B感受态细胞于预冷的0.1 cm电转化杯中,在2000 V,100Ω,25μF的条件下进行电转化。电击后迅速加入1 mL预热至37℃的SOC液体培养基,置于37℃、200 r/min摇床培养2 h后,取200μL涂布于含25μg/mL的氯霉素的LB选择性琼脂平板放置于37℃温箱过夜培养,挑取平板上单菌落接种于500 mL,含250μg/mL氯霉素的LB液体培养基中,37℃、200 r/min摇床培养16 h。将培养16 h后的500 mL菌液用QIAGENE plasmid Midi kit试剂盒按其说明操作,中量提取BAC质粒。BACDNA的提取按照试剂盒说明书进行,将提取的大分子量BAC DNA去1μg用限制性内切酶Bam H I 1μL及Eco R I 1μL,37℃酶切2 h后做普通的电泳分析。同时PCR扩增gpt基因以及MDV毒株的meq基因、US10基因和pp38基因,相关引物见表1。50μL PCR标准反应体系具体成分:10×扩增缓冲液 5μL,dNTPs各0.8 mmol/L,引物各 0.5 μmol/L,模板 DNA 120 ng,Taq DNA 聚合酶2.5 μL,Mg2+3.2 mmol/L,用水补齐至50μL,将上述成分分别加入PCR扩增试剂到PCR管中,轻轻混和均匀后,离心后置于PCR扩增仪。按照以下扩增程序进行反应。首轮循环:95℃5 min,54℃ 1 min,72℃ 1 min;中间循环:95℃1 min,54 ℃ 1 min,72 ℃ 1 min 30 s,进行30个循环;末轮循环:95℃ 1 min,54℃ 1 min,72℃延伸10 min;末轮循环后置4℃保存。

表1 用PCR来鉴定GD0908-BAC所用的部分引物
1.6 重组病毒的拯救及间接免疫荧光试验 按照转染试剂 LipfectamineTM2000的说明,取 Qiagen Plasmid Midi Kit试剂盒提取的经鉴定的BAC DNA1μg于 100μL opti-MEM 中,取 10μL lipfectamine于100μL opti-MEM中,将两者混匀,室温放置20 min后,用opti-MEM补充至1 mL后加入6孔板中置于37℃,5%CO2细胞培养箱中培养6 h,然后将该6孔板中的液体换为含5%犊牛血清的DMEM培养基,继续培养几天,当病毒蚀斑形成后,用500μL 0.25%胰酶37℃、2 min将细胞消化,传至已长成单层的原代CEF,如此连续传34代以扩大病毒量,待扩增到一定量时,将其收获,冻存于液氮中。次日,取出1支进行病毒定量。将100 PFU病毒rGD0908株接种于6孔细胞培养板上已铺成单层的CEF中。培养3 d后,将生长液倒掉,用冷丙酮∶乙醇(3∶2)固定液固定5 min,用PBS洗1次,加0.5 mL(1∶100稀释)抗MDV抗体,放37℃温箱反应45 min后,用PBS洗3次,将水分甩干,加上FITC标记抗鼠IgG荧光抗体(sigma,按说明书配置工作浓度)0.5 mL,放37℃温箱反应45 min后,用PBS洗3次,将水分甩干,加1滴50%甘油,在倒置荧光显微镜下观察(200×)。
1.7 重组病毒体外生长特性测定 为了判定rGD0908株在细胞中的增殖速率,将GD0908株与rGD0908株按100PFU/孔的量分别接种5块铺满CEF 单层的6 孔板中,在24、48、96、120、144 h 时分别取1块6孔板,测定每孔的病毒滴度,计算平均值,绘制病毒的生长曲线,比较 GD0908株与rGD0908株在CEF上的生长速率差异。
2 结果
2.1 BAC分子克隆化病毒的鉴定结果 利用Qiagen Plasmid Midi Kit试剂盒提取rGD0908质粒,用Eco RⅠ和Bam HⅠ进行酶切,酶切结果见图2A;以rGD0908株DNA为模板,以表1中的引物进行PCR扩增,PCR扩增结果见图 2B,结果表明,以rGD0908株BAC克隆为模板,gpt基因以及GD0908株基因组中的meq、US10、pp38均获得了特异性的扩增。酶切及PCR结果证实了获得的克隆为rGD0908株阳性克隆。
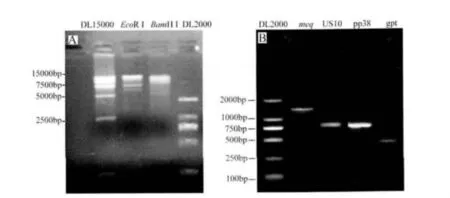
图2 鉴定GD0908株BAC质粒的结果
2.2 拯救的重组病毒鉴定 用Qiagen Plasmid Midi Kit试剂盒提取 BAC DNA,按照转染试剂LipfectamineTM2000的说明,取 1μg质粒与 10μL Lipfectamine转染CEF。转染后培养5 d出现病毒蚀斑,该传染性克隆病毒定名为rGD0908株。在接种rGD0908株的CEF单层上,用抗MDVⅠ特异血清进行IFA检测,结果呈现出显示荧光的特异性病毒蚀斑,而作为对照的没有接种MDV的CEF没有显示荧光(图3)。
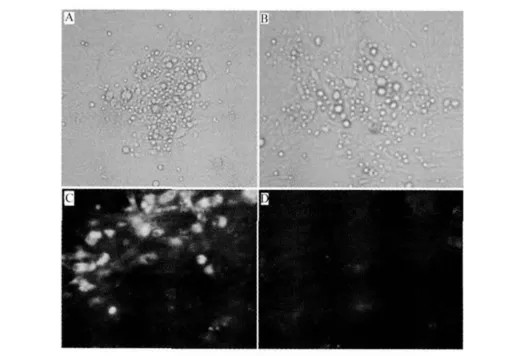
图3 重组病毒rGD0908的噬斑形态
2.3 GD0908株与rGD0908株在体外增殖能力比较 为了确定rGD0908株在体外的复制能力,利用rGD0908株与父代病毒GD0908株同时感染CEF,进行病毒生长曲线的测定,生长曲线结果显示,rGD0908株与GD0908株在体外增殖速度无显著性差异(图4)。
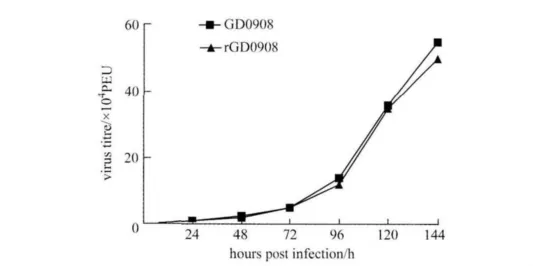
图4 GD0908株和rGD0908株在CEF上的增殖曲线
3 讨论
近50年来,对MDV的研究取得了突破性进展,在这一过程中,现有的MDV疫苗虽然很好的控制了MD的发生,但其并不能控制MDV的感染与传播(GD0908株即为CVI988疫苗免疫鸡群中分离的),还直接导致了MDV毒力的不断增强[6]。按照MDV演变规律,其毒力很有可能会在今后几年变得更强[11],如果到时没有获得有针对性的疫苗,MDV可能给养禽业带来一场新的灾难。要获得良好MD疫苗还有许多工作去做,比如,目前仍没有完全弄清哪些基因与免疫原性或毒力有关,如RLORF5 a能在肿瘤细胞系及MDV潜伏感染的QT35肿瘤细胞系中表达,但它的表达对潜伏感染和病毒复制或肿瘤转化的重新激活是非必须的[12-15];作为一个高效的疫苗,哪些基因必须表达(或敲除);另外,对MDV的先天性与获得性免疫以及疫苗的保护机理仍然没有搞清楚[16-18];同时,对介导 MDV 感染与传播的基因也需要进行深入的研究[19-20]。
由于MDV基因组比较大,一直以来,MDV的基因突变、基因缺失等分子水平上的操作比较困难,BAC技术有力的推动了MDV的基因组学研究。1997年,Messerle首次将BAC克隆及突变技术运用在基因组为220 kb的鼠细胞巨化病毒的基因上[21],成功地将传染性疱疹病毒的全基因组作为mini-F质粒克隆进大肠杆菌。2000年,BAC技术开始运用于MDV感染性克隆的构建,Schumacher等成功地获得了无致病力的584Ap80C的感染性克隆[8]。此后,国内外学者基于BAC技术构建了一系列的MDV感染性克隆,包括疫苗株及强毒株[22-25],并在此基础上对MDV进行了多个基因功能的研究(如 Meq、PP38、1.8kb mRNA、vIL -8 等)和重组疫苗的。本研究把GD0908株的基因组克隆入BAC中,自大肠杆菌中提取的BAC DNA经转染CEF后成功拯救出了重组病毒rGD0908株。拯救的病毒利用MDVⅠ特异性抗体进行IFA检测进一步证明了GD0908株的感染性克隆的成功构建。该技术允许MDV基因组以BAC形式在大肠杆菌(E.coli)中保存、增殖和引入人工突变。理论上,它允许对病毒基因组中任何基因进行各种修饰,包括基因的剪切﹑插入﹑突变﹑克隆与亚克隆等,并且操作非常方便。该技术为研究病毒的复制、生长特性、致病性、病毒与宿主之间的相互关系等提供了一个崭新而高效的手段。因此,基于BAC系统的MDV感染性克隆的成功构建使MDV分子水平上的操作变的非常简单可行,也将会极大的促进MDV分子致病机理的研究进程,同时,BAC技术也为疱疹病毒编码的microRNA 研究提供了便利[26-27],利用同源重组技术构建microRNA单基因或单基因簇敲除的毒株,可为进一步研究microRNA基因缺失对MDV的复制、致病性、致瘤性等致病表型的影响及其分子调控机制奠定良好的基础。
[1] Payne LN,Biggs PM.Studies onmarek’s disease.ii.pathogenesis[J].JNatl Cancer Inst,1967,39:281 - 302.
[2] Eidson C S,Schmittle SC.Studies on acutemarek’s disease.I.characteristics of isolate ga in chickens[J].Avian Dis,1968,12:467-476.
[3] Kawamura H,King D J,Anderson D P.A herpesvirus isolated from kidney cell culture of normal turkeys[J].Avian Dis,1969,13:853-863.
[4] Rispens B H,van Vloten H,Mastenbroek N,et al.Control of marek’s disease in the netherlands.I isolation of an avirulent marek’s disease virus(strain cvi 988)and its use in laboratory vaccination trials[J].Avian Dis,1972,16:108 -125.
[5] Schat K A,Calnek BW.Characterization of an apparently nononcogenic marek’s disease virus[J].JNatl Cancer Inst,1978,60:1075-1082.
[6] Witter R L.Increased virulence of marek’s disease virus field isolates[J].Avian Dis,1997,41:149 - 163.
[7] Haq K,Fear T,Ibraheem A,et al.Influence of vaccination with cvi988/rispens on load and replication of a very virulentmarek’s disease virus strain in feathers of chickens[J].Avian Pathol,2012,41:69 -75.
[8] Schumacher D,Tischer B K,Fuchs W,et al.Reconstitution of marek’s disease virus serotype 1(MDV -1)from dna cloned as a bacterial artificial chromosome and characterization of a glycoprotein b - negative MDV - 1 mutant[J].J Virol,2000,74:11088 -11098.
[9] Petherbridge L,Xu H,Zhao Y,et al.Cloning of gallid herpesvirus 3(marek’s disease virus serotype-2)genome as infectious bacterial artificial chromosomes for analysis of viral gene functions[J].JVirol Methods,2009,158:11 - 17.
[10] Lee L F,Liu X.Monoclonal antibodies with specificity for three different serotypes ofmarek’s disease viruses in chickens[J].J Immunol,1983,130(2):1003 -1006.
[11] Gimeno IM.Marek’s disease vaccines:a solution for today but a worry for tomorrow.[J]Vaccine,2008,26 Suppl 3:C31 - 41.
[12] Ohashi K,O’Connell P H,Schat K A.Characterization ofmarek's disease virus bam H I-a-specific cdna clones obtained from a marek’s disease lymphoblastoid cell line[J].Virology,1994,199:275-283.
[13] Peng Q,Zeng M,Bhuiyan ZA,etal.Isolation and characterization ofmarek’s disease virus(MDV)cdnasmapping to the bamhI-i2,Bam H I- q2,and Bam H I-l fragments of the MDV genome from lymphoblastoid cells transformed and persistently infected with MDV[J].Virology,1995,213:590 -599.
[14] Schat K A,Hooft van Iddekinge B J,Boerrigter H,et al.Open reading frameⅡ ofmarek’s disease herpesvirus is not essential for in vitro and in vivo virus replication and establishment of latency[J].JGen Virol,1998,79(Pt4):841 -849.
[15] Jarosinski K W,Osterrieder N,Nair V K,et al.Attenuation of marek’s disease virus by deletion of open reading frame rlorf4 but not rlorf5a[J].JVirol,2005,79:11647 -11659.
[16] Omar A R,Schat K A.Syngeneic marek’s disease virus(MDV)-specific cell-mediated immune responses against immediate early,late,and unique MDV proteins[J].Virology,1996,222:87-99.
[17] Xing Z,Schat K A.Expression of cytokine genes in marek’s disease virus-infected chickens and chicken embryo fibroblast cultures[J].Immunology,2000,100:70 -76.
[18] Levy AM,Davidson I,Burgess SC,et al.Major histocompatibility complex class I is downregulated in marek’s disease virus infected chicken embryo fibroblasts and corrected by chicken interferon[J].Comp Immunol Microbiol Infect Dis,2003,26:189-198.
[19] Schumacher D,Tischer B K,Reddy SM,et al.Glycoproteins e and iofmarek’s disease virus serotype 1 are essential for virus growth in cultured cells[J].JVirol,2001,75:11307 -11318.
[20] Tischer B K,Schumacher D,Messerle M,et al.The products of the ul10(gm)and the ul49.5 genes of marek’s disease virus serotype 1 are essential for virus growth in cultured cells[J].JGen Virol,2002,83:997 -1003.
[21] Messerle M,Crnkovic I,Hammerschmidt W,et al.Cloning and mutagenesis of a herpesvirus genome as an infectious bacterial artificial chromosome[J].Proc Natl Acad Sci U S A,1997,94:14759-14763.
[22] Petherbridge L,Howes K,Baigent S J,et al.Replication - competent bacterial artificial chromosomes of marek’s disease virus:novel tools for generation of molecularly defined herpesvirus vaccines[J].JVirol,2003,77:8712 - 8718.
[23] Cui H Y,Wang Y F,Shi X M,et al.Construction of an infectious marek’s disease virus bacterial artificial chromosome and characterization of protection induced in chickens[J].JVirol Methods,2009,156:66 -72.
[24] Sun A J,Xu X Y,Petherbridge L,et al.Functional evaluation of the role of reticuloendotheliosis virus long terminal repeat(ltr)integrated into the genome of a field strain of marek’s disease virus[J].Virology,2010,397:270 -276.
[25] Smith L P,Petherbridge L J,Baigent S J,et al.Pathogenicity of a very virulent strain of marek’s disease herpesvirus cloned as infectious bacterial artificial chromosomes[J].JBiomed Biotechnol,2011,2011:412 -829.
[26] Burnside J,Bernberg E,Anderson A,et al.Marek’s disease virus encodesmicrornas thatmap to meq and the latency-associated transcript[J].JVirol,2006,80:8778 -8786.
[27] Muylkens B,Coupeau D,Dambrine G,et al.Marek’s disease virusmicrorna designated mdv1-p re-mir-m4 targets both cellular and viral genes[J].Arch Virol,2010,11:1823 - 1837.
