鹅细小病毒VP3与禽分枝杆菌副结核亚种hsp65融合基因真核表达载体的构建及鉴定
2013-10-09姜秀云马红霞高云航徐凤宇
张 岩,姜秀云,马红霞,高云航,徐凤宇*
(1.吉林农业大学动物科技学院,长春 130118;2.吉林农业大学动物生产及产品质量安全教育部重点实验室,长春 130118;3.吉林农业大学生命科学学院,长春 130118)
小鹅瘟是由鹅细小病毒(Goose parvovirus,GPV)引起的1月龄以内雏鹅急性或亚急性败血性传染病,发病率和致死率高,是危害养鹅业的重要传染病之一,被我国列为二类动物疫病。目前,主要采用弱毒苗在产蛋前接种母鹅以及雏鹅肌注高免血清防控该病,但弱毒疫苗存在潜在返祖风险[1]。DNA疫苗等新型疫苗为传染病的预防开辟了新思路[2],但单基因的DNA疫苗激发动物机体的免疫反应一般较弱,有必要配合高效的分子佐剂使用[3]。VP3蛋白是鹅细小病毒的主要衣壳蛋白,也是主要保护性抗原;Hsp65(Heat shock protein 65)是分枝杆菌的优势抗原,也可引导与其融合表达的抗原物质在抗原递呈细胞(APC)内经MHC-I分子途径加工递呈,有效刺激 APC表达 CD86、CD80等分子,起到分子佐剂作用[4]。研究将GPV的VP3和禽分枝杆菌副结核亚种(MAP)的hsp65基因先后连接入真核表达载体pVAX1,构建了真核表达质粒pVAX1-VP3和pVAX1-hsp65-VP3,并在Vero细胞中获得表达,为Hsp65分子作为佐剂在动物医学领域的应用及GPV DNA疫苗的研制奠定了基础。
1 材料与方法
1.1 材料 Vero细胞、MAP的hsp65 PCR回收产物、pVAX1质粒、pMD18-T-VP3质粒、E.coli DH5α感受态、E.coli JM 109感受态、兔抗小鹅瘟多克隆抗体由吉林农业大学预防兽医学实验室保存。DNA凝胶纯化回收试剂盒、卡那霉素(Kan)、脂质体-2000、FITC标记的山羊抗兔IgG抗体,北京全式金生物公司;MEM细胞培养液、TBD标准胎牛血清,赛墨飞世尔生物化学制品有限公司;Trizol、RNase抑制剂、LA Taq DNA 聚合酶、dNTPs、NheⅠ、Hin d Щ、XbaⅠ、DL2000、DL5000、1 kb DNA Marker、T4 DNA 连接酶、pMD19-T质粒,宝生物工程(大连)有限公司;其他化学试剂均为分析纯。
1.2 hsp65基因和VP3基因的引物设计 根据禽分枝杆菌副结核亚种K-10株(GenBank登录号:NC_002944.2)hsp65基因序列设计特异引物P1h、P2h,两端分别加入酶切位点NheⅠ和Hin dЩ(下划线部分),P2’h的5端添加入linker序列(斜体)。
P1h5’GGCACCATGGCCAAGACAATT 3’;
P2’h5’AGAGCCTCCACC GAAGTCCATGCCACCCA 3’;
P2h5’GCGAGAGCCTCCACCGAA 3’。
根据鹅细小病毒 B株(GenBank登录号:U25749.1)、SH 株(GenBank 登录号:JF333590.1)、SYG61-41(GenBank登录号:DQ299421.1)等的VP3基因序列设计引物P1v、P2v,两端分别加入酶切位点Hin dЩ和XbaⅠ(下划线部分),P1’v的5’端添加入linker序列(斜体),引物由生物工程(上海)有限公司合成。
P1’v5’GGTGGAGGCTCTATGGCAGAGGGAGG 3’;
P1v5’TATGGTGGAGGCTCTATGGCA 3’;
P2v5’GGGTTACAGATTTTGAGTTA 3’。
1.3 VP3、hsp65基因的 PCR扩增与回收 VP3 PCR 体系:模板 1 μL,dNTPs 2.5 μL,P1’v0.5 μL,P2v0.5 μL,10 ×LA Taq buffer 2.5μL,LA Taq DNA聚合酶 0.3 μL,ddH2O 17.7 μL。
VP3基因扩增的反应条件:95℃预变性5min;94℃变性1 min,53℃退火1 min,72℃延伸2 min,共30个循环;72℃延伸10 min。
hsp65 PCR 体系:模板1 μL,dNTPs2.5 μL,P1h0.5 μL,P2’h0.5 μL,2 × LA Taq buffer 2.5 μL,LA Taq DNA 聚合酶 0.3 μL,ddH2O 17.7 μL。
hsp65基因扩增的反应条件:98℃预变性5 min;98℃变性1 min,62℃退火1 min,72℃延伸2 min,共35个循环;最后72℃延伸10 min。
扩增产物经1%琼脂糖凝胶电泳分析,用DNA凝胶纯化回收试剂盒回收。
1.4 重组表达质粒构建 将回收的hsp65、VP3片段分别与 pMD19-T载体连接,构建重组质粒pMD19-T-hsp65和 pMD19-T-VP3,送生物工程(上海)有限公司测序。
将真核表达空载体pVAX1和鉴定正确的pMD19-T-VP3用XbaⅠ和Hin dⅢ双酶切,回收后用T4DNA连接酶连接,构建pVAX1-VP3,转化至DH5α感受态中,提取质粒进行鉴定;将鉴定正确的pVAX1-VP3和pMD19-T-hsp65用NheⅠ和Hin dⅢ双酶切,回收后用T4DNA连接酶连接,构建pVAX1-hsp65-VP3,转化至 DH5α感受态中,提取质粒进行鉴定。
1.5 质粒转染 在6孔细胞培养板的底部放置盖玻片,制备Vero细胞爬片。待细胞达95%铺满盖玻片时,将重组质粒与脂质体-2000按体积比1∶4用无血清的 MEM培养基混匀后,转染细胞,置37℃ 5%CO2培养箱培养6 h。弃去转染液,更换细胞培养液,继续培养24~42 h,检测表达产物。
1.6 表达产物检测
1.6.1 间接免疫荧光鉴定 取出长满的细胞爬片,晾干后,用 pH7.2的 PBS洗涤 3次;以丙酮(10%)固定细胞3~5 min,PBS洗涤3次;加入兔抗小鹅瘟多克隆抗体(1∶5),37℃感作2 h后,PBS洗涤3次;加入FITC标记的山羊抗兔IgG抗体(1∶20),37℃感作2 h后,PBS洗涤3次,荧光显微镜下观察。
1.6.2 RT-PCR鉴定 收集转染细胞,提取细胞总RNA。以总RNA为模板,反转录合成cDNA。反应体系为:总 RNA10 μL,Oligod(T)1 μL,Rnase Inhibitor 2 μL,AMV buffer 2 μL,AMV 酶 1 μL,dNTPs 4μL。42℃ 1 h,95℃ 5 min。以 cDNA为模板,分别以 P1v、P2v和 P1h、P2h为引物,PCR 扩增,反应条件见1.3。
2 结果
2.1 VP3和hsp65基因克隆结果 经测序知分别克隆到了1635 bp(含linker)的hsp65片段和1605 bp(不含Linker序列)的VP3片段,序列分析结果表明,分别与GenBank上登录的MAP K-10株hsp65基因和GPV SYG61-41毒株的VP3基因的同源性为 99.1%和 99.63%。
2.2 重组质粒pVAX1-VP3的鉴定 重组质粒pVAX1-VP3经XbaⅠ和Hin dⅢ双酶切后,经1%琼脂糖凝胶电泳检测,可见约1.6 kb片段及3.0 kb的载体片段,经PCR可扩增出1.6 kb的VP3基因(图1),与预期结果相符。
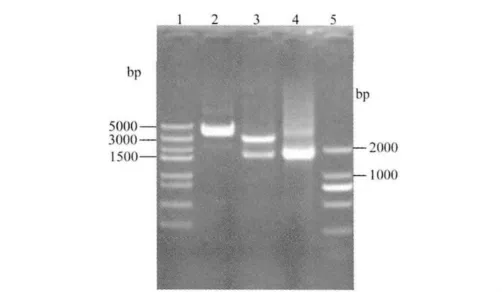
图1 真核表达载体pVAX1-VP3酶切及PCR鉴定
2.3 重组质粒pVAX1-hsp65-VP3的鉴定 重组质粒pVAX1-hsp65-VP3经HindⅢ及NheⅠ双酶切后,1%琼脂糖凝胶电泳鉴定,可见约1.6 kb及4.6 kb的DNA片段,同时可见未被切开的大小约为6.2 kb大小的DNA片段(图2)。

图2 重组质粒pVAX1-hsp65-VP3酶切及PCR鉴定
2.4 RT-PCR结果 RT-PCR扩增产物经1%琼脂糖凝胶电泳,结果如图3所示,A图中1、2泳道均为VP3基因PCR产物,B图中1泳道为hsp65基因的PCR产物。可见在1000~2000 bp间均有明显的条带,在转录水平上证实两基因在Vero细胞中获得表达。
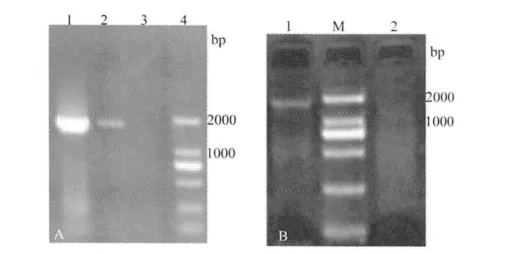
图3 真核表达载体pVAX1-hsp65-VP3和pVAX1-VP3转染Vero细胞RT-PCR检测结果
2.5 间接免疫荧光检测结果 重组质粒pVAX1-hsp65-VP3和pVAX1-VP3转染Vero细胞42 h后,经丙酮固定。将固定好的细胞爬片经间接免疫荧光检测,结果在荧光显微镜下可见细胞表面存在特异荧光,对照组pVAX1空载体转染的Vero细胞表面未见荧光(图4),进一步说明两基因获得了表达,且表达产物具有反应原性。
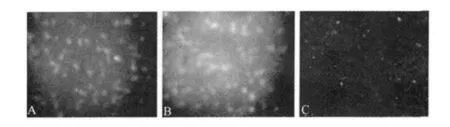
图4 真核表达载体转染Vero细胞后间接免疫荧光检测结果(200×)
3 讨论
DNA疫苗可激发动物机体的细胞和体液免疫应答,作为一种新型疫苗被广泛应用于各种传染病及肿瘤的预防制品中,新的包裹技术也正在推进其向临床应用不断迈进。
在小鹅瘟DNA疫苗的研制中,韩新锋等[5]发现,pcDNA3.1-GPV-VP3肌注小鼠和鹅后能够诱发产生抗 GPV的中和抗体;车茜等[6]构建的pcDNA-GPV-VP3能诱导雏鹅产生良好的体液免疫和细胞免疫。说明GPV的VP3蛋白可作为良好的保护性抗原,但单基因的DNA疫苗诱发的免疫反应较弱,一般配合高效的佐剂使用。Hsp65又称Cpn 60.2,是分枝杆菌热休克蛋白家族成员,其佐剂作用可能与其结构相关,因为Rohini等[7]在结核分枝杆菌Hsp65晶体结构中发现,其形成的二聚体可导致某些疏水区暴露在蛋白表面,推测与其非特异地结合抗原肽有关;王华等[8]构建的 HSP65-HBV epi融合蛋白有望成为有效的治疗性乙肝疫苗;Hsp65在癌症治疗中也发挥了一定作用,与弗氏佐剂联合给药,免疫7次后,对实验性小鼠移植黑色素瘤的抑瘤率达73.2%,可能通过介导抗体依赖性细胞毒作用杀伤肿瘤或被病毒感染的靶细胞[9]。所以本研究构建了带有MAP的hsp65基因的VP3真核表达载体。
在本研究中,扩增目的基因时应用了LA Taq DNA聚合酶,主要考虑到所扩增的hsp65基因片段GC含量高(68.1%)且稍长。另外,在实验的最初阶段,考虑应用重叠延伸PCR技术先将两基因融合在一起后再连接入真核表达载体,但多次均未能成功,推测可能与两引物的Tm值相差较多有关,因为有报道称应用该技术时待融合基因引物的Tm值最好相近或相同[10],所以改用将两基因先后连接入表达载体并连接成功。
本研究结果表明,VP3和hsp65同表达载体pVAX1分别连接后,在Vero细胞中能够表达,为探索鹅细小病毒DNA疫苗的研究奠定了基础,也为Hsp65的佐剂作用在动物医学领域中的应用奠定了基础。
[1] 敖礼林.小鹅瘟及其综合防控措施[J].福建农业,2011,19(2):36-37.
[2] 高 光,张 鑫,徐 佳,等.鹅细小病毒VP3基因真核表达载体的构建及其在Vero细胞中表达[J].中国兽医学报,2010,30(3):323-326.
[3] 侯俊玲,郑亚东,景志忠,等.DNA疫苗免疫佐剂的研究进展[J].中国兽医科技,2005,35(2):153 -156.
[4] 杨 鑫,陈福旺,宇 航,等.热休克蛋白在抗病毒免疫中作用的研究进展[C].全国动物生理生化第十二次学术交流会论文摘要汇编,畜牧与兽医,2012,44:70 -72.
[5] 韩新峰,程安春,汪铭书,等.小鹅瘟病毒VP3基因疫苗的构建及其诱导小鼠和鹅中和抗体的初报[J].高技术通讯,2008,18(5):543 -549.
[6] 车 茜.小鹅瘟病毒VP3基因疫苗诱导雏鹅细胞免疫和体液免疫的研究[D].雅安,四川农业大学,2007.
[7] Rohini Qamra,Shekhar C.Mande.Crystal structure of the 65 -kilodalton heat shock protein,chaperonin 60.2,ofmycobacte-rium tuberculosis[J].Bacteriol,2004,186(23):8105 -8113.
[8] 王 华.HSP65-HBV多表位融合蛋白乙肝治疗性疫苗的研制[D].长春,吉林大学,2006.
[9] 谢燕飞,陈 檬,彭淑红,等.重组卡介苗HSP65抑制小鼠移植黑色素瘤的初步药效学研究[J].中国生物工程杂志,2012,32(12):47-51.
[10]徐 芳,姚泉洪,熊爱生,等.重叠延伸PCR技术及其在基因工程上的应用[J].分子植物育种,2006,4(5):747 -750.
