苏丹红Ⅰ磁性分子印迹聚合物的制备及其分离分析应用
2013-10-08曾延波张祖磊陈智栋
马 洁,黄 静,曾延波,张祖磊,张 剑,陈智栋,李 蕾*
(1.常州大学 化学化工学院,江苏 常州 213016;2.嘉兴学院 生物与化学工程学院,浙江 嘉兴 314001)
分子印迹聚合物具有预定选择性、化学性质稳定、对环境的耐受性好和制备简单等优点,因此在固相萃取、传感器、催化等领域得到广泛应用[1-4]。磁性分离是在磁场的作用下依据物质的磁性差异,将磁性组分与非磁性组分分离的一种技术[5]。将磁性分离技术与分子印迹技术相结合制备的磁性分子印迹聚合物(M-MIPs),兼具分子印迹聚合物和磁性材料的特点,可选择性分离富集分析物,使之在外磁场的作用下快速与基质分离。近年来基于磁性材料的分子印迹聚合物逐渐成为研究热点。
苏丹红是一种人工合成的工业染料,国际癌症机构将其列为三类致癌物质[6],但一些不法食品企业将其作为食品色素,严重危害消费者健康。目前食品中苏丹红Ⅰ的检测方法主要有HPLC法、GCMS联用法、电化学检测法等[7-10],而这些方法大都需要繁琐的样品前处理过程。用分子印迹聚合物作为萃取材料,可简化样品前处理过程[11-14],但通常需将其离心分离或者用于填充柱,分离过程仍较繁琐,而M-MIPs在外磁场作用下可与基质快速分离,因此,M-MIPs的使用降低了样品预处理的复杂性,提高了方法的可靠性。本文以3-(异丁烯酰氧)丙基三甲氧基硅烷(MPS)修饰的 Fe3O4为磁性组分,以苏丹红Ⅰ为模板分子,甲基丙烯酸为功能单体,乙二醇二甲基丙烯酸酯为交联剂,制备了磁性分子印迹聚合物,并将其用于辣椒粉提取液中苏丹红Ⅰ的分离富集,在外磁场下实现快速分离,用甲醇洗脱,并结合液相色谱法进行检测。该方法具有操作简单、选择好、回收率高等优点。
1 实验部分
1.1 仪器与试剂
UV-2550型紫外可见分光光谱仪(日本岛津公司),Agilent 1200型高效液相色谱仪(美国安捷伦科技有限公司),NEXUS470型傅立叶变换红外光谱仪(美国热电尼高力公司),Hitachi s-4800型扫描电子显微镜(日本日立公司),JEM-200CX型透射电子显微镜(日本JEOL公司),Lake Shore 7410型振动样品磁强计(美国Lake Shore Cryotronics公司)。
FeCl3·6H2O、FeSO4·7H2O、3-(异丁烯酰氧)丙基三甲氧基硅烷(MPS)(分析纯,上海晶纯试剂有限公司);苏丹红Ⅰ、苏丹红Ⅱ、苏丹红Ⅲ、氨水、乙酸(分析纯)及甲基丙烯酸(MAA,化学纯,使用前提纯)均购于国药集团化学试剂有限公司;乙二醇二甲基丙烯酸酯(EGDMA,98%)、偶氮二异丁腈(AIBN,98%)(使用前提纯,上海百灵威有限公司);甲醇、氯仿、乙腈(分析纯);超纯水(实验室自制);辣椒粉购于当地超市。
1.2 苏丹红Ⅰ磁性分子聚合物(M-MIPs)的制备
取2 g制备的Fe3O4颗粒[15]于三口烧瓶中,加入38 mL无水乙醇和2 mL水,再加入0.4 mL MPS,超声0.5 h后,在回流温度下搅拌反应3 h[16]得到MPS修饰的Fe3O4颗粒。
取1 mmol(0.25 g)苏丹红Ⅰ溶于50 mL乙腈中,加入4 mmol(0.34 mL)MAA超声0.5 h后,加入10 mmol(1.89 mL)交联剂EGDMA、1 g MPS修饰的Fe3O4和0.1 g引发剂AIBN,N2氛围下65℃聚合反应24 h。空白印迹聚合物(M-NMIPs)的制备方法同上,只是制备过程中未加模板分子。
M-MIPs用索氏提取器抽提(抽提液为体积比为9∶1的甲醇-乙酸)直至检测不到模板分子,用甲醇洗去残留乙酸后,于60℃真空干燥过夜。
1.3 聚合物的吸附性能测试
1.3.1 静态吸附性能研究 称取20 mg M-MIPs加入到锥形瓶中,然后分别加入5 mL不同浓度(0.3~3.0 mmol/L)的苏丹红Ⅰ-乙腈标准溶液,室温振荡12 h后,用磁铁吸附M-MIPs,取清液用紫外可见分光光度法测定平衡时苏丹红Ⅰ的浓度,根据吸附前后的浓度变化,计算M-MIPs对不同浓度苏丹红Ⅰ溶液的吸附量Q,其公式为Q=(C0-Ce)V/m,其中Q为静态平衡时的吸附量(μmol/g),C0为底物的初始浓度(mmol/L),Ce为吸附平衡时清液的浓度(mmol/L),V为底物溶液的体积(L),m为磁印迹材料的加入量(g)。M-NMIPs使用上述方法测定结合量并与M-MIPs相比较。
1.3.2 选择性吸附实验 为研究聚合物的选择性,将苏丹红Ⅱ和苏丹红Ⅲ(结构式见图1)作为底物,用平衡吸附实验研究聚合物的识别性能。将20 mg M-MIPs放入5 mL分别含有1.0 mmol/L的苏丹红Ⅰ、苏丹红Ⅱ和苏丹红Ⅲ的乙腈标准溶液中,室温振荡12 h后,用磁铁吸附聚合物,取清液用紫外可见分光光度法测定平衡时底物的浓度,根据吸附前后的浓度变化,计算聚合物对3种底物的结合量,M-NMIPs使用同样方法测定。
图1 苏丹红Ⅰ、苏丹红Ⅱ和苏丹红Ⅲ的分子结构式Fig.1 Molecular structures of SudanⅠ,SudanⅡand SudanⅢ
1.4 样品加标处理及萃取过程
在1 g辣椒粉表面喷洒1 mL的苏丹红Ⅰ-乙腈溶液(加标浓度为1.5~60 μg/g),静置过夜后,用5 mL乙腈超声提取10 min,离心取上清液,残渣再重复提取2次,合并提取液。
将60 mg M-MIPs加入到提取液中,振荡吸附12 h后用强磁铁将吸附剂与清液分离。用2 mL甲醇溶液对吸附剂超声洗脱,洗脱液经0.45 μm有机滤膜过滤后,再使用高效液相色谱进行检测,计算回收率。
色谱条件:Agilent 1200 HPLC系统包括G1322A脱气机,G1311A四元泵,G1316A柱保温箱,G1315D二极管阵列检测器,G1329A进样器。色谱柱:反相Extend-C18柱(5 μm,250 mm×4.6 mm),柱温:35℃;流动相:50%甲醇水溶液-色谱纯甲醇(10∶90);检测波长:478 nm;流速:1.0 mL/min;进样体积:10 μL。
2 结果与讨论
2.1 磁性分子印迹聚合物的制备
本文利用MPS修饰的Fe3O4粒子为磁性组分,制备了苏丹红Ⅰ的磁性分子印迹聚合物,具体制备路线及应用如图2所示。

图2 苏丹红ⅠM-MIPs的制备与应用过程Fig.2 Schematic diagram of the fabrication and application process of SudanⅠM-MIPs
2.2 红外光谱分析
图3是各‖种聚合物的红外表征图谱。2 919 cm-1和2‖ 857 cm-1是饱和C—H的伸缩振动峰,1 750 cm-1是MPS中CO的伸缩振动峰,1 620 cm-1为MPS中CC双键的伸缩振动峰,1 123 cm-1为MPS中Si—O键的伸缩振动峰,580 cm-1处为Fe3O4中Fe—O键的特征吸收峰。对比曲线a、b可知MPS已经成功结合到Fe‖3O4粒子的表面[16-17]。M-MIPs曲线(c)中,1 460、1 390 cm-1处是甲基的面内弯曲振动峰,聚合物中CO的振动峰(1 732 cm-1)显著增强。

图3 Fe3O4纳米颗粒(a)、MPS修饰的Fe3O4(b)和M-MIPs(c)的红外光谱图Fig.3 FT-IR spectra of Fe3O4nanoparticles(a),Fe3O4modified with MPS(b)and M-MIPs(c)
2.3 磁性分子印迹聚合物的形貌结构分析
用扫描电镜/透射电镜(SEM/TEM)对各磁性微球的形貌结构进行分析。由图4A中Fe3O4的SEM/TEM图可以看到,用共沉淀法制备的Fe3O4磁性颗粒呈规则的球形结构,且粒径比较均匀。由图4B可以看到,由于在MPS修饰的Fe3O4微球表面进行印迹聚合作用,使得部分M-MIPs微球稍有粘连现象;从M-MIPs的TEM图可以看到,其外壳薄膜厚度较大,这是由于聚合反应过程中参与反应的有机物的量很多,从而导致聚合物的有机物层变厚[18],说明已成功制备得到M-MIPs。
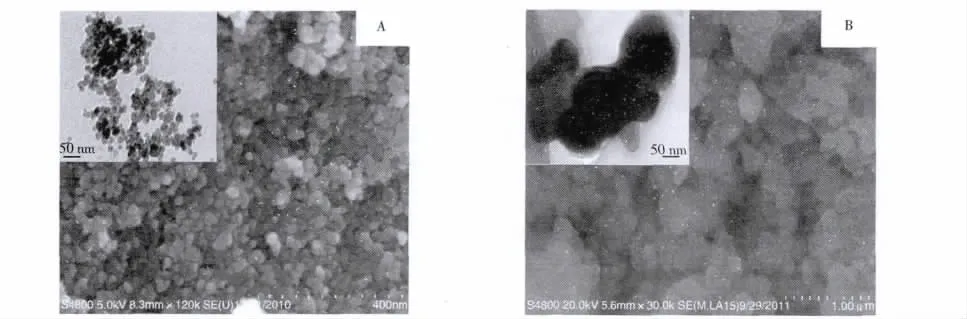
图4Fe3O4纳米颗粒(A)及M-MIPs(B)的TEM/SEM图Fig.4 TEM/SEM images of Fe3O4nanoparticles(A)and M-MIPs(B)
2.4 磁性分子印迹聚合物的磁性能表征
考察了几种材料的常温磁滞回归曲线(见图5A)。由图可知,由于Fe3O4颗粒表面包裹物的增加,Fe3O4颗粒、MPS修饰的Fe3O4、M-MIPs的饱和磁化强度依次降低。图5B中左侧为MMIPs的分散液,右侧为在外磁场下M-MIPs的分散液,可以看出M-MIPs具有良好的磁性能,在强磁铁的作用下,分散了M-MIPs的溶液立刻澄清,表明M-MIPs可满足磁分离需求。

图5 几种材料的常温磁滞回归曲线(A)及M-MIPs在外磁场下的分离示意图(B)Fig.5 The magnetization curves of several materials(A)and the separation process of M-MIPs in the presence of an external magnetic field(B)a.Fe3O4nanoparticles,b.Fe3O4modified with MPS,c.M-MIPs
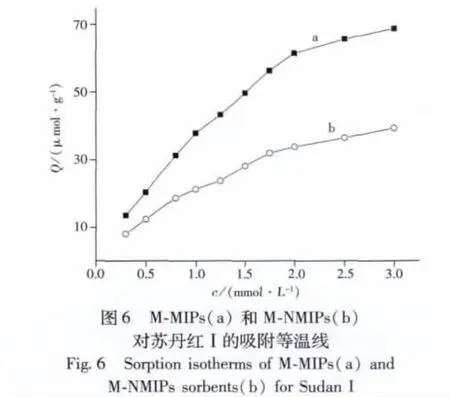
2.5 吸附等温线
采用静态平衡法,测定了印迹聚合物和非印迹聚合物对不同浓度苏丹红Ⅰ的吸附等温线(见图6)。

分子印迹聚合物的结合特性常用Scatchard模型[19]来评价:Q/Ce=(Qmax-Q)/Kd,式中Kd是平衡离解常数,Qmax和Q分别为M-MIPs对苏丹红Ⅰ的最大吸附量和理论平衡吸附量(μmol/g)。
以Q/Ce对Q作图即得 Scatchard曲线(图7),M-MIPs对苏丹红Ⅰ的吸附作用并非完全等价,而是存在两类不同的结合位点。将图中线性较好的两个部分分别进行拟合,得到拟合线性方程:Q/Ce=-1.127Q+95.33(r=0.977 8)和Q/Ce=-0.308Q+64.83(r=0.998 8)。由线性方程的斜率和截距可以求得Kd1=0.89 mmol/L,Kd2=3.25 mmol/L,Qmax1=84.59 μmol/g,Qmax2=210.49 μmol/g;M-NMIPs的 Scatchard 曲线则是一条线性相关曲线,表明M-NMIPs的结合位点各向同性,所以只能形成一种非选择性的结合位点。
2.6 选择性吸附
采用静态平衡法研究了聚合物对苏丹红Ⅰ、Ⅱ、Ⅲ的选择吸附性,并根据公式:KD=Qe/Ce计算出对应的分配系数KD及相对选择系数k(见表1)。式中KD为分配系数(L/g),Qe为平衡吸附量(μmol/g),Ce为吸附液中结构类似物的平衡浓度;k=KD(template)/KD(analogue)[20]。
由表1可以看出M-MIPs对苏丹红Ⅰ的KD最大且明显高于M-MIPs对其他两种物质的KD,表明其对苏丹红Ⅰ的吸附能力最强,而M-NMIPs对3种结构类似物的KD较小且相差不大,表明其对3种物质的吸附能力较低且相差不大;M-MIPs对苏丹红Ⅰ/苏丹红Ⅱ、苏丹红Ⅰ/苏丹红Ⅲ的k分别为2.47、2.24,明显高于M-NMIPs对应的k,表明M-MIPs对苏丹红Ⅰ选择性较好。这是因为在M-MIPs中形成了与苏丹红Ⅰ空间结构和结合位点相匹配的空穴,而M-NMIPs由于其功能团的分布是无序的,未能形成与苏丹红Ⅰ互补的识别位点,对苏丹红Ⅰ不具特异选择性。

表1 聚合物的KD及k值Table 1 KDand kvalues of the polymers
2.7 方法的标准曲线与检出限
按照“1.4”的色谱条件进行测定,以峰面积A对浓度C进行线性回归分析。在加标浓度1.5~40 μg/g范围内,苏丹红Ⅰ峰面积 (A)与浓度(C)呈良好的线性关系,其线性回归方程为A=3.533C-6.024,相关系数(r)为0.989,方法的检出限(S/N=3)为0.50 μg/g。
2.8 辣椒粉提取液中苏丹红Ⅰ的测定
按照“1.4”方法用苏丹红Ⅰ M-MIPs和M-NMIPs分别对加标辣椒样品(加标浓度分别为2.4、4.8、19.2 μg/g)进行萃取处理,HPLC法测定。由表2可知,M-MIPs对应的回收率为78%~103%,相对标准偏差为2.8%~5.8%,其回收率明显高于M-NMIPs的回收率(8%~27%),表明M-MIPs对苏丹红Ⅰ有特异识别性。

表2 实际样品中苏丹红Ⅰ的测定(n=3)Table 2 The detection of SudanⅠin paprika sample(n=3)
用 M-MIPs和 M-NMIPs对添加19.2 μg/g和未添加苏丹红Ⅰ的辣椒粉进行萃取,以富集后液相峰面积与富集前液相峰面积之比计算得M-MIPs的富集倍数约为6,图8为样品的HPLC色谱图。由图可以看出,实际样品中无苏丹红Ⅰ。
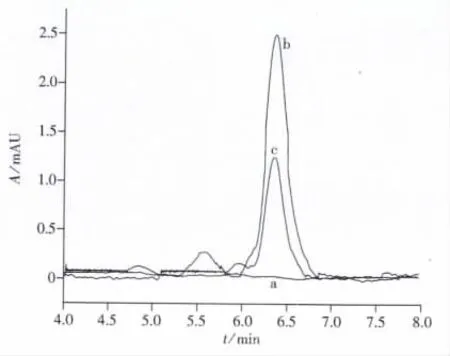
图8 辣椒粉样品(a)及加标辣椒粉样品(b、c)经吸附萃取后洗脱液的HPLC色谱图Fig.8 HPLC chromatograms for paprika samples(a)and spiked paprika samples(b,c)after extraction a,b:extracted with M-MIPs,c:extracted with M-NMIPs;spiked concentration of Sudan Ⅰ:19.2 μg/g
3 结论
本文以MPS修饰的Fe3O4为磁性组分,苏丹红Ⅰ为模板分子,甲基丙烯酸为功能单体,乙二醇二甲基丙烯酸酯为交联剂,制备了磁性分子印迹聚合物。结合实验表明该磁性印迹聚合物对苏丹红Ⅰ有较高的选择性和吸附性。将该磁性印迹聚合物用于辣椒粉提取液中苏丹红Ⅰ的分离富集,用磁铁将其与溶液快速分离,并经高效液相色谱测得样品的回收率为78%~103%,相对标准偏差为2.8%~5.8%。
[1] Carolina Q M,Claude B,Ana M G C.Food Chem.,2012,135(2):775-779.
[2] Zhang H B,Zhang Z H,Hu Y F,Yang X,Nie L H.Chem.J.Chin.Univ.(张华斌,张朝晖,胡宇芳,杨潇,聂利华.高等学校化学学报),2010,31(11):2141-2147.
[3] Wu B,Wang Z H,Zhao D X,Lu X Q.Talanta,2012,101:374-381.
[4] Abbate V,Bassindale A R,Brandstadt K F,Taylor P G.J.Catal.,2011,284(1):68 -76.
[5] Zeng H,Sun S H.Adv.Funct.Mater.,2008,18(3):391 -400.
[6] Stiborova M,Martinek V,Rydlova H,Hodek P,Frei E.Cancer Res.,2002,62(20):5678-5684.
[7] He R,Liao L C,Yan Y Y,Yang L,Chen L L,Jin S J,Li W J,Huang L Y.J.Instrum.Anal.(何荣,廖林川,颜有仪,杨林,陈礼莉,金圣杰,李雯佳,黄璐瑶.分析测试学报),2008,27(7):751-754.
[8] He L M,Su Y J,Fang B H,Shen X G,Zeng Z L,Liu Y H.Anal.Chim.Acta,2007,594(1):139-146.
[9] Xie X Y,Luo H Q,Li N B.Chin.J.Anal.Chem.(谢学英,罗红群,李念兵.分析化学),2009,37:E058.
[10] Luo S X,Dai X R,Wu Y H,Lu H Y.J.Instrum.Anal.(罗宿星,代小容,伍远辉,卢恒一.分析测试学报),2012,31(12):1562-1566.
[11] Qiao F X,Geng Y R,He C Q,Wu Y P,Pan P Y.J.Chromatogr.B,2011,879(27):2891-2896.
[12] Yan H Y,Qiao G D,Pei Y N,Long T,Ding W,Xie K.Food Chem.,2012,132(1):649-654.
[13] Xin J H,Zhao D Y,Zhang L M,Xu Z X,Zhou J,Qu D J.Chromatographia,2011,73(3/4):235 -242.
[14] Zhang Z H,Liu L,Zhou H Y,Nie L H.J.Instrum.Anal.(张朝晖,刘丽,周慧圆,聂丽华.分析测试学报),2010,29(2):136-141.
[15] Abareshi M,Goharshadi E K,Zebarjad S M,Fadafan H K,Youssefi A.J.Magn.Magn.Mater.,2010,322(24):3895-3901.
[16] Gai Q Q,Qu F,LiuZ J,Dai R J,Zhang Y K.J.Chromatogr.A,2010,1217(31):5035 -5042.
[17] Cui S,Shen X D,Lin B L.Rare Metals,2006,25:426 -430.
[18] Ji Y S,Yin J J,Xu Z G,Zhao C D,Huang H Y,Zhang H X,Wang C M.Anal.Bioanal.Chem.,2009,395(4):1125-1133.
[19] Zhou J,He X W.Anal.Chim.Acta,1999,381(1):85.
[20] Han D M,Fang G Z,Yan X P.J.Chromatogr.A,2005,1100(2):131-136.
