经内镜黏膜下剥离术与黏切除术治疗胃部早期病变的临床疗效观察
2013-10-08陈桂权张志坚程树红刘宇虎陈孟君黄妙兴
陈桂权,张志坚,程树红,刘宇虎,陈孟君,黄妙兴
(东莞市人民医院,广东 东莞 523000)
早期胃癌(Early gastric carcinoma,ECG)是局限于黏膜或黏膜下层的癌变,且不考虑是否出现淋巴结转移。有研究报道,日本40%~60%的胃癌是在早期阶段被发现的[1-2],而国内目前早期胃癌的诊断率还不足两成[3]。依据2010年第4版消化系统肿瘤WHO分类方法,上皮内瘤变通常用来描述表现为细胞学和组织结构改变的病变,相当于重度不典型增生和原位癌[4]。
内镜下黏膜切除术(Endoscopic mucosal resection,EMR)是治疗早期胃癌的方法之一[5]。根据日本胃癌协会制定的治疗指南[6],EMR被推荐用于治疗直径小于20 mm并无淋巴结转移的早癌;对于直径大于20 mm并无淋巴结转移的早癌,推荐整块切除,因为分次切除的局部复发率要高于整块切除,但因为技术及病变本身的原因,EMR很难做到这点[7]。
内镜下黏膜剥离术(Endoscopic submucosal dissection,ESD)是一种不依赖套扎达到黏膜及黏膜下层剥离的新技术,有较高的整块切除率,目前也是治疗胃早期病变的方法之一[8];关于ESD和EMR的对比研究,国外如日本等已有多中心、大样本的回顾性研究[8-10]。然而,ESD技术在国内引进只是近十年的事,这方面的报道还相对缺乏,本文基于我院的相关资料,具体探讨这两种内镜技术的优缺点。
1 资料与方法
1.1 一般资料 选择2008年1月至2009年6月在我院确诊为早期胃癌及高级别上皮内瘤变并经EMR治疗的患者39例,2009年我院开始引进并展开ESD技术,纳入2009年6月至2011年1月在我院确诊为早期胃癌及高级别上皮内瘤变并经ESD治疗的患者45例。其中EMR组男性20例,女性19例,年龄(34±7.9)岁,病变大小≤10 mm者22例,11~20 mm者12例,≥21 mm者5例;病变位置:胃窦24例,胃角12例,胃体3例;病理分型:高分化17例,中分化10例,低分化8例,乳头状腺癌等其他类型4例;深度:黏膜层22例,黏膜下层17例;伴发溃疡:(+)11例,(-)28例。ESD组男性25例,女性20例,年龄(35±8.2)岁;病变大小;≤10 mm者26例,11~20 mm者13例,≥21mm者6例;病变位置:胃窦27例,胃角14例,胃体4例;病理分型:高分化29例,中分化12例,低分化9例,乳头状腺癌等其他类型5例;深度:黏膜层25例,黏膜下层20例;伴发溃疡:(+)9例,(-)36例;差异无统计学意义(P>0.05),具备可比性。患者均签订知情同意书。
1.2 ESD和EMR治疗的适应证及具体操作 本研究纳入ESD和EMR治疗的适应证参照日本内镜胃癌协会(The Japanese Gastric Cancer Association,JGCA)的扩大的标准 :⑴不同分化类型的胃早期病变。⑵病变无淋巴管或静脉侵袭。⑶无伴发溃疡的黏膜层病变,不管其病灶体积大小;伴发溃疡的黏膜层病变,体积≤30 mm;侵及黏膜下层的微小病灶≤30 mm。ESD和EMR具体操作参照国内推荐的方法[12],术后均密切观察生命体征,禁食、补液、抑酸、抗感染、止血等治疗,必要时停留胃管胃肠减压。
1.3 相关的观察指标[13]⑴整块切除:内镜视野下通过一次性电切或剥离移除整个病灶;⑵完全切除:肿瘤整块移除,且经病理证实在其水平及垂直边缘无癌组织;⑶不完全切除:相对于完全切除,并且分次切除均被认为是不完全切除;⑷术中出血:需内镜止血治疗,如钛夹或喷洒止血药物;⑸术后出血:需输血或手术干预,或术后血红蛋白水平下降2 g/dl;(6)穿孔:通过术后内镜下诊断或立卧位腹平片出现膈下游离气体。
1.4 随访及复发 所有患者治疗后随访时间均为1年:根据不同的切除类型:完全切除的患者,术后12个月后复查一次内镜;不完全切除的患者,术后3个月、12个月复查内镜,如果有必要需结合EUS或CT检查[13];局部复发的标准[13]:治疗部位出现任何损害均需通过病理确认方可认为是局部复发。
1.5 统计学方法 应用SPSS16.0软件包进行统计分析,计量资料表示为均数±标准差(±s),组间比较采用卡方检验,P<0.05为差异有统计学意义。
2 结果
2.1 EMR和ESD整块切除和完全切除的比较分析 在未伴发溃疡的情况下,不论病灶大小,ESD组整块切除率和完全切除率均明显高于EMR组(P<0.01),在伴发溃疡的情况下,不论病灶大小,组间差异无统计学意义(P>0.05),见表1和表2。
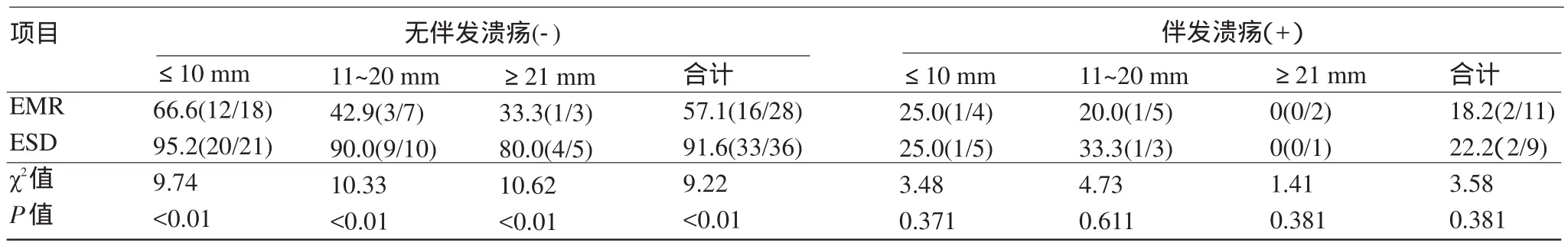
表1 EMR和ESD整块切除率比较[%(n1/n2)]
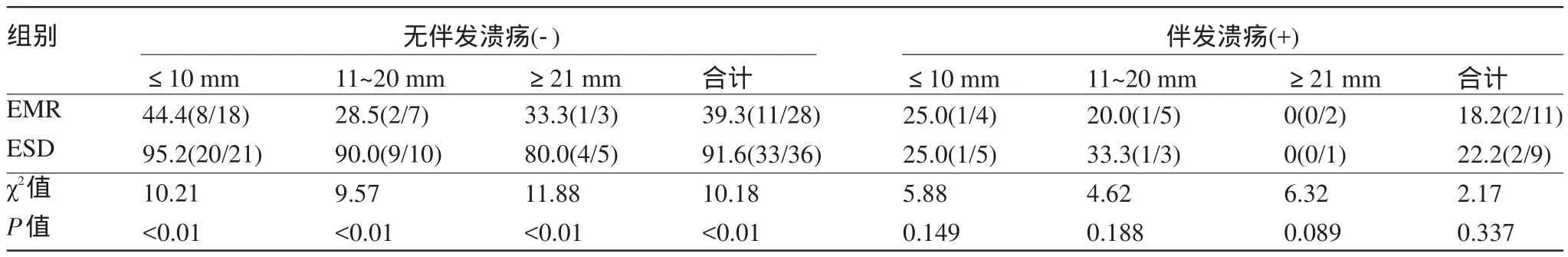
表2 EMR和ESD完全切除率比较[%(n1/n2)]
2.2 EMR和ESD手术时间及并发症的对比分析 不论病灶大小及是否伴发溃疡,ESD组的平均手术时间均远长于EMR组(P<0.05),且ESD组的术中出血率明显高于EMR组(P<0.05),但术后出血组间差异无统计学意义(P>0.05);只有在伴发溃疡的情况下,ESD组发生穿孔的风险性才高于EMR组(P<0.05),见表3和表4。
2.3 EMR和ESD术后1年的复发率的对比分析 EMR组和ESD组术后1年随访资料显示:ESD组无论是整块切除还是分次切除,复查胃镜均无复发,而EMR术后患者分次切除复发率明显高于整块切除,也明显高于ESD组(P<0.05),其中EMR在≥21 mm病灶中整块切除后复发率为100%,因为只有1例患者,所以此数据并不能反映真实情况,见表5。
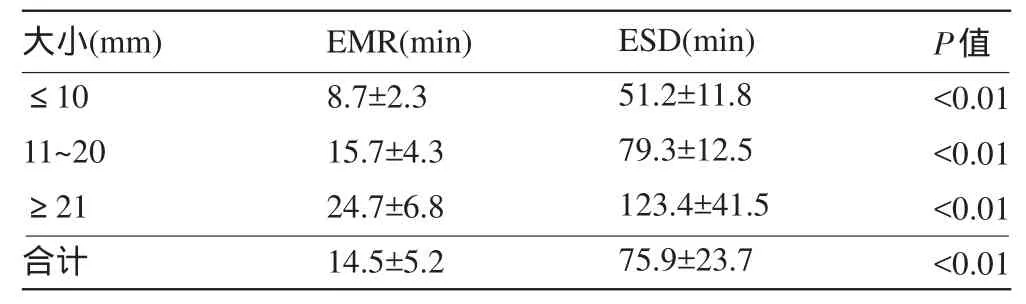
表3 ESD和EMR的平均手术时间比较(x±s)

表4 ESD和EMR并发症比较[%(n1/n2)]
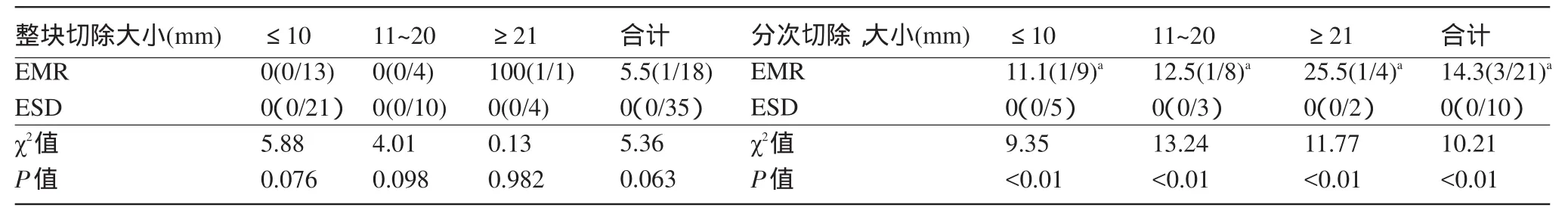
表5 EMR和ESD术后1年的复发率比较[%(n1/n2)]
3 讨论
胃癌是消化系统常见的恶性肿瘤之一,最新的全球流行病学资料显示,胃癌每年的发病率和病死率均位居所有肿瘤的前5位[14]。所以对于胃癌的早期诊断和早期治疗尤为重要,有研究报道,日本40%~60%的胃癌是在早期阶段被发现的[1-2]。而国内目前早期胃癌的诊断率还不足一成[3]。而高级别上皮内瘤变也被认为是发展为浸润癌的一个过渡阶段[15]。随着内镜技术的发展,胃早期病变的手术治疗正逐步被内镜下治疗(Endoscopic resection,ER)所取代,而ER包括EMR和ESD,这两种治疗手段各有所长[7-8]。EMR对于直径小于20 mm的病灶有着良好的治疗效果,手术时间短,创伤小及并发症较少,但是对于较大病灶分次切除存在局部高复发的风险性[7]。ESD是一种不不依赖套扎达到黏膜及黏膜下层剥离的新技术,有较高的整块切除率[8]。我们的研究资料表明:在未伴发溃疡的情况下,不论病灶大小,ESD整块切除率和完全切除率均明显高于EMR(P<0.01),且切除率在90%以上;在伴发溃疡的情况下,不论病灶大小,组间比较差异无统计学意义(P>0.05),可见溃疡是影响ESD整块切除的一个重要的影响因素。但Miyamoto等[10]研究发现病灶的大小及位置亦是影响整块切除成功率的重要影响因素。
内镜下治疗最常见的并发症是出血和穿孔。本研究中,ESD术中出血及穿孔的发生率显著高于EMR,Makuuchi等报道,在所有的EMR病例中,约1.6%的患者出现出血。在ESD病例中,文献报道的出血发生率为7%~38%[15],可见我们的报道与目前的研究是有一致性的。而且在实际工作中,即使是喷射状出血亦可以在内镜下止住,没有一个患者需要外科手术止血。同时我们还发现,溃疡是ESD治疗中穿孔发生率的最重要的影响因素。不过本研究中穿孔多发生于刚开始做ESD的病例中,可能与我们缺乏经验也有一定的关系。在治疗后随访的1年当中,ESD术后患者均无局部复发,而EMR术后患者局部复发率明显高于ESD组,并且EMR组分次切除局部复发率明显高于整块切除(P<0.05),可见ESD对胃早期病变的患者后期预后更加有益,不过本研究随访时间较短,并且未作相关的生存分析,后期还需更大样本量,多中心、长时间的随访来支持研究结果。
[1].Ikeda Y,Mori M,Koyanagi N,et al.Features of early gastric cancer detected by modern diagnostic technique[J].Clin Gastroenterol,1998,27:60-62.
[2]Shimizu S,Tada M,Kawai K.Early gastric cancer:its surveillance and natural course[J].Endoscopy,1995,27:27-31.
[3]孙远杰,柳 燕,鲍晓蕾,等.早期胃癌序贯筛查的流行病学结果分析[J].中国临床研究,2007,56(4):453-457.
[4]Besman FT,Carneiro F,Hruban RH,et al.World Health Organization Classification of Tummours of the Digestive System[M].Lyon:IARC Press,2010:2.
[5]Soetikno RM,Gotoda T,Nakanishi Y,et al.Endoscopic mucosal resection[J].Gastrointest Endosc 2003,57(2):567-579.
[6]Nakajima T.Gastric cancer treatment guidelines in Japan[J].Gastric Cancer,2002,5:1-5.
[7]Nakamura N,Akamatsu T,Yokoyama T,et al.Treatment for post-EMR remnant lesions:limitation of endoscopic retreatment[J].Stomach Intestine,2002,37:1195-1200.
[8]Hirasaki S,Tanimizu M,Moriwaki T,et al.Efficacy of clinical pathway for the management of mucosal gastric carcinoma treated with endoscopic submucosal dissection using an insulation-tip diathermic knife[J].Intern Med,2004,43:1120-1125.
[9]Yahagi N,Fujishiro M,Kakushima N,et al.Endoscopic submucosal dissection for early gastric cancer using the tip of an electrosurgical snare(thin type)[J].Dig Endosc,2004,16:34-38.
[10]Miyamoto S,Muto M,Hamamoto Y,et al.A new technique for endoscopic mucosal resection with an insulated-tip electrosurgical knife improves the completeness of resection of intramucosal gastric neoplasms[J].Gastrointest Endosc,2002,55:576-581.
[11]Torii A,Sakai M,Kajiyama T,et al.Endoscopic aspiration mucosectomy as curative endoscopic surgery,analysis of 24 cases of early gastric cancer[J].Gastrointest Endosc,1995,42:475-479.
[12]杨建明.消化道肿瘤的内镜下粘膜切除术治疗[J].重庆医学,2003,32(9):1178-1180
[13]Shiro Oka,MD,Shinji Tanaka,e al.Advantage of endoscopic submucosal dissection comparedwith EMR for early gastric cancer[J].Gastrointest Endosc,2006,64(6):877-833.
[14]Ahmedin Jemal,Freddie Bray,Melissa M,e al.Global cancer statistics[J].CACancer J Clin,2011 61:69-90.
[15]Fujisaki J,Matsuda K,Tajiri H.Endoscopic mucosal resection for early gastric cancer:aiming at safety,speed,and reliability[J].Dig Endosc,2003,15:8-11.