天然产物在不对称催化中的应用研究进展
2013-10-08陈卫红
陈卫红 石 浩
(浙江工业大学药学院,浙江 杭州 310014)
0 前言
不对称催化是获得光学纯化合物最有效的方法之一,由于其是一个手性增量的过程,使用少量手性配体或手性修饰剂即可获得大量手性化合物,因而被广泛应用。近年来不对称催化反应迅速发展,一些典型的反应已经应用到工业化中。然而多数手性催化剂转化率较低,稳定性不高,难以回收和重复使用,没有广泛适用的万能手性催化剂。因此,如何设计合成高效、新型的手性催化剂,提高手性催化剂的选择性和稳定性是该研究领域面临的挑战。
天然产物具有价廉、易得、稳定等特点,再加上其本身通常含有多个手性中心,结构易修饰,可通过化学反应合成多个手性化合物。因此,以其为手性前体合成手性催化剂的研究越来越受到人们的关注,并取得了一定的进展。本文就近年来以天然产物为手性前体进行结构改造合成的手性催化剂及其在不对称反应中的应用作一综述。
1 天然产物衍生的手性催化剂
1.1 生物碱衍生的手性催化剂
金鸡纳生物碱是一类光活性天然生物碱,其廉价易得,在不对称催化反应中有较高的立体选择性。因此由天然金鸡纳碱衍生的手性催化剂被广泛应用。
2006年,Tillman等[1]在金鸡纳生物碱结构中引入硫脲基团,催化丙二酸酯与N保护亚胺的不对称Mannich反应(fig.1)。研究表明该反应催化得到的β-氨基酯,其收率可达95%,最高ee值达99%。

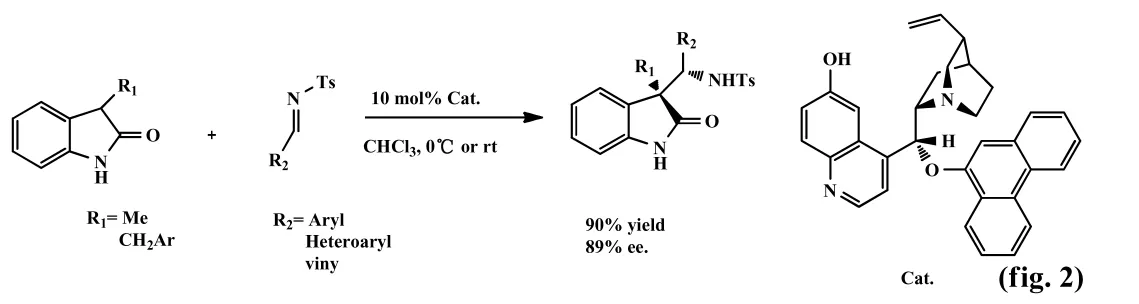
2009年,Cheng等[2]用经过修饰的金鸡纳碱催化2-氧代吲哚和N-Ts保护的芳基醛亚胺的不对称Mannich反应(fig.2)。研究表明该反应催化得到含有季碳手性中心的反式3,3-二取代-氧代吲哚衍生物,其收率可达90%,ee值达89%。
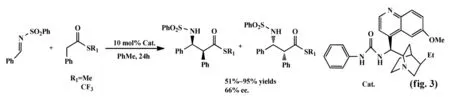
2010年,Kohler等[3]报道基于金鸡纳生物碱合成的氨基尿素类的催化剂,催化苯乙酸硫酯和苯磺酰基保护的醛亚胺的不对称Mannich反应(fig.3)。研究表明该反应的收率可达95%,非对映选择性最高可达97:3,但对映选择性相对较差,最高ee值为66%。
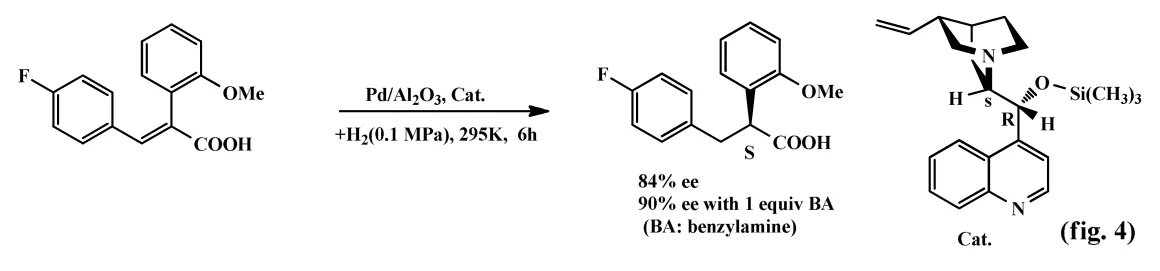
此外,可在金鸡纳生物碱的9-羟基上引入酯、氨基和膦等基团制备相应催化剂。2012年,Szollos等[4]在9-羟基上引入甲基硅醚等基团,催化二苯基肉桂酸在Pd/Al2O3下的不对称羟基化反应(fig.4)。研究表明该催化剂在苄胺存在下具有较高对映选择性,最高ee值可达90%。
1.2 氨基酸衍生的手性催化剂
氨基酸是天然存在的手性源中最重要的一类,其L构型的氨基酸在自然界中存在广泛,便宜易得。同时氨基酸含有的各种侧链基团结构易于调节,可设计性强,分子中含有的羧基和氨基,可以在保持手性的基础上合成出其它手性配体。然而氨基酸在大多数溶剂中溶解性较低,这就促成天然手性氨基酸的衍生物合成并被广泛用于催化各种不对称反应中。
2005年,Pelagatt等[5]以一系列的天然氨基酸(丙氨酸、缬氨酸、苯丙氨酸、异亮氨酸)的酰胺作为配体形成Ru(II)金属络合物,在KOH的存在下催化苯乙酮的不对称转移氢化反应(fig.5)。研究发现苯丙氨酸酰胺配体的金属络合物具有很好的催化活性,其收率可达97%,但对映选择性相对较差,最高ee值达30%。

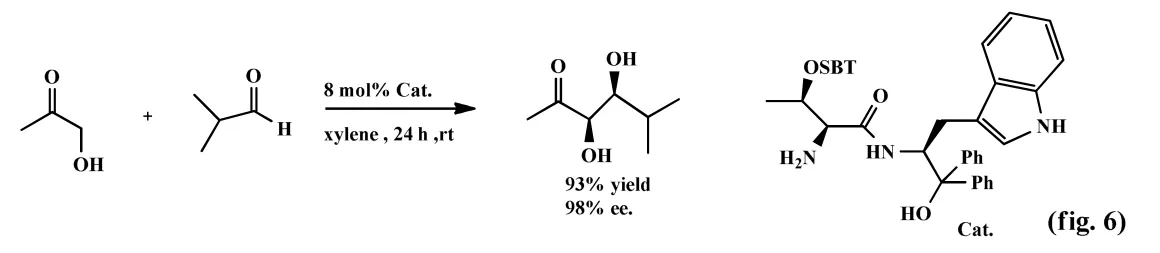
2008年,Wu等[6]以L-苏氨酸和L-亮氨酸为原料合成手性催化剂,催化不对称羟醛缩合反应(fig.6)。研究表明该类催化剂催化的丙酮醇和脂肪醛的缩合反应具有较好的产率和对映选择性,其收率可达93%,ee值达98%。而在催化丙酮醇和芳香醛的羟醛缩合中其对映选择性相对较低。
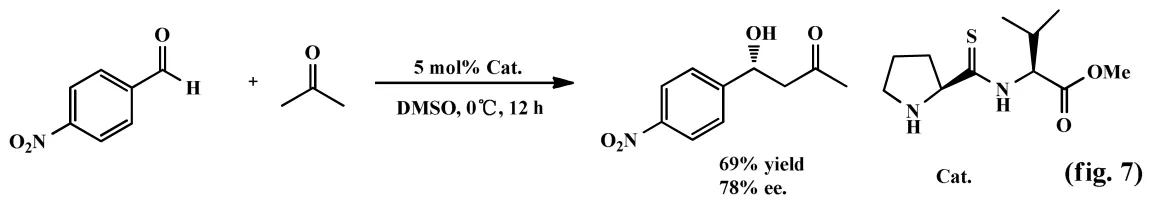
2009年,Wang等[7]以脯氨酸和缬氨醇为原料合成脯氨酸的硫代酰胺衍生物类催化剂,催化各种醛和酮、环己酮或环戊酮分子之间的Aldol反应(fig.7)。研究表明该反应其收率达69%,ee值达78%。
此外,Ahlford等[8]合成氨基酸酰肼配体和[RhCl2Cp*]2原位生成的催化剂催化苯乙酮的不对称氢转移反应(ATH)(fig.8)。研究表明该催化剂是获得手性醇的重要方法之一,在室温下反应2 h后反应的转化率为56%,ee值达91%。

1.3 糖类衍生的手性催化剂
糖类化合物具有天然手性结构,价廉易得,且糖环上的多个羟基容易被修饰,因此可通过多种直接有效的方法合成手性催化剂,并应用于不对称反应中。目前,木糖、甘露糖、果糖、阿洛糖、葡萄糖等糖类化合物在催化不对称合成方面的研究进展十分迅速。
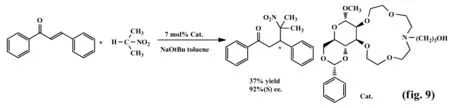
2005年,Peter等[9]以甘糖露为骨架合成甘糖露冠醚作为相转移催化剂,催化硝基丙烷和查尔酮的不对称Michael加成反应(fig.9)。研究表明该类催化剂具有较好的不对称相转移催化性能,其收率达37%,最高ee值可达92%。

2005年,Daniel等[10]报道由葡萄糖衍生的含氮化合物为配体,在Zn(OTf2)存在下催化醛炔化的加成反应(fig.10)。研究表明该催化剂在适宜的条件下具有较好的催化性能和对应选择性,其最高收率可达95%,ee值达97%。
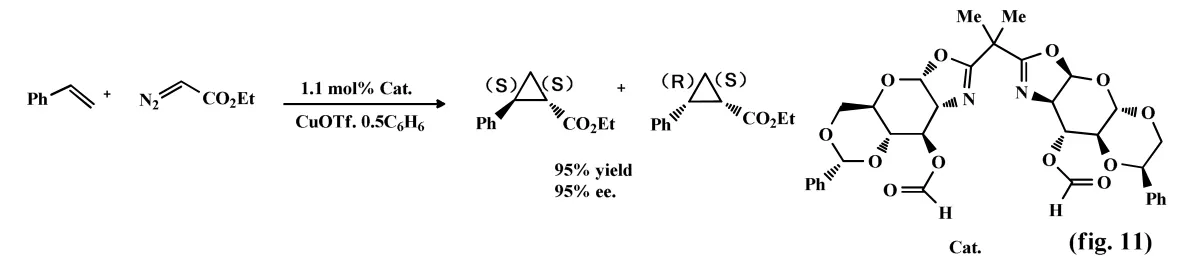
2010年,Tobias等[11]首次报道了以氨基葡萄糖为起始原料,经四步反应获得基于葡萄糖骨架衍生的手性双噁唑啉配体,该配体形成的铜化合物已被应用于催化苯乙烯的不对称环丙烷化反应中(fig.11)。研究表明该催化剂具有较高收率,最高可达95%,其ee值达95%。

2011年,Alessandra等[12]从廉价易得的手性葡萄糖出发设计合成了手性硫脲催化剂,并成功应用到乙酰丙酮与硝基苯乙烯的不对称Michael加成反应中(fig.12)。研究表明该催化剂催化的收率达27%,ee值达55%。
1.4 萜类衍生的手性催化剂
萜类化合物由于其本身特殊的结构骨架和多个手性中心,可通过多种结构修饰合成手性催化剂并应用于不对称催化反应中。
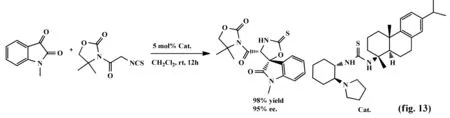
2009年,王锐等[13]首次合成由松香衍生的双功能氨基硫脲催化剂,催化不对称azaaza-Henry反应(fig.13)。研究表明该反应可以原位合成N-氨基甲酸酯亚胺类化合物,具有较高的对映选择性,其收率达98%,ee值达95%。
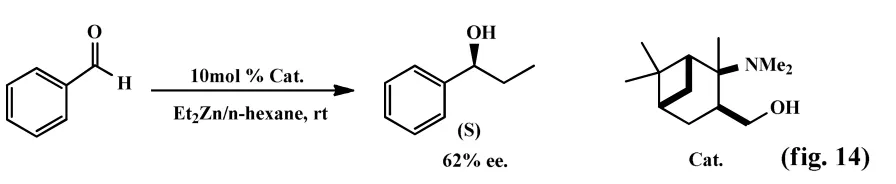
2011年,Zsolt等[14]在天然单萜类(蒈烯)基础上合成一系列手性的β-氨基醇衍生物,以该类化合物为手性配体,在二乙基锌的存在下催化不对称醛的还原反应(fig.14)。研究表明该反应具有较高对映选择性,其ee值可达62%。

2010年,安雅洁等[15,16]采用异甜菊醇作为手性配体骨架结构,连接脯氨酸得到新型手性催化剂,并应用于催化对硝基苯甲醛和环己酮的不对称aldol反应(fig.15)。研究表明该催化剂的活性和对映选择性很高,其反应在适宜条件下最高收率可达99%,ee值达99%。

此外,2011年,Ma[17]等以异甜菊醇为手性骨架合成硫脲类催化剂,并应于催化异丁醛与苯并马来酰亚胺的不对称Michael加成反应(fig.16)。研究表明在适当的条件下该反应的产率可达98%,ee值达99%。
2 结语
在自然界中,生物碱、氨基酸、糖类、萜类化合物等手性天然产物的含量丰富,光学纯度高,价廉易得,且以天然产物为原料合成的手性催化剂具有一定催化活性和对映选择性。因此,基于天然产物的不对称催化剂越来越受到人们广泛关注。对天然产物进行结构改造和修饰,合成高催化活性的手性催化剂,已经成为不对称合成研究的重要方向。
[1]Tillman A L,Yeb J X,Darren J D.Direct enantio-and diastereoselective Mannich reactions of malonate and bketo esters with N-Boc and N-Cbz aldimines catalysed by a bifunctional cinchonine derivative[J].Chem.Commun.,2006,1191-1193.
[2]Cheng L,Liu L,Jia H,et al.Enantioselective Organocatalytic anti-Mannich-Type Reaction of N-Unprotected 3-Substituted 2-Oxindoles with Aromatic N-Ts-aldimines[J].J.Org.Chem,2009,74:4650-4653.
[3]Kohler M C,Yost J M,Garnsey M R,et al.Direct Carbon-Carbon Bond Formation via Soft Enolization:A Biomimetic MAsymmetric Mannich Reaction of Phenylacetate Thioesters[J].Organic Letters,2010,12(15):3376-3379.
[4]Szollosi G,Busygin I,Herman B,et al.Inversion of the Enantioselectivity in the Hydrogenation of (E)-2,3-diphenylpropenoic Acids over Pd Modified by Cinchonidine Silyl Ethers[J].ACS Cotol.,2011,1:1316-1326.
[5]Pelagatti P,Carcelli M,Calbiani F,et al.Transfer Hydrogenation of Acetophenone Catalyzed by Half-Sandwich Ruthenium(II)Complexes Containing Amino Amide Ligands.Detection of the Catalytic Intermediates by Electrospray Ionization Mass Spectrometry[J].Organometallics,2005,24(24):5836-5844.
[6]Wu X Y,Ma Z X,Ye Z Q,et al.Highly Efficient qrganocatalyzed Direct asymmetric aldol reactions of hydroxyacetone and Aldehydes[J].Adv.Synth.Catal.2009,351:158-162.
[7]Wang B,Chen G H,Liu L Y,et al.A novel proline-valinol thioamide small organic molecule for a highly enantioselective direct aldol reaction[J].Adv.Synth.Catal.2009,351:2441-2448.
[8]Ahlford K,Ekstrom J,Zaitsev A B,et al.Asymmetric transfer hydrogenation of ketones catalyzed by amino acid derived rhodium complexes:on the origin of enantioselectivity and enantioswitchability[J].chem.Eur.J.2009,15:11197-11209.
[9]Bako P,Mako A,Keglevich G,et al.Synthesis of D-mannose-based azacrown ethers and their application in enantioselective reactions[J].Tetrahedron:Asymmetry,2005,16:1861-1871.
[10]Emmerson D P G,Hems W P,Davis B G.Carbohydratederived amino-alcohol ligands for asymmetric alkynylation of aldehydes[J].organic letters,2006,8(2):207-210.
[11]Minuth T,Boysen M K.Bis(oxazolines)based on glycopyranosides–steric,configurational and conformation-al influences on stereoselectivity[J].Beilstein Journal of Organic Chemistry,2010,6(23):1-7.
[12]Puglisi A,Benaglia M,Raimondi L,et al.Novel carbohydrate-based bifunctional organocatalysts for nucleophilic addition to nitroolefins and imines[J].Cite this:Org.Biomol.Chem.,2011,9:3295-3302.
[13]Jiang X X,Cao Y M,Wang Y Q,et al.A unique upproach to the concise synthesis of highly optically active spirooxazolines and the discovery of a more potent oxindole-type phytoalexin analogue[J].J.Am.Chem.Soc.,2010,132:15328-15333.
[14]Szakonyi Z,Fulop F.Monoterpene-based chiral b-amino acid derivatives prepared from natural sources:syntheses and applications[J].Amino Acids.2011,41:597-608.
[15]An Y J,Zhang Y X,Wu Y,et al.Simple amphiphilic isosteviol–proline conjugates as chiral catalysts for the direct asymmetric aldol reaction in the presence of water[J].Tetrahedron:Asymmetry,2010,21:688-694.
[16]An Y J,Wang C C,Xu Y Z.et al.Highly Enantioselective a-aminoxylation Reactions Catalyzed by Isosteviol-proline Conjugates in Buffered Aqueous Media[J].Catal Lett.,2011,141:1123-1129.
[17]Ma Z W,Liu Y X,Li P L,et al.A highly efficient largescale asymmetric Michael addition of isobutyraldehyde to maleimides promoted by a novel multifunctional thiourea[J].Tetrahedron:Asymmetry,2011,22:1740-1748.
