Antiflammin-1与NIH 3T3细胞的结合特性
2013-10-07史小娟冯丹丹李金凤汉建忠罗自强
李 晨,史小娟,冯丹丹,李金凤,汉建忠,罗自强
(1.中南大学湘雅医学院生理学系,长沙 410078;2.长治医学院生理学教研室,长治 046000)
Clara细胞分泌蛋白 (Clara cell secretory protein,CCSP)又称子宫珠蛋白(Uteroglobin),是气道中含量最为丰富的蛋白质之一,CCSP具有抗炎、抗氧化、免疫调节、抑制肿瘤细胞外基质侵袭、抑制成纤维细胞趋化、抑制TH2细胞活化等多种生物活性[1.2]。研究发现,CCSP的多种生物学作用依赖于细胞膜上子宫珠蛋白结合蛋白(uteroglobin-binding protein)的介导[3]。
Antiflammin-1(简称AF-1)是CCSP的活性片段,位于CCSP与其他蛋白相互作用的部位,具有与CCSP相似的抗炎作用[2]。AF-1作用的受体机制尚未阐明。本研究室曾经报道,AF-1对小鼠成纤维细胞NIH 3T3的影响有赖于膜上子宫珠蛋白结合蛋白(uteroglobin-binding protein)的介导[4]。但 AF-1与NIH 3T3表面结合的特性还不清楚。本研究首次报道AF-1与小鼠成纤维细胞 NIH 3T3在活细胞上的结合特性。
1.材料与方法
1.1 AF-1合成和标记
AF-1(MQMKKVLDS)的合成由北京晶美生物科技有限公司采用美国ABI公司的多肽自动合成仪固相合成法,对固相合成的多肽用液相色谱仪进行纯化,所得到的产品先后用HPLC鉴定纯度和质谱仪测定分子量,纯化后纯度大于98%。储存于20℃备用。Cy5标记的AF-1(Cy5-AF-1)由北京晶美生物科技有限公司 完成。Biotin标记的AF-1(Biotin-AF-1)由上海生物工程技术有限公司提供。
1.2 激光扫描共聚焦显微镜观察
小鼠成纤维细胞株 NIH 3T3 (ATCC Catalog No.CRL-1658,由中南大学国家医学遗传学重点实验室提供)种于35 mm细胞培养皿,以10%FBSDMEM培养基培养至50%汇合,加入Cy5标记的AF-1多肽(加入标记多肽之前换无酚红DMEM培养液过夜)[5]。Cy5标记多肽加入后37°C孵育1 h,洗涤,去除未结合的Cy5-AF-1,Carl Zeiss LSM 510激光共聚焦显微镜下观察和进行图像分析。
1.3 竞争实验
为了避免胰蛋白酶对细胞表面蛋白的影响,用改进的EDTA方法制备单细胞悬液[6]:用无血清无酚红DMEM培养基洗涤贴壁细胞3次,加入37℃ 预热的0.2%EDTA/PBS溶液孵育 3~5 min至细胞松动,用5mL Tip吹打使细胞块脱落后加入10%的胎牛血清。将细胞悬液离心洗涤2次先后通过6号、4号注射针头制成单细胞悬液。台盼蓝检查细胞活性备用。
在一系列试管加入从稀浓度到高浓度的未标记的AF-1(控制每管细胞在106/mL PBS),使各管的AF-1 的终浓度依次为 1 mol/L,5 mol/L,10 mol/L,和20 mol/L,放置30 min后,向各管中加入100 nmol/L的Cy5-AF-1,各管混匀,于4℃孵育60 min后用1%BSA-PBS洗涤细胞,流式细胞仪检测各管荧光强度。
在用Biotin-AF-1进行实验时,加入100nmol/L的Biotin-AF-1于4℃孵育30min后,加入FITC标记的抗生物素抗体继续避光孵育30 min,1%BSA-PBS洗涤细胞后流式细胞仪检测各管荧光强度。
1.4 配体亲和力分析
按照每管3×106个细胞制备细胞悬液,分装于棕色Eppendorf管中备用。在用于测定总结合的各管用PBS制备细胞悬液,在用于测定非特异性结合的各平行管中加入20 mol/L未标记的AF-1。细胞悬液放置30 min后,分别于各管内加入从低浓度到高浓度的Cy5-AF-1,使各管中Cy5-AF-1的终浓度依次为 0.5 nmol/L,1 nmol/L,2 nmol/L,5 nmol/L,10 nmol/L,20 nmol/L,50 nmol/L,100 nmol/L,于4℃避光继续孵育60 min后用流式细胞仪测各管荧光强度。Specific binding=Total bindingnonspecific binding。将得到的实验数据经Prism程序计算得到Kd值和Bmax值,并绘制Scatchard plot。
1.5 统计学分析
用SigmaStat 3.5进行统计学分析,用SigmaPlot 10.0绘制统计图。所给出的数据用平均值SEM表示。P<0.05表示有显著性差异。用GraphPad PRISM 4.0进行结合特性分析与计算,并绘制Scatchard图。
2 结果
2.1 激光共聚焦显微镜观察Cy5-AF-1与NIH3T3细胞的结合
NIH 3T3细胞 与Cy5-AF-1孵育1小时后,通过激光共聚焦显微镜观察细胞标记的Cy5的情况,结果显示,NIH3T3细胞可被Cy5-AF-1的红色荧光标记,表明NIH 3T3细胞可以结合AF-1(图1,A).
2.2 基于流式细胞分析的结合实验和竞争实验
首先用Biotin标记AF-1检测其与细胞表面的结合。 流式细胞分析结果显示,生物素标记的AF-1具有与NIH3T3细胞表面结合的能力 (图1,B)。
当在NIH 3T3细胞与Biotin-AF-1的反应体系中加入未标记的AF-1之后,检测到的Biotin-AF-1的平均荧光强度随着未标记肽的加入而显著下降(结合量下降)(图1,C)。当未标记的肽浓度为1 mol/L (10 倍),5 mol/L (50 倍),10 mol/L(100倍)和20 mol/L(200倍)时,流式细胞分析方法测得的各管平均荧光强度与对照管平均荧光强度相比分别降低60%,80%,85%,和91%。
为了尽可能排除标记方法的不同对AF-1与细胞表面的结合特性的影响,我们进而用Cy5标记AF-1在NIH 3T3细胞重复上述实验,发现Cy5标记的AF-1同样具有结合NIH3T3细胞表面的能力,Cy5-AF-1的平均荧光强度随未标记肽浓度的增加而下降(图2)。
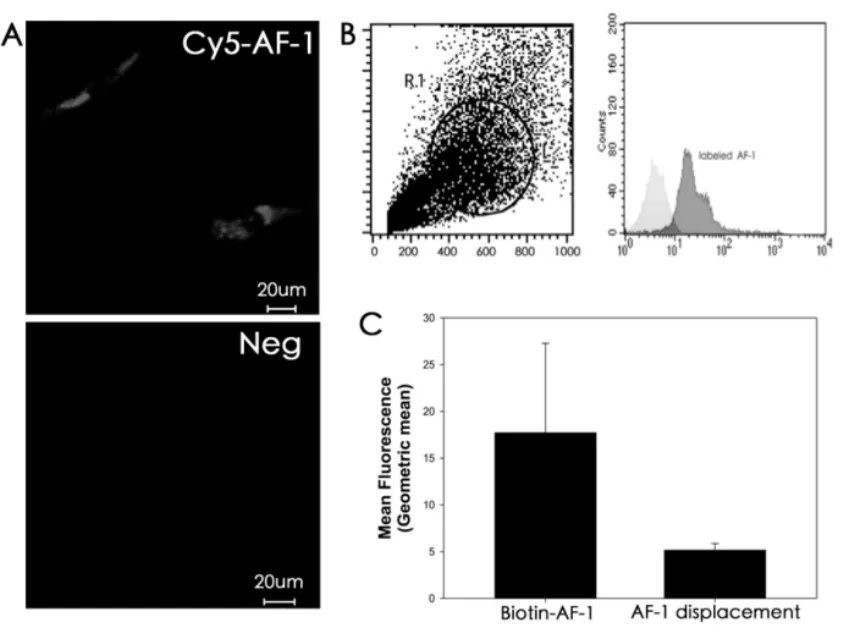
图1 激光共聚焦显微镜及流式细胞分析方法检测AF-1与NIH 3T3细胞的结合
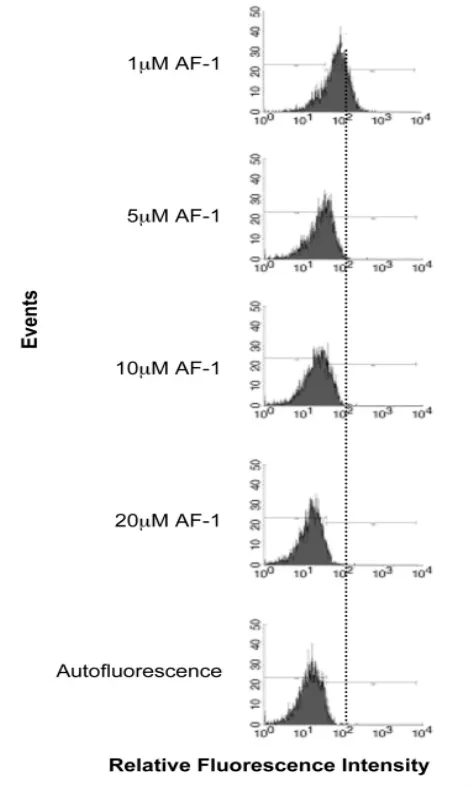
图2 过量未标记肽可以竞争Cy5-AF-1与NIH 3T3的结合。
在NIH 3T3细胞与 Cy5-AF-1 (0.1 mol/L)的反应体系中加入不同浓度的过量未标记的AF-1,流式细胞方法检测发现,Cy5-AF-1的平均荧光强度随未标记肽浓度的增加而下降。
2.4 最大结合容量(Bmax)和平衡解离常数(Kd)的计算
按照方法部分设计的实验体系,实验所得数据用GraphPad Prism4.0软件进行Scatchard作图,计算其Kd和Bmax分别为37.754.003 nmol/L和93.294.267RFI(图 3,图 4)。

图3 Cy5-AF-1结合于NIH 3T3细胞的结合曲线。
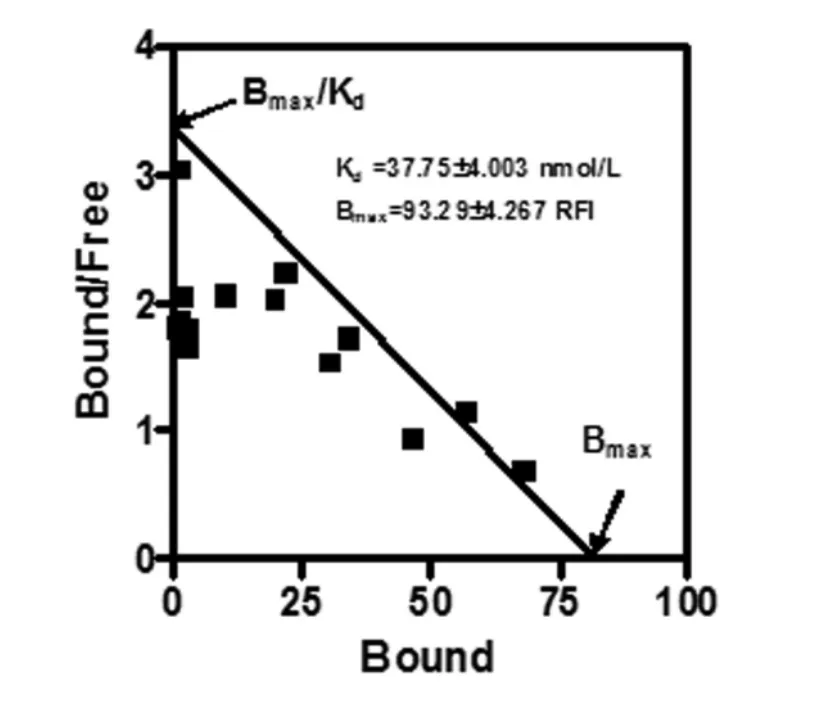
图4 Cy5-AF-1结合于NIH 3T3细胞的Scatchard作图。
3 讨论
配体结合试验是一种在体外研究受体的直接的方法 。通过配体结合试验不仅可以认识受体-配体间相互作用的机制和特性,认识各种受体在不同组织、不同细胞上的分布,还有助于认识组织细胞的功能及其机制。 在现有相关的研究报道中,用于受体结合分析的标本可以是组织切片、完整细胞的悬液,或者是细胞、组织块、经初步分离得到的亚细胞组分如细胞膜、微粒体、细胞浆,也可以是经过进一步纯化或基因工程合成的受体蛋白标本[7]。选择完整的活细胞作为体外受体结合实验的受体材料,可以使受体处于原有的相对正常环境中,允许在受体功能反应完全的情况下研究受体。 作为对于细胞功能起重要作用的膜蛋白而言,只有在其肽链折叠成特定构象,并且与细胞膜上的磷脂双层及周围蛋白保持特定的相互作用时,才能正常行使其功能。因此,在活细胞体系进行的研究和应用已经越来越受到研究者的重视和关注[8,9]。AF-1对应于CCSP分子中第 39-47位的氨基酸(MQMKKVLDS),位于CCSP与其他蛋白相互作用的部位。本文利用荧光标记技术结合激光共聚焦成像和流式细胞分析等方法,研究AF-1与其结合蛋白或受体在活细胞上发生结合的特性,首次对AF-1与活细胞的结合特性进行了研究。
激光扫描共聚焦显微镜由于采用点扫描,与全反荧光显微镜相比其优点是可以获得样品不同深度层次的图像,从而在溶液和室温条件下进行成像时仍然可以得到高分辨率,这样,借助于用合适的荧光基团(本研究采用Cy5)对所研究的大分子进行标记并结合计算机分析,就能在对细胞最少扰动的情况下对活细胞成像,因而在活细胞上用于研究配基-受体相互作用上有较大的适用范围[5,10]。本课题组前期曾以用荧光染料标记的AF-1作为"荧光探针"(fluorescent probe),在激光扫描共聚焦显微镜下对该寡肽片段进行示踪和定位,证明了AF-1与活细胞上的受体蛋白的表达呈现共定位现象[4]。本文的研究结果进一步表明,荧光标记的AF-1可以直接结合于受体阳性细胞NIH 3T3,提供了它们在活细胞上发生结合的证据。
根据文献报道,借助流式细胞分析对配基-受体的结合特性进行分析被认为可以得到与放射性配基分析方法相似且可靠的研究的结果[11,12],Shatti等(1987年)利用125I和生物素双标记的单抗进行的比较研究表明,碘标测定的结合位点数与荧光强度间有线性关系。因此,基于流式细胞方法的配体受体结合分析不仅需要细胞数更少(不及氚标记配体结合试验的1/10),而且由于提供了一种更快速灵敏的受体分析方法而被广泛采用[12]。我们按照Ligand binding interaction方法[11,12]建立试验体系,借助流式细胞分析方法对AF-1及结合位点的结合特性进行分析,发现细胞表面结合的标记配基的量由于加入未标记肽而明显下降(图1,C.),这一现象符合配体与受体之间结合的竞争抑制的特性[7],提示二者之间的结合是特异性的,呈现"配体-受体"样的结合。通过计算,AF-1与NIH 3T3之间的亲和力Kd在29.19~46.33 nmol/L之间 (图2),Bmax=93.294.267 RFI(图3),提示是一种较高亲和力的结合。 根据我们的分析结果,Scatchard作图呈线性,符合简单位点系统的特征。
综上所述,本研究首次在完整的活细胞上研究了AF-1与其受体或结合蛋白阳性表达细胞NIH3T3之间的结合,这对于更加客观真实地揭示在生理条件下AF-1与其结合蛋白(或受体)之间的结合特性具有重要意义。
[1]罗自强,岳少杰,赵必红.Clara细胞分泌蛋白[J].生理科学进展,2003,34,227-230.
[2]Mukherjee AB,Zhang Z,Chilton BS.Uteroglobin:a steroid-inducible immunomodulatory protein that founded the Secretoglobin superfamily[J].Endocr Rev,2007,28(7):707-725
[3]Kundu GC,Zhang Z,Mantile-Selvaggi G,et al.Uteroglobin binding proteins:regulation of cellular motility and invasion in normal and cancer cells[J].Ann NY Acad Sci,2000,923:234-248.
[4]Li C,Han J,Li L,et al.Interaction of antiflammin-1 with uteroglobin-binding protein induces phosphorylation of ERK1/2 in NIH 3T3 cells[J].Peptides,2007,28(11):2137-2145.
[5]Sako Y,Minoghchi S,Yanagida T.Single-molecule imaging of EGFR signalling on the surface of living cells[J].Nat Cell Biol,2000;2(3):168-172.6.Zell T,Khoruts A,Ingulli E,et al.Single-cell analysis of signal transduction in CD4 T cells stimulated by antigen in vivo[J].Proc Natl Acad Sci,2001,98(19):10805-10810.
[7]贺师鹏,胡雅儿,夏宗勤.受体研究技术[M].北京大学医学出版社,2004.
[8]Schaaf MJ,Cidlowski JA.Molecular determinants of glucocorticoid receptor mobility in living cells:the importance of ligand affinity[J].Mol Cell Biol,2003,23(6):1922-1934.
[9]F?ldes-Papp Z,Demel U,Tilz GP.Laser scanning confocal fluorescence microscopy: an overview [J].Int Immunopharmacol,2003,3(13-14):1715-1729
[10]Knemeyer JP,Herten DP,Sauer M.Detection and identification of single molecules in living cells using spectrally resolved fluorescence lifetime imaging microscopy[J].Anal Chem,2003,75(9):2147-2153.
[11Brockhoff G,Hofstaedter F,Knuechel R.Flow cytometric detection and quantitation of the epidermal growth factor receptor in comparison to Scatchard analysis in human bladder carcinoma cell lines[J].Cytometry,1994,17(1):75-83.
[12]Gati WP,Paterson AR,Larratt LM,et al.Sensitivity of acute leukemia cells to cytarabine is a correlate of cellular es nucleoside transporter site content measured by flow cytometry with SAENTA-fluorescein[J].Blood,1997,90(1):346-353.
