DFMG对LPC诱导的人脐静脉内皮细胞的CD40/CD40L相互作用及E-选择素的释放的影响
2013-10-07杨慧琼戴哲娟曹建国符晓华
杨慧琼,戴哲娟,张 婧,曹建国,符晓华
(湖南师范大学医学院,湖南 长沙 410013)
动脉粥样硬化是冠心病、脑梗死等心脑血管疾病的重要病理基础。血管内皮细胞是连续被覆在全身血管内膜的一层表面光滑的扁平细胞,直接和血液接触,不仅具有生理屏障作用,而且具有调节动脉血管舒缩、凝血系统平衡、血小板聚集、单核细胞聚集和促进新生血管生长的功能[1-2]。血管内皮的损害是动脉粥样硬化发生发展的始动因素[3]。近年来发现,CD40/CD40L广泛存在于动脉粥样硬化(AS)斑块的各种细胞中,其相互作用显著影响AS相关细胞的功能,并且与斑块的发生发展密切相关[4]。因此,保护血管内皮细胞,拮抗内皮细胞凋亡是防治心血管疾病特别是抗动脉粥样硬化的前沿研究领域之一。
7-二氟甲氧基-5、4'-二甲氧基金雀异黄素(7-difluoromethoxy-5,4'-dimethoxygenistein,DFMG)是我们自主设计、合成和筛选得到的一种较先导化合物GEN具有更强的保护血管内皮过氧化氢应激损伤作用的活性新化学实体[5]。本文旨在DFMG拮抗LPC诱导的HUVE-12细胞凋亡是否与抑制CD40/CD40L的表达及E-选择素的释放的有关。
1 材料与方法
1.1 药品与试剂
DFMG由本实验室参照文献[4]方法合成,纯度>99%,分子式C18H14O5F2,分子量 348,性状为淡黄色晶体粉末。GEN (美国 Sigma公司)、LPC (美国Sigma公司)、AnnexinⅤ-FITC/PI双染试剂盒 (美国Roche 公司)、FITC anti-human CD40(美国 Biolegend公司)、FITC anti-human CD40L(美国 Biolegend 公司)、PE Mouse IgG1,κ Isotype Ctrl Antibody(美国 Biolegend 公司)、Human endothelium-selectin Kit(美国RayBio公司)购自湖南科泰生物技术有限公司(中国长沙)。
1.2 细胞与细胞培养
人脐静脉内皮细胞(HUVE-12),培养于含10%胎牛血清的DMEM培养基中,置于37℃、5%二氧化碳(CO2)及饱和湿度培养箱中培养,用0.25%胰蛋白酶进行消化传代,1-2天传代一次,取对数生长期细胞用于实验。
1.3 FITC标记Annexin-V/PI双染流式细胞术分析
经DFMG或GEN和LPC处理的HUVE-121×106,1000 g 离心 5 min,弃上清,加入 100μL 的已配置好的Annexin V-FLUOS标记溶液,(配置方法为1ml孵育缓冲液中加入20μL的Annexin V-FLUOS标记试剂和10μL碘化丙啶溶液,混匀,室温避光放置),轻轻重悬细胞后,室温下(15-25℃)避光孵育15 min。然后每管加入孵育缓冲液0.5mL轻轻混匀,立即用EPICS XL流式细胞仪(美国Coulter公司)检测Annexin V-FITC阳性 (早期凋亡)和An-nexin VFITC/PI双染阳性(晚期凋亡)细胞百分率。
1.4 用流式细胞仪检测CD40/CD40L的表达
采用流式细胞仪(EPICS-XL,美国Culter公司)间接免疫荧光法检测。将106/mL细胞悬于PBS中,4℃600g离心3min,去上清,加50μL第一抗体于样品管中,对照组加50μLPBS,4℃下孵育30min,PBS洗2次后,加入50μLPE标记的二抗,4℃孵育30min,PBS洗2次以200μLΡBS重悬细胞,维持在4℃立即上流式细胞仪检测。计数5000个细胞,用平均荧光强度(mean fluorescence intensity,MFI)代表细胞表达 CD40、CD40L水平。
1.5 E-选择素定量检测试剂盒检测E-选择素
经DFMG或GEN和LPC处理的HUVE-121×106,1000r/min。4℃离心 15min,取上清液用于实验。按E-选择素试剂盒说明书进行加样,每组样品设3个复孔,酶标板覆膜37℃反应120min,弃去液体,甩干,不用洗涤,每孔加提前配置好的生物素标记抗体工作液100μL,37℃反应 60min。温育 60min 后,弃去孔内液体,甩干,洗涤5次,甩干。依序每孔加底物溶液90μL,37℃避光显色,30min内,此时肉眼可见标准品的前3-4孔有明显的梯度蓝色,后3-4孔显色不明显,即可终止。依序每孔加终止液50μL,终止反应,此时蓝色转为黄色。用酶联仪在450nm波长依序测量各孔的光密度值(OD值)。在加终止液后15min内检测。
1.6 统计学分析
实验数据以均数±标准差表示,应用SPSS 19.0统计软件进行方差齐性检验、单因素方差分析(OnewayANOVA)。方差具有齐性,用LSD法进行多样本均数之间的两两比较;方差不齐,采用Dunnett T3法进行多样本均数之间的两两比较。P<0.05为差异具有统计学意义。
2 结果
2.1 LPC对HAEC细胞凋亡率的影响
表 1 显示,LPC(3.0、10.0 和 30.0μmol/L)处理24 h时,HUVE-12细胞凋亡率 [Annexin V-FITC阳性(早期凋亡)和 Annexin V-FITC/PI双染阳性(晚期凋亡)细胞百分率之和]增高,呈浓度依赖性(P<0.05)。LPC(10μmol/L)的细胞凋亡率为(30.98%±2,04%)(P<0.05),因 此,在接下来的实验中,10μmol/L的 LPC作用 24 h制备 LPC诱导HUVE-12细胞凋亡模型。
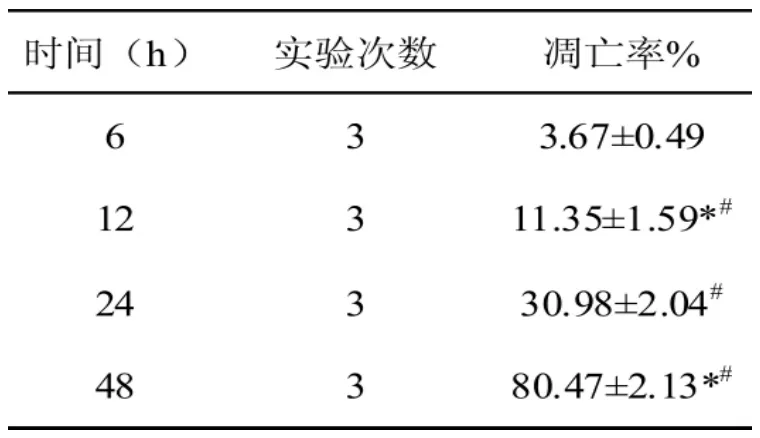
表1 LPC作用不同时间HUVEC-12细胞凋亡的比较与 6h组比较,#P<0.05 ,与 24h组比较:*P<0.05。
2.2 DFMG对LPC诱导HUVE-12细胞凋亡的影响
表 2 可见,DFMG(1.0,3.0μmol/L)预孵育有效拮抗LPC诱导HUVE-12细胞凋亡,呈浓度依赖性,相同浓度的DFMG较先导化合物GEN拮抗作用更强,与洛伐他汀组差异无统计学意义。
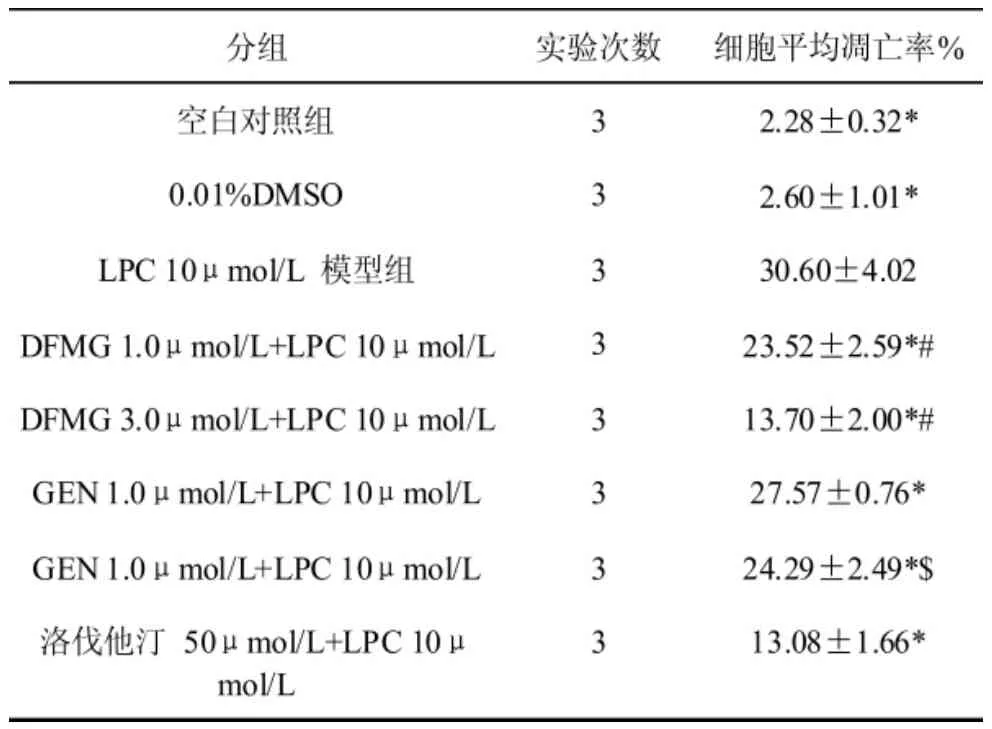
表2 LPC作用不同时间HUVEC-12细胞凋亡的比较表中所示为3次独立实验的合并结果。与LPC 10μmol/L
2.3 DFMG对LPC诱导HUVE-12 CD40/CD40L的影响
图 1 表明,DFMG(1.0,3.0μmol/L)预孵育有效拮抗 LPC诱导HUVE-12 CD40/CD40L的表达,呈浓度依赖性,相同浓度的 DFMG较先导化合物GEN拮抗作用更强,与洛伐他汀组差异无统计学意义。
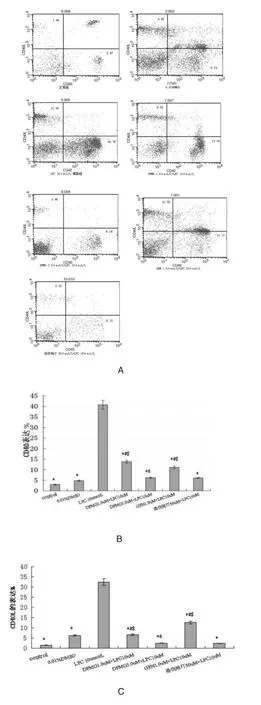
图1 DFMG降低LPC诱导HUVE-12的CD40及CD40L的表达和相互作用
2.4 DFMG对LPC诱导HUVE-12释放E-选择素的影响
图 2 可见,DFMG(1.0,3.0μmol/L)预孵育有效拮抗LPC诱导HUVE-12释放E-选择素,呈浓度依赖性,相同浓度的DFMG较先导化合物GEN拮抗作用更强,与洛伐他汀组差异无统计学意义。DFMG和GEN各自单独应用,在本实验条件下对HAEC细胞凋亡无明显影响。
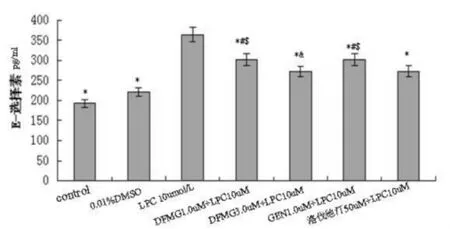
图2 DFMG拮抗LPC诱导HUVE-12的E-选择素的表达
3 讨论
HAUNSTETTER等[6]学者很早就认为内皮细胞凋亡在动脉粥样硬化的早期扮演着重要角色。此后不断有研究发现血流剪切力[7]、氧化型低密度脂蛋白[8]、生长因子[9]、活性氧[10]等众多因素影响动脉粥样硬化中血管内皮细胞、血管平滑肌细胞和单核巨噬细胞的凋亡。因此,以减少内皮细胞凋亡来达到防治动脉粥样硬化的发生与发展,是治疗动脉粥样硬化的新领域。本文用氧化型低密度脂蛋白的活性成分即LPC作用体外培养 HUVE-1224 h,以时间依赖方式诱导细胞凋亡。这些结果提示,LPC具有诱导HUVE-12细胞凋亡作用。此外,国内也有人发现GEN以浓度依赖方式抑制人脐静脉血管平滑肌细胞[11]和人脐静脉内皮细胞[12]增殖,能减轻Ox-LDL导致的血管炎症反应,发挥抗AS的作用[13]。
近年来发现,CD40/CD40L广泛存在于动脉粥样硬化(AS)斑块的各种细胞中,其相互作用显著影响AS相关细胞的功能,并且与斑块的发生发展密切相关,体外细胞实验也证实,CD40/CD40L的相互作用可以促进人ECs、SMCs和巨噬细胞对与某些和AS的发生发展密切相关的黏附分子、细胞因子、基质金属蛋白酶和组织因子的表达。动物实验发现CD40-CD40配体通路与As病变和斑块结构等具有相关性[14,15];临床研究也证实这一系统与As的发病和严重程度的关系[16,17],而许多抗As的治疗都可能直接或间接的通过这一途径发挥作用[18,19]。在AS中黏附分子的重要性已在实验模型中证实,CD40诱导的黏附分子如ICAM-1、VCAM-1或P/E-选择素的缺乏不仅是显著减少免疫成分细胞的黏附,而且减少apoE-缺陷鼠的AS损伤的大小[20,21],CD40信号通路在As的发生发展中起着重要的作用,阻断CD40-CD40配体系统能够减少粘附分子的表达、抑制炎症反应、减轻As的病变程度[22]。因此,抑制CD40-CD40配体信号通路在As防治中的作用及其机制越来越多地引起研究者的关注。
在本文的研究中,用不同浓度的 DFMG和GEN预孵育 30 min,LPC作用 HUVE-1224 h后发现,DFMG能以浓度依赖方式降低 LPC诱导HUVE-12 CD40/CD40L的相互作用及E选择素的表达。而且DFMG比GEN显现出更高的效价强度,从而证明 DFMG不但和GEN一样具有拮抗LPC诱导HUVE-12细胞凋亡作用,而且其作用比GEN更强。这些研究结果凸显了 DFMG具有优良药效学特性的AS防治候选药物潜能。
[1]Erdbruegger U,Woywodt A,Kirsch T,et al.Circulat-ing endothelial cells as a prognostic marker in thrombotic microangiopathy[J].Am J Kidney Dis,2006,48(4):564-570.
[2]Wassmann S,Werner N,Czech T,et al.Improvement ofendothelial function by systemic transfusion of vascular progenitorcells[J].Circ Res,2006,99(8):74-83.
[3]Chapman MJ.From pathophysiology to targeted therapy for atherothrombosis:a role for the combination of statin and aspirinin secondary prevention [J].Pharmacol Ther,2007,113(1):184-196.
[4]佟倩, 闫立敏, 郑杨.CD40/CD40L参与动脉粥样硬化的机制[J].J Clin Cardiol(China),2005,21(8)506-509.
[5]Fu Xh,Wang L,Zhao H,et al.Synthesis of genisteinderivatives and determination of their protective effects againstvascular endothelial cell damages caused by hydrogen peroxide[J].Bioorg Med Chem Lett,2008,18(2):513-517.
[6]Haunstetter A,Izumo S.Apoptosis:basic mechanisms and implications for cardiovascular disease[J].Circ Res,1998,82(4):1111-1120.
[7]Dimmeler S,Hermnann C,Galle J,et al.Upregulation of superoxide dismutase and nitrie oxide synthase mediates the apoptosis-suppressive effects of Shear stress on endothelial cells.[J].Arterioseler Thromb Vasc Biol,1999,19(3):656-666.
[8]Farber A,Kitzmiller T,Morganelei PM,et al.A cas-pase inhibitor decreases oxidized low-density lipoproteininduced apaoptosis in bovine endothelial cells[J].J Surg Res,1999,85(2):323-330.
[9]Artese L,Ucehino S,Piattelli A,et al.Factor associ-ated with apoptosis in symptomatic and asymptomatic carotid atheroselerotic plaques[J].Int J Immunopathol Pharmaeol,2005,18(4):645-653.
[10]DE Nigris F,Lerman A,Ignarrol J,et al.Oxida-tionsensitive meehanisms vaseular apoptosis and atheroselerosis[J].Trends Mol Med,2003,9(8):351-359.
[11]Guan XM,Feng ZJ,Qian MZ.The inhibition of genistein on proliferation and transcription of c-fos mRNA in human umbilical vascular smooth muscle cells induced by MCP-1 [J].Chinese Pharmacological Bulletin,2005,21(8):943-945.Chi-nese
[12]Li QS,Liu Y,Feng ZJ,et al.Effects of genistein on proliferation of human umbilical vein endothelial cells[J].Chinese Journal of Cellular and Molecular Immunology,2007,23(7):668-670.Chinese
[13]Feng ZJ,Lu ZS,Liu Y,et al.Genistein suppresses activation of nuclear factor-κB in vascular smooth muscle cells [J].Chinese Journal of Arteriosclerosis,2009,5(17):363-366.Chinese
[14]Lutgens E,Cleutjens KB,Heeneman S,et al.Both early and delayed anti-CD40L antibody treatment induces a stable plaque phenotype[J].Proc Natl Acad Sci,2000,97(13):7464-1469
[15]Schonbeck U,Sukhova GK,Shimizu K,Mach F,Libby P.Inhibition of CD40signaling limits evolution of established atherosclerosis in mice[J].Proc Natl Acad Sci,2000,97(13):7458-1463
[16]Heeschen C,Dimmeler S,Hamm CW,et al.Soluble CD40 ligand in acute coronary syndromes[J].N Engl J Med,2003,348(12):1104-1111
[17]Buremmer D,Riggers U,Holzmeister J,et al.Expression of CD40 in vascular smooth muscle cells and macrophages is as-sociatedwith early development of human atherosclerotic lesions[J].Am J Car diol,2001,87(1):21-27
[18]金冬雁,黎孟枫.分子克隆试验指南[M].第二版, 科学出版社,1998
[19]Cockerill GW,Huehns TY,Weerasinghe A,Set al.Elevation of plasma high density lipoprotein concentration reduces inter-leukin-12 induced expressionofE-selectiin in an InVivomodel ofacute inflamma-tion[J].Circulation,2001,103(2):108-112
[20]Cybulsky MI,Iiyama K,Li H,et al.A major role for VCAM-1,but not ICAM-1,in early atherosclerosis[J].J Clin Invest,2001,107:1255-1262.
[21]Collins RG,Velji R,Guevara NV,et al.P-Selectin or intercellular adhesion molecule (ICAM)-1 deficiency substantially protects against atherosclerosis in apolipoprotein E-deficient mice[J].J Exp Med,2000,191:189-194.
[22]Zhang J,Chen JL,Gu Q,et al.Effects of Inhibition of CD40-CD40Ligand System on Atherosclerosis。 [J]中国动脉硬化杂志,2006,14(2):119-122.
