血塞通对局灶性脑梗死大鼠海马Nogo-A表达的影响*
2013-10-02吴建华张晓倩朱陵群
吴建华 张晓倩 朱陵群
(北京中医药大学东直门医院中医内科学教育部重点实验室 北京市重点实验室,北京 100070)
成人的中枢神经系统的再生能力微乎其微,主要的影响因素之一就是中枢神经系统微环境中存在着众多的抑制性因子。在已知的诸多抑制因素中Nogo-A是最主要的中枢神经轴突生长抑制因子[1]。中药血塞通在缺血性脑血管病的治疗中具有很好的疗效,本研究通过观察大鼠大脑中动脉阻塞模型不同恢复时间点大脑海马区病理学改变以及Nogo-A蛋白含量的变化,探讨药物血塞通对脑缺血后中枢神经的保护、功能重建的作用机理以及血塞通不同剂量应用所产生的不同疗效。
1 材料与方法
1.1 动物 健康雄性SD大鼠,体质量(300±20)g,购自北京维通利华实验动物技术有限公司,许可证编号:SCXK(京)2006-0009。
1.2 药物与试剂 尼莫地平片(拜耳医药保健有限公司生产,国药准字 H20003010),规格:每片 30 mg;注射用血塞通冻干粉(昆明制药集团股份有限公司生产,国药准字Z20026438),主要成分为三七总皂苷,规格:每瓶400 mg。2636型尼龙栓线:线身直径0.25 mm,线头直径(0.34±0.02)mm,线长 40 mm,购自北京沙东生物技术有限公司。Nogo-A为兔多克隆抗体(美国santa cruz公司,批号:sc-25660),SP 试剂盒、DAB 显色试剂盒均购自北京百事创新科技有限公司。
1.3 MCAO模型制备 大鼠编号称体质量后随机分为手术组和非手术组(正常组)。手术组动物参考文献采用改良的EZ Longa方法[1]制备大鼠MCAO模型。术前12 h禁食不禁水,腹腔注射3.5%水合氯醛麻醉(10 mL/kg),仰卧位固定,于颈正中纵行切开皮肤,钝性分离颈部肌群,游离颈总动脉(CCA)、颈外动脉(ECA)与颈内动脉(ICA),结扎ECA近分叉处和CCA近心端,用动脉夹暂时夹闭CCA远端,在CCA结扎与夹闭两处之间用虹膜剪剪开一小口,将浸于肝素生理盐水中的尼龙线栓沿CCA插入ICA,并顺ICA推进18~22 mm,稍遇阻力停止,即可造成大脑中动脉的阻断,然后结扎颈总动脉固定栓线,缝合皮肤,放到笼中并保暖。MCAO模型成功的判断标准采用Longa EZ评分标准[1]:0 分,无神经缺损表现;1 分,对侧前爪不能充分伸展;2分,向外侧转圈;3分,行走时向对侧倾倒;4分,不能行走,意识丧失。动物清醒后进行神经功能评分,1至3分者为纳入标准,0分和4分者剔除。
1.4 分组及给药 所有纳入实验的动物,根据Longa评分和体质量随机分组,分为模型组,血塞通大剂量组,血塞通小剂量组和尼莫地平组以及未手术的正常组5组。给药剂量按大鼠与人的体表面积等效剂量折算,尼莫地平片每日为1.44 mg/100 g;血塞通小剂量每日为3.6 mg/100 g;血塞通大剂量每日为7.2 mg/100 g。各组大鼠均于当日手术后5 h给药,血塞通大、小剂量组进行腹腔注射,尼莫地平组予以尼莫地平混悬液灌胃,模型组和正常组每日腹腔注射等体积生理盐水,药物每日新鲜配制,各组大鼠每3日称1次体质量,根据体质量重新计算每只动物的给药量,直到取材当日处死时。
1.5 标本采集与检测 于术后第7、14、28日3个时间点分别进行取材。(1)苏木素-伊红(HE)染色。在各时间点,每组大鼠用腹腔注射3.5%水合氯醛麻醉后,使用PBS和4%多聚甲醛心脏灌注,然后将大鼠快速断头处死,冰上取脑,4%多聚甲醛浸泡固定,视交叉后2 mm取脑组织,常规脱水浸蜡包埋,行5 μm厚度切片。每只大鼠取1张含有海马区的切片,切片脱蜡至水,进行常规HE染色。(2)免疫组化染色。石蜡切片常规脱蜡至水,枸橼酸缓冲液修复、3%过氧化氢避光浸泡。4℃孵育滴加兔抗Nogo A多克隆抗体(1∶25)至少16 h。生物素标记二抗,37℃孵育30 min,使用PBS缓冲液清洗数次,滴加辣根过氧化物酶标记链酶卵白素工作液后,孵育时间与温度与二抗相同。然后在室温下滴加DAB显色剂避光显色,显色完毕后自来水终止显色。常规脱水中性树脂透明封片。以0.01 mol/L PBS缓冲液代替一抗作为阴性对照。(3)图像与数据分析。使用OLYMPUS BX60型显微镜和SPOT-Ⅱ软件进行图像采集,用Meta Morph Universal imaging corporation软件进行图像分析。各组各时间点的免疫组织化学图像分析采用阳性信号光密度值作为参数进行统计分析。
1.6 统计学处理 数据经正态分布及方差齐性检验后进行方差分析,应用SPSS10统计软件,数据以(±s)表示。P<0.05为差异有统计学意义。
2 结果
2.1 术后不同时间点各组大鼠神经功能评分 见表1。模型组术后5 h神经功能缺损严重,评分较高,术后48 h缺损的神经功能有所恢复,评分开始下降,术后72 h评分,模型组显著高于尼莫地平组和血塞通各组(P<0.05 或 0.01)。
2.2 一般状态 正常组SD大鼠活动灵活,精神状态良好。术后24 h内各组大鼠活动度较差,皮毛不光泽,反应迟钝,蜷缩聚集,饮食饮水受限,24 h后,手术各组大鼠开始饮食饮水,但精神、反应和活动度仍然较差。术后7 d各组大鼠精神、反应及活动度有好转,血塞通组和尼莫地平组较模型组好转明显,能自由活动。术后14 d各组大鼠恢复很快,饮食饮水正常,活动度较好。术后28 d,各组动物一般状态接近正常,活动度跟正常动物无明显的差异。正常组的动物精神状态,活动度,饮食饮水一直很好。
2.3 形态学观察 HE染色正常组大鼠海马区内的神经元数量较多,且排列整齐,细胞结构完整,细胞体积大,核大而圆,核仁明显;而模型组大鼠海马区神经元排列紊乱,界限不清楚,神经元之间间隙增大,正常细胞结构消失,较多神经元呈固缩状坏死。与模型组相比,血塞通大小剂量组和尼莫地平组病理形态变化得到一定程度的改善,海马神经元排列较整齐,细胞结构较完整,固缩的神经元数量较少,且血塞通大剂量组较小剂量组的病理形态变化改善明显。
2.4 MCAO术后大鼠海马Nogo-A蛋白表达的变化见表2。模型组在MCAO 术后7、14、28 d的海马Nogo-A的表达持续增高,均显著高于正常组,具有非常明显差异(P<0.01)。各药物组Nogo-A的表达均低于模型组,其中血塞通大剂量组、尼莫地平组在给药后7、14、28 d的海马Nogo-A 的表达均显著低于模型组,具有明显差异(P<0.01);血塞通小剂量组海马的No-go-A的表达在给药后28 d显著低于模型组,具有显著差异(P<0.05);血塞通大剂量组的Nogo-A的表达在28 d明显低于血塞通小剂量组(P<0.05)。
表1 各组大鼠神经功能评分比较(分,±s)

表1 各组大鼠神经功能评分比较(分,±s)
与模型组同时间点比较,*P<0.05,**P<0.01。
组 别 n尼莫地平组 21正常组 7模型组 18术后5 h 术后24 h 术后48 h 术后72 h 2.05±0.6 1.76±0.44 1.67±0.48 1.28±0.46**0 0 0 0 2.00±0.59 1.89±0.58 1.83±0.51 1.78±0.43血塞通大剂量组 18 2.11±0.47 1.78±0.55 1.67±0.59 1.38±0.50**血塞通小剂量组 18 2.06±0.54 1.83±0.38 1.77±0.42 1.33±0.48*
表2 各组大鼠海马Nogo-A蛋白表达水平比较(±s)
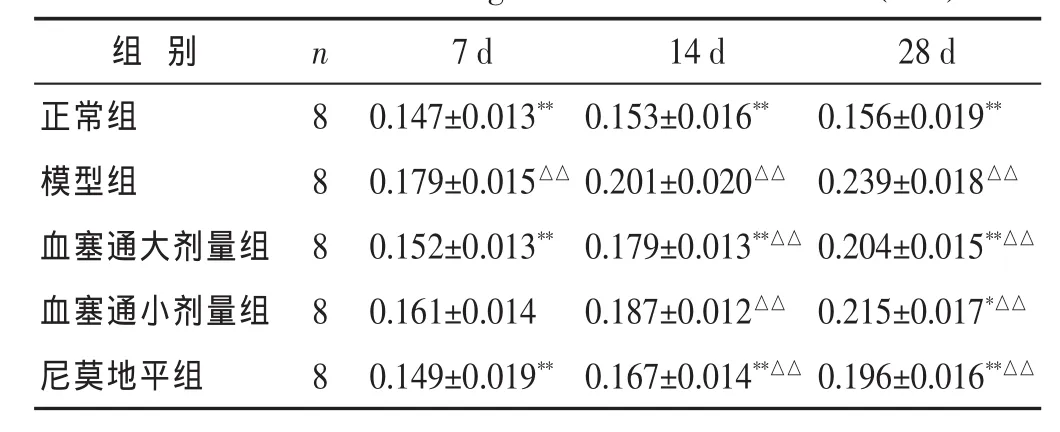
表2 各组大鼠海马Nogo-A蛋白表达水平比较(±s)
与模型组比较,*P<0.05,**P<0.01;与正常组比较,△△P<0.01。
组 别 n尼莫地平组 8正常组 8模型组 8 7 d 14 d 28 d 0.149±0.019** 0.167±0.014**△△ 0.196±0.016**△△0.147±0.013**0.153±0.016** 0.156±0.019**0.179±0.015△△ 0.201±0.020△△ 0.239±0.018△△血塞通大剂量组 8 0.152±0.013** 0.179±0.013**△△ 0.204±0.015**△△血塞通小剂量组 8 0.161±0.014 0.187±0.012△△ 0.215±0.017*△△
3 讨论
缺血性脑血管病后,中枢神经功能的重建一直是影响脑科学领域发展的最重要的问题之一。原因在于中枢神经系统的环境中既存在着营养因子,又存在着阻止神经的抑制因子。近年来研究已经证实在中枢神经功能的重建过程中存在着多种神经生长抑制因子,其中Nogo-A具有很强的轴突生长抑制作用,被认为是阻止中枢神经再生的关键因素[2-3]。Nogo-A由少突胶质细胞表达的整合膜蛋白,在成年哺乳动物中主要存在与中枢神经系统[4]。早在80年代,已经有学者开始陆续发现动物体内的相关蛋白,但直到2000年,由Chen、Prlnjh 等人了首先克隆出了 Nogo 基因[5]。该基因的发现对于缺血性脑血管病的治疗具有重要意义。在近年来的缺血性脑疾病的研究中,如何通过药物、基因以及生物学手段,解除该基因的抑制作用,成为缺血性脑疾病后促进轴突生长和重塑神经功能的热点方向。
本实验的线栓法大鼠中动脉阻塞(MCAO)模型目前应用最广泛,多年来,国内外研究者对其进行了很多研究、改进,使其成为一种比较稳定、可靠、能反映人类脑缺血疾病的动物模型。该模型相比开颅操作等其他方法具有创伤小,操作简便的优势,但是模型的最关键步骤是在非直视情况下完成的,因为对于实验材料的选择具有较高的要求。其中最关键的因素为动物的体重选择与线栓的插入尺寸。目前报道300g左右的大鼠应使用直径0.25 mm的插线,自颈总动脉分叉处插入18±5 mm[6-7]。
血塞通主要成分为三七总皂苷,中药三七活血化瘀、化瘀而不伤正气。血塞通对脊髓损伤、脑出血、脑缺血后受损神经元有保护作用,已经在临床广泛应用[7-8]。本实验结果显示,血塞通组在术后的精神状态、活动度均较同时间点模型组有所改善,在从恢复时间上更快,而且术后脑部梗死范围较小,组织结构更完整,提示了血塞通对于大鼠脑缺血后对脑组织具有更好的保护作用;模型组7、14、28 d的海马Nogo-A的表达持续增高,均显著高于正常组,而各药物组Nogo-A的表达均低于模型组,其中血塞通大剂量组、尼莫地平组在给药后7、14、28 d的海马Nogo-A的表达均显著低于模型组具有非常显著性差异,提示Nogo-A可能在脑缺血早期即发挥其抑制轴突再生的作用,而其长时间的高水平表达可能是脑损伤后神经元再生困难的原因之一,而血塞通可以下调Nogo-A的表达,这可能是血塞通能够促进脑梗死后神经功能恢复的原因之一。而且血塞通大剂量组在降低Nogo-A基因表达方面具有更明显的作用。根据实验结果可以看出,血塞通在术后促进细胞生长、组织结构重建以及脑功能恢复方面具有较好的效果,为今后的临床应用提供实验依据。
[1]Longa EZ,Weinstein PR,Carlson S,et,al.Reversible middle cerebralarteryocclusionwithoutcraniectomyinrats[J].Stroke,1989,20(1):84-91.
[2]Pernet V,Schwab ME.The role of Nogo-A in axonal plasticity,regrowth and repair[J].Cell Tissue Res,2012,349(1):97-104.
[3]Wang T,Xiong JQ,Ren XB,et,al.The role of Nogo-A in neuroregeneration:a review[J].Brain Res Bull,2012,87(6):499-503.
[4]杨晓梅,周长满.Nogo-A蛋白的研究进展[J].神经解剖学杂志,2004,20(3):319-321.
[5]Chen MS,Huber AB,Vanderhaar ME,et al.Nogo-A is a myelin-associat ed neurit e out growthinhibitor and anantigen for monoclonal antibody IN-1[J].Nature,2000,403(6768):434.
[6]刘玉和,于春荣.线栓法制备大鼠局灶性脑缺血模型的研究[J].北华大学学报:自然科学版,2007,8(1):41-45.
[7]王席玲,邹忆怀,翟建英,等.三七三醇皂苷对MCAO大鼠BDNF和TrkB表达的影响[J].北京中医药大学学报,2008,31(2):102-105.
[8]杨挺,蒋赞利,茅祖斌.血塞通在中枢神经系统疾病中的应用[J].现代医学,2010,38(1):86-89.
