rFN/CDH-BCP组织工程骨的制备和体内融合效应的初步研究
2013-09-27王加旭刘明华第三军医大学西南医院急救部新桥医院骨科重庆400038
向 强,崔 翔,王加旭,刘明华 (第三军医大学:.西南医院急救部;.新桥医院骨科,重庆 400038)
双嗜性分子重组纤维连接蛋白/钙粘附蛋白(recombinant fibronectin/cadherin chimera,rFN/CDH)实现了对FN和CDH11功能学的叠加[1],本实验把该融合蛋白引入双相钙磷陶瓷(Biphasic calcium phosphate ceramic,BCP)表面复合bMSCs制备组织工程骨,利用细胞离心粘附实验、MTT实验和成骨诱导分化等方法观察骨种子细胞的粘附和分化,并把其应用于兔腰椎横突间植骨融合,观察融合部位新骨生成状况及种子细胞分布、转归状况,为该组织工程骨的临床研究和应用提供实验依据。
1 材料与方法
1.1 主要试剂与材料
rFN/CDH融合蛋白(实验室自备),方法见文献[1],多孔双相钙磷陶瓷(prous BCP)购于四川大学,DMEM/F12培养基,DTBP双官交联剂,MTT,胎牛血清,胰蛋白酶,TEMED,Trypsin,购于美国Sigma公司,ALP检测试剂盒,细胞钙含量检测试剂盒(ARⅢ)),钙结节染色试剂盒(茜素红)购于南京建成生物材料有限公司。
1.2 bMSCs的分离和培养
选取健康7 d新西兰大白兔仔兔(购于第三军医大学实验动物中心),收集双侧股骨干骺骨髓3 mL,采用密度梯度离心贴壁筛选法。离收集细胞,加入percoll细胞分离液,收集白膜层的单个核细胞,洗涤、离心后加入DMEM/F12培养基重悬细胞,按105~106/mL的密度接种于无菌50 mL培养瓶内。在37℃、50%CO2、饱和湿度恒温细胞培养箱内培养24 hr换液弃去未贴壁细胞,加入DMEM/F12培养基在37℃、50%CO2、饱和湿度恒温细胞培养箱内连续培养。倒置像差显微镜下观察细胞生长情况,每2~3 d换液1次,待细胞生长至3~6代、融合率达70%~80%时即可用以成骨诱导分化实验。
1.3 bMSCs复合 rFN/CDH-BCP
将生长至第3代、融合率达70% ~80%的bMSCs以0.25%胰蛋白酶消化成细胞悬液,计数、离心,制成密度为107/mL的单细胞悬液。将rFN/CDH-BCP平铺于12孔板塑料小皿底部,以每孔1 mL单细胞悬液(1×107个细胞/孔)加入各孔rFN/CDH-BCP表面,在37℃、50%CO2、饱和湿度恒温细胞培养箱内培养过夜,使细胞充分贴附于rFN/CDH-BCP表面。
1.4 动物模型建立
选取健康成年新西兰大白兔16只(购于第三军医大学实验动物中心,雌雄不限),麻醉成功后消毒铺巾,定位L4~L5间隙,后正中切口切开皮肤全层暴露至椎旁2~3 cm,暴露L4、L5横突,打磨制备植骨床。每组随机选取8只大白兔,分别将单纯BCP材料(BCP植入组)或bMSCs复合rFN/CDH-BCP材料(bMSCs-BCP组织工程骨组)植入骨床处。术后3 d每日注射青霉素钠40万单位,每日2次。
1.5 指标检测
bMSCs复合rFN/CDH-BCP 24 h后,利用MTT实验、扫描电镜、荧光染色等方法观察骨种子细胞的粘附、增殖和分化。利用X线影像学和组织学技术观察融合部位新骨生成状况及种子细胞分布、转归情况。
1.5.1 bMSCs增殖率和活力检测 将BCP界面消毒、预湿后,置于96孔细胞培养板,取bMSCs单细胞悬液(第3~6代),以每孔2 000的初密度接种于96孔培养板,37℃、5%CO2、适度饱和的培养箱中培养1~9 d,隔日换液1次;每日行MTT检测,酶标仪检测并记录各孔OD值(检测波长570 nm)。
1.5.2 描电镜观察 在rFN/CDH-BCP界面上将300μl bMSCs细胞悬液以1 000/片的初密度接种,复合24 h,持续培养48 h后取出载有bMSCs的rFN/CDH-BCP,经PBS液漂洗后3%戊二醛固定2 h,梯度酒精脱水,真空干燥8 h,真空镀膜仪喷金镀膜后SEM检测观察。
1.5.3 荧光染色 加入0.5mg/mL的Hoechst 33342母液培养至3~6代,密度为105/mL的bMSCs单细胞悬液,避光冰浴20 min,细胞标记后细胞以100 μl/孔的体积(104个细胞/孔)加入96孔培养板各孔BCP表面,避光,胰酶消化,记录各孔荧光强度,置于细胞培养箱贴壁2~4 hr,荧光倒置显微镜观测记录,并用Viewfinder图像分析软件分析。
1.5.4 rFN/CDH-BCP界面细胞ALP活性测定 取各组诱导培养10 d的hMSCs,消化、离心、收集,加入细胞裂解液,吹打混匀,反复 -70℃急冻和37℃融化3次,超声破碎,离心12 000 r/min,1℃低温离心15 min,收集上清检测。
1.5.5 rFN/CDH-BCP界面细胞钙结节染色 采用茜素红法,取诱导培养14 d的hMSCs制成单细胞悬液(1×105/mL),加入DMEM/F12培养基,7 d后弃培养液,依次进行GENMED固定,清理、染色,脱水,澄清,最后加入GENMED透亮液,光镜下观察。
1.5.6 X线观察 术后1 d、1个月、3个月将兔麻醉后俯卧位、侧位摄片,拍摄X线片,判断各组材料在体内成骨趋势和融合情况、对比成骨差异。
1.5.7 组织学检测 动物处死后,完整留取实验融合部位组织块,置入中性福尔马林溶液中固定72 h,梯度酒精脱水,MMA包埋,硬组织切片机切片,HE染色和甲苯胺蓝染色。
1.6 统计学分析
利用SPSS 13.0软件统计学分析,计量资料以均数±标准差()的形式表示,采用独立样本t检验分析各组有无统计学差异及其有效性,P<0.05为显著统计学差异。
2 结果
2.1 骨髓间充质干细胞的形态学观察
倒置显微镜下骨髓间充质干细胞的形态学观察:原代bMSCs培养72 h换液后,即可观察到贴壁细胞,细胞形态短小,呈长梭型、纺锤形,培养至7 d,细胞明显增多、变长、变大,长梭型、纺锤形形态更加明显,14 d时,细胞基本铺满皿底,细胞排列呈螺旋状或漩涡状。传代培养中,细胞基本保持长梭型的形态(图1)。

图1 骨髓间充质干细胞的形态学观察
2.2 bMSCs增殖率和活力的测定
bMSCs与rFN/CDH-BCP复合7 d内测定细胞活力,绘制bMSCs增殖曲线图显示:rFN/CDH-BCP界面的增殖率和细胞活力在前7 d的培养时间内,明显高于阴性(BCP组)和阳性(FN-BCP组,CDH-BCP组)对照组(P<0.05),表现为 MTT还原产物溶液的吸光度显著高于对照组,7 d以后各组吸光度无明显差异(图2)。
2.3 扫描电镜观察结果
扫描电镜观察显示,在hMSCs与rFN/CDH-BCP复合界面有大量细胞粘附,细胞充分伸展充分,呈多边形状或圆盘状,伪足样结构减少,形成致密的板层样结构覆盖在材料表面,如图中箭头所示。在单纯BCP界面,细胞伸展不良,呈条索状,可见大量伪足样结构深入材料孔隙内(图3)。
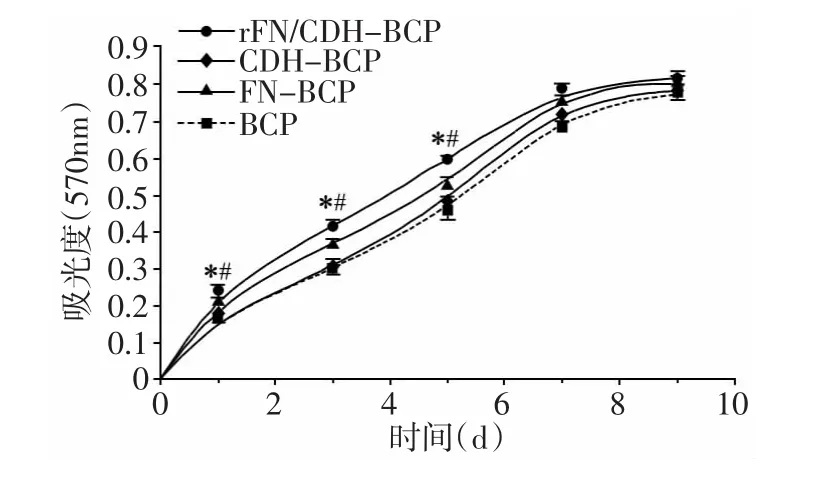
图2 bMSCs增殖曲线图

图3 rFN/CDH-BCP界面对hMSCs生长形态的影响
2.4 bMSCs粘附性测定。
细胞离心粘附实验显示在rFN/CDH-BCP界面,随着rFN/CDH密度的增加,粘附的细胞数亦逐渐增多。rFN/CDH-BCP表面明显优于阳性对照CDH-BCP和FN-BCP组,同时荧光显微镜下观测也发现了相同的结果(图4)。
2.5 rFN/CDH-BCP界面ALP活性测定
ALP活性测定显示在rFN/CDH-BCP表面的ALP活性表现最高,显著高于阴性对照和阳性对照组,提示复合了bMSCs的rFN/CDH-BCP组织工程骨的成骨活性增强(图5)。
2.6 rFN/CDH-BCP界面细胞钙结节染色
茜素红法检测成骨诱导后向细胞间钙结节形成情况显示,各组细胞间均有卵圆形、橘红色均染的结节斑,以rFN/CDHBCP表面细胞形成最多,分布最广,提示复合了bMSCs的rFN/CDH-BCP组织工程骨能促进bMSCs的成骨分化(图6)。

图4 bMSCs在不同BCP处理表面粘附测定

图5 bMSCs在不同处理因素BCP表面的ALP活性变化

图6 bMSCs在不同处理因素BCP表面的钙结节形态(茜素红染色后钙结节差异性表达)
2.7 X线检测
术后3个月X线检测显示,单纯BCP移植组与横突间未见明显愈合,BCP材料依然清晰可见。bMSCs+rFN/CDH-BCP组织工程骨移植组横突间及周围已形成大量纤维骨痂结构,材料与横突周围骨质融为一体,界限模糊(图7)。

图7 组织工程骨植入后横突间腰椎融合的X线放射学评价
双盲法评估融合动物数量和横突间隙骨痂填充率结果显示:bMSCs复合rFN/CDH-BCP组织工程骨移植组达到100%融合率,单纯BCP移植组融合率为40%。组织工程骨移植组横突间隙的骨痂填充率也明显优于BCP组(P<0.01),提示其诱导新骨形成的能力增强(表1)。
表1 影像学表现下定量评估体内骨愈合效果(,n=5)

表1 影像学表现下定量评估体内骨愈合效果(,n=5)
*:与 BCP 组比较,P <0.01
2.8 组织学观察
组织学观察显示,单纯BCP植入组材料-骨床交界区以软骨组织为主,新生骨成熟度较低,材料与骨床间无骨性融合和钙化,组织学分级以软骨组织为主。bMSCs复合rFN/CDH-BCP组植入组织学表现为融合区域出现成熟度较高的骨小梁交错性桥接与材料融为一体,HE和甲苯胺蓝染色均有特征性表现,显示成骨能力显著强于单纯BCP植入组(图8)。

图8 复合bMSCs的rFN/CDH-BCP和单纯BCP植入3个月的组织学观察
3 讨论
目前多样化的骨替代材料,尤其是组织工程材料表现出了一定的临床应用前景,但由于材料本身特性单一,缺乏特定的结构和分子信号,影响了细胞粘附到材料上的效率,并由此限制了随后的材料-组织界面的骨诱导和骨生成作用[2]。为尝试解决这一难题,我们把兼有纤维连接蛋白(fibronectin,FN)和钙粘附蛋白(Cadherin,CDH)功能特点的双嗜性rFN/CDH融合蛋白引入多孔的双相钙磷陶瓷(Biphasic calcium phosphate ceramic,BCP)表面,以期获得一种在体外具有高效粘附性和良好促进骨种子细胞成骨分化潜能的生物界面,并对其实际应用价值进行评估。
细胞在材料界面的粘附与细胞迁移、增殖、分化,基质沉积、血管芽生成,材料降解等息息相关[3],细胞在材料表面的粘附特性是衡量材料生物相容性的一个重要指标。在实验中,我们采用离心促粘附实验检测了bMSCs在rFN/CDH-BCP界面的粘附状况。离心促粘附实验是通过适当的离心力促进细胞与材料的结合/脱离,用荧光标记的方法对有效粘附的细胞进行计数,具有准确、简捷、可控、假阳性率低的优势[4]。结果表明在BCP界面上粘附的hMSCs数量与rFN/CDH的密度成正相关,明显高于单纯BCP和FN、CDH修饰的BCP界面,证实了rFN/CDH修饰后的BCP界面对bMSCs的粘附能力明显增强。
单纯BCP材料对于细胞增殖无明显影响[5],为验证bMSCs在rFN/CDH-BCP界面的活力和增殖能力,我们采用了MTT检测法,MTT代谢产物的量与细胞数量和活力呈正相关。实验结果显示:rFN/CDH-BCP表面bMSCs的MTT代谢产物的量显著增加,明显高于单纯BCP材料组,提示bMSCs在rFN/CDH-BCP表面的增殖率和细胞活力明显优于单纯BCP材料。实验通过扫描电镜观察发现,在rFN/CDH-BCP材料的表面有大量bMSCs,细胞充分伸展充分,呈多边形状或圆盘状,伪足样结构减少,形成致密的板层样结构覆盖在材料表面。而单纯BCP表面bMSCs少,细胞伸展不良,呈条索状,可见大量伪足样结构深入材料孔隙,此结果有效地说明了rFN/CDH-BCP界面能增强种子细胞的活力和增殖能力。
ALP是成骨分化的早期标志物为,茜素红染色法检测成骨诱导后细胞间钙结节形成是评价成骨终末作用的有效指标[5]。实验结果显示rFN/CDH-BCP界面上bMSCs诱导10 d后ALP活力检测已明显增高,是单纯BCP组的8.7倍(P <0.05),由此说明rFN/CDH-BCP界面具有促进种子细胞早期成骨分化的作用。实验中把诱导21 d的bMSCs在体外继续培养7 d,检测成骨诱导后向细胞间的钙结节形成情况显示rFN/CDH-BCP表面的细胞间质中存在大量的橘红色钙结节,提示此时进入基质矿化期,表明rFN/CDH-BCP表面具有更强信号以促进分化成熟的成骨细胞矿化。
材料在生物体内是涉及成千上万的信号分子效应蛋白和一系列胞内和ECM级联反应的复杂过程[6],通过组织学检测则可对组织-材料界面上的基质矿化、骨质沉积和新骨形态进行全面的了解[7]。把复合bMSCs的rFN/CDH-BCP组织工程骨用于兔腰椎横突间融合术后取材,X线检测显示,单纯BCP移植组与横突间未见明显愈合,BCP材料依然清晰可见。bMSCs+rFN/CDH-BCP组织工程骨移植组横突间及周围已形成大量纤维骨痂结构,材料与横突周围骨质融为一体,界限模糊为。组织学切片发现单纯BCP植入组材料-骨床交界区以软骨组织为主,新生骨成熟度较低,材料与骨床间无骨性融合和钙化,组织学分级以软骨组织为主。bMSCs复合rFN/CDH-BCP组植入组织学表现为融合区域出现成熟度较高的骨小梁交错性桥接与材料融为一体,HE和甲苯胺蓝染色均有特征性表现,显示成骨能力显著强于单纯BCP植入组。实验结果显示,bMSCs+rFN/CDH-BCP组织工程骨具有促进成骨细胞粘附和成骨的良好生物学效应,在体内表现出了良好的骨传导和骨诱导特性,是一种有广阔应用前景的骨修复材料。
[1]Zhang Y,Zhou Y,Zhu J,et al.Effect of a novel recombinant protein of fibronectinIII7-10/cadherin 11 EC1-2 on osteoblastic adhesion and differentiation[J].Biosci Biotechnol Biochem,2009,73(9):1999 -2006.
[2]Green DW,Watson GS,Watson J,et al.New biomimetic directions in regenerative ophthalmology[J].Adv Healthc Mater,2012,1(2):140 -148.
[3]Krauss Juillerat F,Borcard F,Staedler D.Functionalization of microstructured open-porous bioceramic scaffolds with human fetal bone cells[J].Bioconjug Chem,2012,23(11):2278 -2290.
[4]Reyes CD,García AJ.A centrifugation cell adhesion assay for highthroughput screening of biomaterial surfaces[J].J Biomed Mater Res A,2003,67(1):328 -333.
[5]Li B,Chen X,Guo B,et al.Fabrication and cellular biocompatibility of porous carbonated biphasic calcium phosphate ceramics with a nanostructure[J].Acta Biomater,2009,5(1):134 - 143.
[6]Fini M,Giavaresi G,Torricelli P,et al.Osteoporosis and biomaterial osteointegration[J].Biomed Pharmacother,2004,58(9):487 -493.
[7]Magit DP,Maak T,Trioano N,et al.Healos/recombinant human growth and differentiation factor-5 induces posterolateral lumbar fusion in a New Zealand white rabbit model[J].Spine(Phila Pa 1976),2006,31(19):2180-2188.
