亚低温减轻沙土鼠海马前脑缺血再灌注损伤和对Hsp70表达的影响*
2013-09-26陈秀侠滕大才胡忠浩
陈秀侠,滕大才,李 军,胡忠浩
(1.徐州医学院附属医院麻醉科,江苏徐州 221002;2.徐州医学院神经生物学研究室,江苏徐州 221002;3.温州医学院附属第二医院麻醉科,浙江温州 325027)
热休克蛋白70(Hsp70)是细胞在应激状态下产生的保护因子,能够保护神经细胞的能量供应和神经递质的传递,减少缺血坏死范围,抑制细胞凋亡等[1],在脑缺血再灌注中发挥了保护作用。亚低温在大量的动物实验研究中证实对脑缺血有显著的保护作用并逐渐应用于临床[2-3],但其脑保护的机制仍不十分清楚。本研究旨在通过动态观察Hsp70在脑缺血后及亚低温处理后的沙土鼠海马CA1区的表达,探讨Hsp70和亚低温脑保护的关系。
1 材料与方法
1.1 材料
1.1.1 动物分组 蒙古沙土鼠由徐州医学院实验动物中心提供,雌雄不拘,体质量50~80g。实验前在22~25℃实验室中饲养1~2d以适应实验室环境。随机分为4组:假手术组(SH组),分离双侧颈总动脉但不阻断,维持正常体温(37±0.5)℃;假手术低温组(HSH组),手术同SH组,5min后鼓膜温度降至(33±0.5)℃,持续4h;再灌注常温组(IR组),应用无创微动脉夹夹闭双侧颈总动脉5min,松开动脉恢复脑血流灌注,再灌注时维持正常体温;再灌注低温组(HIR组):缺血5 min再灌注即刻降温,10min内鼓膜温度降至(33±0.5)℃并维持4h。每组30只,根据缺血再灌注后的不同时间点各组再分为再灌注2h、4h、1d、3d、5d亚组(每亚组n=6)。4组中SH组、HSH组相对于其他两组为对照组,只有IR组、HIR组有脑缺血再灌注过程。
1.1.2 制备模型 沙土鼠戊巴比妥钠40mg/kg腹腔注射麻醉后,俯卧位下在前囟后2mm、矢状缝外2mm处,置入电极,固定,接多功能脑电监护仪监测脑电图。后仰卧位下切开颈部正中皮肤,分离双侧颈总动脉,用无创微动脉夹夹闭血流造成前脑缺血,5min后松开动脉夹恢复脑血流再灌注。缺血模型制备成功标志是双侧颈总动脉夹闭后1min内脑电图成等电位,并剔除未成等电位的动物。将动物置于流动空气浴箱中,用冰块降温或灯泡加热的方法维持动物鼓膜温度在所需温度。
1.2 方法
1.2.1 行为学观察 沙土鼠行为学变化用开阔法测定[3]。所用观察木箱为76cm×72cm×57cm,箱底均分为25小格。由同一不知情的实验员单独在周围环境条件一致的同一房间内进行观察计数。将沙土鼠在再灌注后1、3、5d时间点放入木箱,记数动物10min爬行的格子数。
1.2.2 组织形态学观察 在预定时间点,沙土鼠腹腔注射戊巴比妥钠60mg/kg,麻醉后开胸,经主动脉灌注生理盐水50 mL,继以灌注10%的中性甲醛100mL,断头取脑,冠状切面切开视交叉后1mm及4mm处,取中间块在相同固定液中固定10d,石蜡包埋。在海马齿状互包平面连续冠状切片,片厚4 μm。切片进行原位末端转移酶标记法(TUNEL)细胞凋亡检测。采用细胞凋亡原位检测试剂盒In Situ Cell Detection Kit,cp试剂盒染色(德国宝灵曼公司),参照试剂盒方法并做部分修改,同时设立阳性(加脱氧核糖核酸酶I DNasel,1μg/mL)和阴性对照(不加末端脱氧核苷酸转移酶TdT)。高倍镜(40×10)计数海马CA1区中段1mm长范围内的凋亡细胞数。
1.2.3 免疫组织化学程序及图像分析 采用Sant Cruz公司的鼠抗Hsp70抗体,其稀释度为1∶100,北京中山生物技术公司的SP免疫组化试剂盒。阴性对照采用等稀释度的鼠抗IgG。详细操作方法见文献[4]。采用德国Leica公司的LEICA Qwin图像处理与分析系统对Hsp70免疫组织化学染色切片进行图像分析。取每张切片CA1区中1/3段测量平均灰度值,减去此片背景平均灰度值,取其相反数作为最终光密度值(OD)。
1.3 统计学处理 采用SPSS11.0统计软件,数据以表示,组间比较应用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 亚低温对沙土鼠缺血再灌注后行为学的影响 沙土鼠前脑缺血5min再灌注后1、3、5d的爬行格子数SH组与HSH组差异无统计学意义(P>0.05);IR组较SH组明显增加(P<0.05),分别是SH组的3.2、1.8、1.9倍。HIR组仅仅在再灌注后1d的爬行格子数较SH组增加(P<0.05),3、5d时比较差异无统计学意义(P>0.05);较IR组各时间点均减少(P<0.05),分别是IR组的46%、71%、65%。见表1。
2.2 亚低温对沙土鼠缺血再灌注后CA1区凋亡锥体细胞数的影响 未缺血沙土鼠CA1区无凋亡锥体细胞,IR组凋亡细胞较SH组明显增加(P<0.05);与IR组比较,HIR组各时间点凋亡细胞数分别减少85%、50%、41%(P<0.05)。见表2、图1。
2.3 亚低温对沙土鼠海马CA1区神经元Hsp70表达的影响 未缺血SH组及HSH组沙土鼠仅有极少量的Hsp70在海马CA1区神经元表达,亚低温对其没有明显影响,两组比较差异无统计学意义(P>0.05)。Hsp70在缺血再灌注2h时,表达没有增加;4h时IR组沙土鼠CA1区已经大量表达,至1d表达达高峰,3d时已经降低,5d时表达仍较高(各点与SH组相比,P<0.01)。HIR组4h时间点与IR组比较差异无统计学意义(P>0.05);1d后Hsp70表达急剧增加,至5d时表达仍维持在高水平,与IR组各时间点相比均显著增高(P<0.01)。见表3、图2。
表1 各组沙土鼠爬行的格子数的比较(,n=6)

表1 各组沙土鼠爬行的格子数的比较(,n=6)
273±73 289±46 269±66 IR组 864±84 520±168 515±137 HSH组 294±51 282±43 294±67 HIR组1d 3d 5d SH组组别402±74 368±34 339±45
表2 各组沙土鼠海马CA1区凋亡锥体细胞计数的比较(,n=6)

表2 各组沙土鼠海马CA1区凋亡锥体细胞计数的比较(,n=6)
1d 3d 5d SH组组别0 0 0 IR组 14.0±1.4 24.8±7.0 21.5±4.1 HSH组 0 0 0 HIR组2.2±1.3 8.3±3.0 12.6±4.8
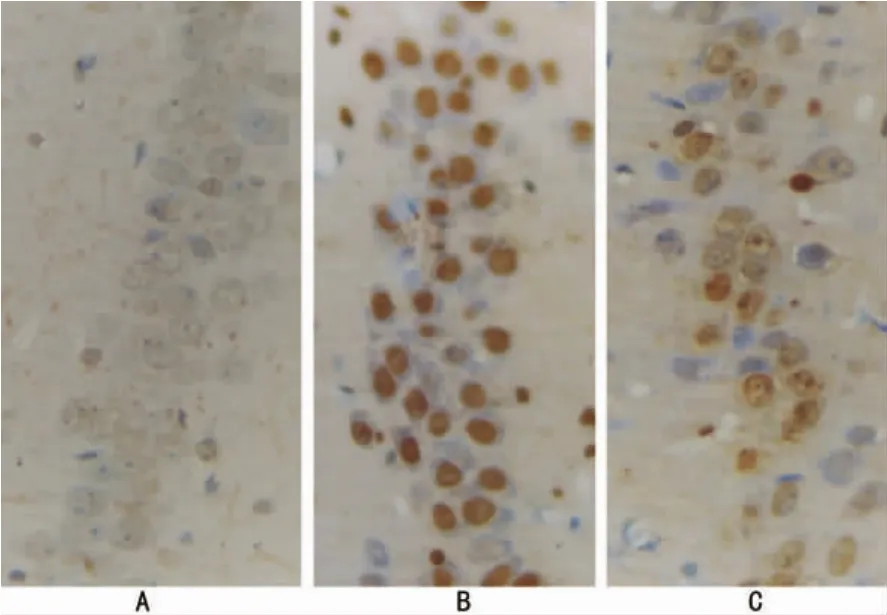
图1 沙土鼠海马CA1区再灌注3dTUNEL阳性细胞(×400)
表3 亚低温对前脑缺血沙土鼠海马CA1区神经元Hsp70蛋白表达OD的影响(,n=6)
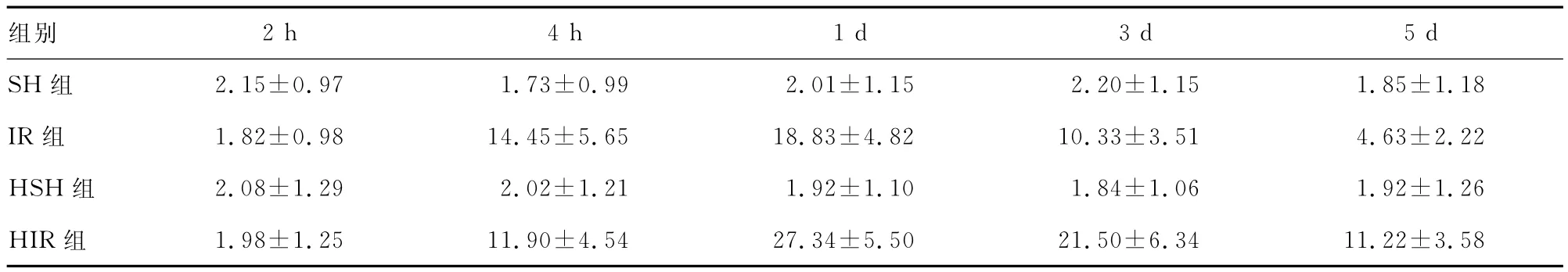
表3 亚低温对前脑缺血沙土鼠海马CA1区神经元Hsp70蛋白表达OD的影响(,n=6)
5±1.18 IR组 1.82±0.98 14.45±5.65 18.83±4.82 10.33±3.51 4.63±2.22 HSH组 2.08±1.29 2.02±1.21 1.92±1.10 1.84±1.06 1.92±1.26 HIR组 1.98±1.25 11.90±4.54 27.34±5.50 21.50±6.34 2h 4h 1d 3d 5d SH组 2.15±0.97 1.73±0.99 2.01±1.15 2.20±1.15 1.8组别11.22±3.58
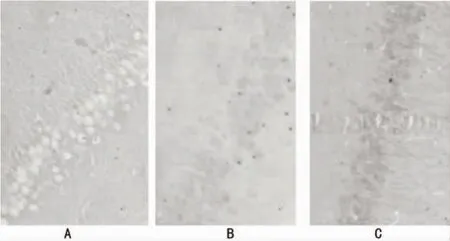
图2 沙土鼠海马CA1区再灌注3dHsp70免疫染色(×200,LEICA Qwin图像处理照片)
3 讨 论
开阔法迷宫是一种反映动物行为的实验方法,海马功能受损后动物空间定位和学习记忆能力下降,探索活动增加。本实验中前脑缺血5min沙土鼠再灌注5d内,各时间点爬行格子数均多于对应的SH组,给予亚低温处理4h后,其爬行格子数明显减少。神经细胞缺血再灌注后死亡的重要方式之一是凋亡,本实验中亚低温减少了沙土鼠脑缺血再灌注后CA1区的凋亡细胞数。
90年代中后期,江基尧等[5]将28~35℃轻中度低温定义为亚低温,发现对实验性脑缺血和颅脑外伤给予亚低温治疗,可以产生明确的神经保护作用。随后亚低温治疗这一概念被广泛引用,并逐渐应用于临床。亚低温可以通过降低缺血后脑细胞代谢、减少细胞能量的消耗、降低兴奋性氨基酸的释放、减少钙离子内流、抑制炎症反应、降低血管的通透性等减轻脑损伤后的脑水肿、降低颅内压促进神经细胞功能的恢复[6-7]。近年来,随着研究的深入,发现亚低温的脑保护机制涉及复杂的生物学级联反应。亚低温可以通过抑制凋亡因子Bax、半胱天冬氨酸蛋白酶-3的表达[8-9],抑制丝裂素活化蛋白激酶(MAPK)通路的磷酸化c-Jun N-末端蛋白激酶(p-JNK)的表达等通过多种途径抑制神经元的凋亡[3],产生脑保护作用,但是没有任何一个因素可以完全解释由低温所提供的脑保护作用,了解它的多方面的影响因素,可能揭示其重要的保护机制[10]。
正常情况下,Hsp70在细胞内有稳定的表达,并很快被降解,脑组织内 Hsp70的含量极少,在应激状态下,Hsp70的表达增加[11],能够防止各种应激刺激损伤大脑。Hsp70可以通过维持细胞内蛋白质的功能正常、促进有害物质如氧自由基等清除,减少神经元凋亡等发挥脑保护作用[12-14]。
对于脑缺血后亚低温对Hsp70的表达的影响,研究结果并不一致,张秀洲等[15]研究发现,亚低温减少Hsp70蛋白的表达,其不是通过诱导Hsp70的表达对脑缺血再灌注损伤起保护作用。本实验免疫组织化学检测显示5min脑缺血引起海马CA1区Hsp70表达明显增加,以再灌注后第1天表达最多,4h亚低温可使1d后的Hsp70表达显著增加,和Terao等[16],肇杰等[17]研究结果一致,但对于2h、4h亚组的表达没有影响,提示亚低温可能通过增加Hsp70表达,上调脑缺血再灌注后的内源性保护作用产生脑保护作用。
亚低温处理4h,可以增加沙土鼠前脑缺血再灌注1d后海马CA1区Hsp70的表达,改善其行为学表现,减少海马凋亡细胞。
[1]马波,张建军,刘耕陶.热休克蛋白与神经保护[J].中国药理学通报,2008,24(8):984-987.
[2]张劲松,孙昊.对我国亚低温治疗现状的认识[J].实用医院临床杂志,2012,9(1):31-33.
[3]Colbourne F,Corbett D.Delayed and prolonged post-ischemic hypothermia is neuroprotective in the gerbil[J].Brain Res,1994,654(2):265-272.
[4]陈秀侠,李军,武静茹,等.亚低温对前脑缺血再灌注损伤沙土鼠海马p-ERK、p-JNK水平的影响[J].中华麻醉学杂志,2007,27(2):144-148.
[5]江基尧,朱诚.国外亚低温与脑损伤的研究进展[J].国外医学:神经病学神经外科学分册,1993,20(1):4-6.
[6]Linares G,Mayer SA.Hypothermia for the treatment of ischemic and hemorrhagic stroke[J].Crit Care Med,2009,37(Suppl 7):S243-S249.
[7]Wu H,Jiang LD,Wrede KH,et al.Local hypothermia and optimal temperature for stroke therapy in rats[J].Chin Med J,2009,122(13):1558-1563.
[8]王军,熊利泽,王警卫,等.全身亚低温对大鼠全脑缺血再灌注后海马CA1区bcl-2,bax基因表达的影响[J].第四军医大学学报,2005,26(3):214-216.
[9]陈秀侠,李军,武静茹,等.亚低温对沙土鼠前脑缺血/再灌注海马CA1区神经元凋亡及Bcl-2、Caspase-3表达的影响[J].中国药理学通报,2007,23(1):77-81.
[10]Yenari MA,Han HS.Neuroprotective mechanisms of hypothermia in brain ischaemia[J].Nat Rev Neurosci,2012,13(4):267-278.
[11]Johannes G,Lassmann MH,Johansen FF.Anti-apoptotic signaling and failure of apoptosis in the ischemic rat hippocampus[J].Neurobiol Dis,2007,25(3):582-593.
[12]唐茜茜,袁倩,崔元孝,等.热休克蛋白70对脑出血大鼠神经细胞Bcl-2、Bax蛋白表达的影响[J].山东大学学报:医学版,2011,49(11):40-43.
[13]Zheng Z,Kim JY,Ma H,et al.Anti-inflammatory effects of the 70kDa heat shock protein in experimental stroke[J].J Cereb Blood Flow Metab,2008,28(1):53-63.
[14]Ouyang YB,Xu LJ,Sun YJ,et al.Overexpression of inducible heat shock protein 70and its mutants in astrocytes is associated with maintenance of mitochondrial physiology during glucose deprivation stress[J].Cell Stress Chaperones,2006,11(2):180-186.
[15]张秀洲,李文华,刘雪平.亚低温对大鼠脑缺血再灌注损伤后热休克蛋白70及胶质纤维酸性蛋白表达的影响[J].临床神经病学杂志,2006,19(2):112-114.
[16]Terao Y,Miyamoto S,Hirai K,et al.Hypothermia enhances heat-shock protein 70production in ischemic brains[J].Neuro Report,2009,20(8):745-749.
[17]肇杰,高红华.亚低温对大鼠急性局灶性脑缺血后脑组织内热休克蛋白70表达的影响[J].实用心脑肺血管病杂志,2006,14(2):101-103.
