菜薹小孢子培养诱导胚状体的影响因素研究
2013-09-24吴艺飞丁茁荑周晓波
吴艺飞,丁茁荑,肖 杰,周晓波,彭 淼
(1.湖南省蔬菜研究所,湖南 长沙410125;2.湖南省蔬菜工程技术研究中心,湖南 长沙410125;3.湖南农业大学园艺园林学院,湖南 长沙410128;4.湖南农业大学东方科技学院,湖南 长沙410128)
菜薹(Brassica compestris ssp.chinensis var.pupurea Hort.)为十字花科芸薹属白菜亚种的变种。通过常规杂交育种选育一个稳定、纯合的材料需要3~5 a,是一个耗工耗时的过程。而通过小孢子培养获得单倍体后进行人工加倍,只需一个世代就可获得纯合的二倍体,作为杂交育种的亲本材料,从而大大加速育种进程。因此,小孢子培养在菜薹遗传和育种中的应用越来越受到育种家的重视[1-2]。
试验采用前期试验筛选出的较易产生愈伤组织和胚状体的红菜薹、白菜薹两种类型8个不同基因型品种作为材料,对小孢子培养中小孢子密度、激素种类及浓度的配比、材料基因型、对胚状体诱导频率的影响,以及琼脂的浓度对胚状体再生植株的成苗率的影响进行了系统的研究,以期能进一步优化菜薹小孢子培养技术,提高胚状体诱导率和再生植株成苗率,为以后培育大量花培植株构建DH群体,进行遗传性状筛选、分子标记、遗传图谱和基因定位研究等奠定基础。
1 材料和方法
1.1 试验材料
供试材料红菜薹,分别为H09-1、H09-2、H09-3、H09-4,白菜薹,分别为B09-1、B09-2、B09-3、B09-4,总共8份材料,由湖南省蔬菜研究所菜薹课题组提供。所有材料均于2011年12月播于大棚苗床中,2012年2月移栽至温室中,人工调控最适温度和湿度,加强肥水管理,促进植株壮苗。2012年3月中下旬进入花期后开始进行试验,注意及时打顶,以促进侧枝的萌发和新花芽的形成,延长供体植株的花期和取样时间。
1.2 试验方法
1.2.1 小孢子培养方法(1)花蕾的采集、处理和灭菌。从菜薹现蕾开始,于上午9:00以前用镊子采摘各不同品种的花蕾放入自封塑料袋中(为减少试验误差,每一品种花蕾摘自4个不同株系的花蕾混合),装入冰盒带回实验室。摘去已经开放或花萼开裂的花蕾,其余装入玻璃瓶中置于4°C冰箱中低温预处理24 h。将经过低温预处理的花蕾去除过大和过小的以及表面有损伤开裂的花蕾,只留2.5~3.5mm左右的花蕾,其花瓣为花药的1/2~4/5(经镜检此时小孢子大都处于单核早期或单核靠边期)。花蕾先用70%酒精消毒15 s,再用0.1%升汞灭菌15 min后,用无菌水漂洗5次,洗净升汞残液,备用。
(2)花蕾的研磨、小孢子的收集与分装。将灭菌后的花蕾放入研钵中,加入5 mL B5-13(1968年B5培养基,蔗糖浓度为13%,pH值5.8,121°C下灭菌25 min)洗涤溶液,用玻璃棒轻轻挤压花蕾,使小孢子游离到洗涤液中,用200目尼龙网筛过滤去花蕾组织碎片,再加5 mL新鲜洗涤液冲洗研钵和滤网,收集小孢子悬浮液,将其移入10 mL离心管中,经800 r/min离心4 min,倒去悬浮液留小孢子,再加5 mL B5-13洗涤液后离心留小孢子,最后将收集的小孢子加入适量的NLN-13(1987年NLN培养基,蔗糖浓度为13%,pH值5.8,0.45μm滤膜过滤灭菌)培养液,用血球计数板调整至需要的小孢子浓度,最后分装至无菌培养皿(Φ60 mm)中,每皿装小孢子悬浮液4 mL,用Parafilm封口。
(3)胚状体诱导。将装有小孢子的培养皿置于33°C高温下热激处理24 h,而后转至25°C室温黑暗条件继续静置培养,直至出现肉眼可见的胚状体。培养30 d后统计胚状体数目。
(4)植株再生。产生的胚状体依次经过球形、心形、鱼雷形、子叶形。胚状体的出现具有不同步性,同一培养皿中可观察到各个不同形态的胚状体。当胚龄为20~30 d时,将培养皿从黑暗环境中拿出,放在弱光下培养1~2 d,待胚状体转绿后再将子叶形胚状体转入无激素的MS培养基中,置于1 500 lx光强下,每天光照12 h,25°C培养。培养7~10 d后,大部分子叶形胚可分化成绿芽,25~30 d待绿芽长出3~4片真叶后,将小植株转入生根培养基MS+NAA 0.1 mg/L中诱导生根,长成完整的植株。
1.2.2 试验设计 (1)不同基因型对小孢子出胚的影响。以8种基因型菜薹为试材,将小孢子浓度调整到2×105个/mL,接种在添加1.0 mg/L 6-BA和0.4 mg/LNAA的NLN-13液体培养基中,每处理接种5皿,3次重复。30 d后统计不同基因型菜薹小孢子的出胚率。
(2)不同小孢子浓度对胚状体诱导的影响。设置4个小孢子浓度梯度:1×105、2×105、3×105、4×105个/mL。接种在不添加激素的NLN-13的液体培养基中,每处理接种5皿,设3次重复。30 d后统计出胚情况。
(3)激素种类和浓度的配比对胚状体诱导的影响。以NLN-13为基本培养基,以H09-1和B09-1为试材,采用两因素多水平试验,考察两种激素6-BA(0、0.5、1.0、1.5 mg/L)和NAA(0、0.2、0.4 mg/L)的浓度配比对胚状体诱导的影响。每处理接种30个花蕾,3次重复,30 d后统计出胚情况。
(4)琼脂浓度对胚状体再生成苗的影响。设置4个琼脂浓度梯度:6、8、10、12g/L,以MS为基本培养基,不添加激素,添加0.5 g/L活性炭,蔗糖30 g/L,考察琼脂浓度对胚状体再生成苗的影响。
1.2.3 数据分析 试验数据采用SAS数据处理系统进行分析。
2 结果与分析
2.1 不同基因型菜薹对小孢子出胚率的影响
表1可知,不同基因型对小孢子出胚的影响非常大,各基因型出胚率差异显著或极显著。供试的4个红菜薹品种有2个诱导出胚,诱导率为50%,出胚率最高的是H09-1,平均产胚为1.11个/蕾,单皿最高产胚为21个;品种H09-2次之,小孢子胚诱导率为0.75个/蕾;而供试的4个白菜薹品种中也有2个诱导出胚,诱导率为50%,出胚率最高的是B09-1,为0.51个/蕾。B09-4为B09-1和B09-3的杂交F1代,出胚率为0.15个/蕾。H09-3、H09-4、B09-2、B09-3均未诱导出胚。
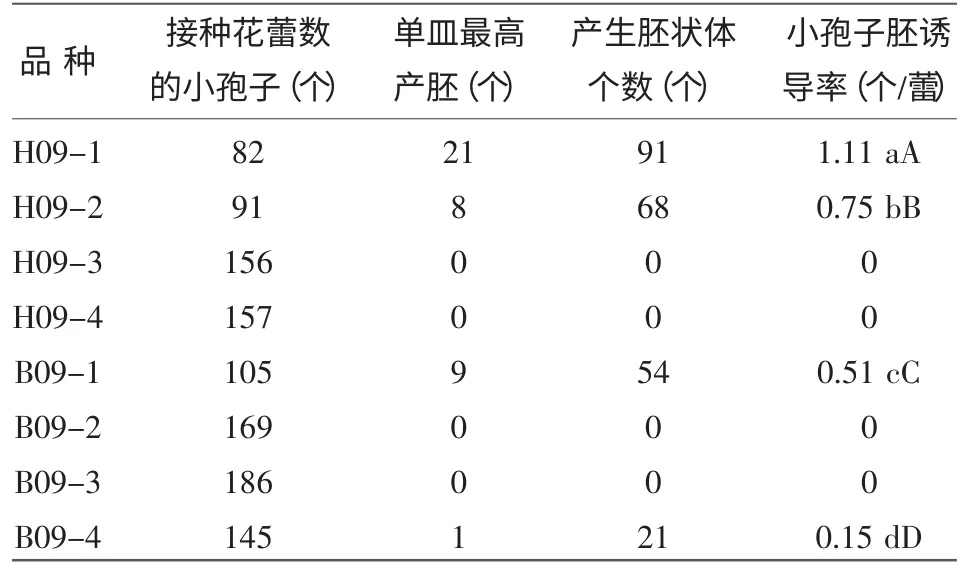
表1 不同基因型菜薹对小孢子出胚率的影响
2.2 不同小孢子浓度对出胚率的影响
由图1可知,小孢子浓度与胚状体出胚率关系密切,浓度过高或过低均不利于胚状体的发生。从供试的4个品种来看,在一定的范围内,随着小孢子浓度的升高,胚状体的发生也呈现上升趋势,当小孢子浓度为2×105个/mL时,产生的胚状体数均达到最高值;之后即使再增加小孢子浓度(3×105、4×105个/mL),小孢子胚状体诱导率反而有下降的趋势。因此,菜薹小孢子培养最适宜的小孢子浓度为2×105个/mL。
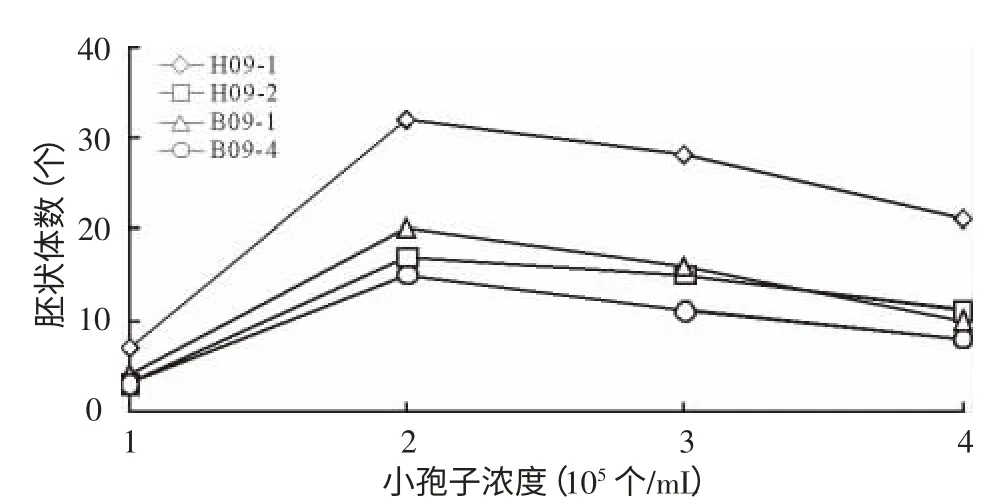
图1 小孢子浓度对小孢子出胚率的影响
2.3 激素种类和浓度配比对胚状体诱导的影响
由表2可知,激素种类和浓度配比与胚状体诱导率密切相关。6-BA和NAA的浓度和配比对菜薹小孢子培养胚状体诱导影响很大,各处理差异显著。所有组合均可以诱导出胚状体,6-BA对胚状体诱导率、子叶形胚产率以及畸形胚比例的影响比NAA大,在一定范围内随着6-BA浓度升高,胚状体的数目也随之增长,但畸形胚的比率也出现上升的趋势;NAA在一定范围内随着浓度的升高,胚产量有小幅的增长,但增幅没有6-BA大,随着NAA浓度的升高,子叶形胚占的比重有所增长,畸型胚比例下降,但浓度过高会抑制胚状体的发生。总的来说,1.0 mg/L 6-BA+0.4 mg/L NAA是菜薹小孢子培养最适的胚状体诱导培养基激素组合。
2.4 琼脂浓度对胚状体再生成苗的影响
表3看出,琼脂浓度与胚状体再生成苗率关系密切,各处理差异均达显著和极显著水平。当琼脂含量为6 g/L时,胚状体的再生成苗率非常低,两个品种都在10%左右。琼脂的含量在10 g/L时胚状体的成苗率最高,品种H09-1和B09-1的成苗率分别为66.7%和65%,是琼脂含量为12 g/L的处理的1.5倍,是琼脂含量为8 g/L的2倍。因此,最适的培养基琼脂含量在8~10 g/L为宜,胚状体成苗率最高。
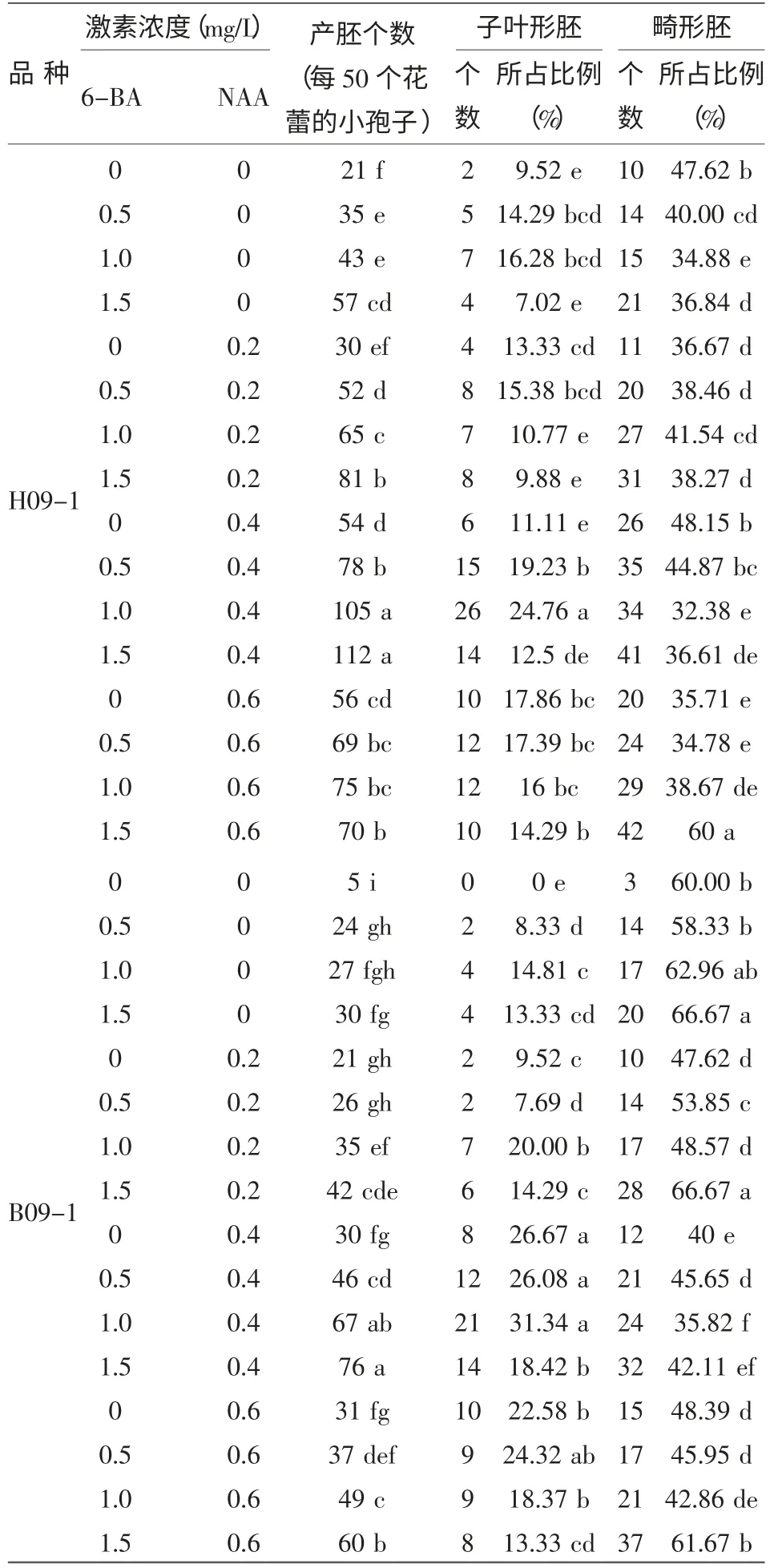
表2 激素种类和浓度的配比对小孢子出胚率的影响
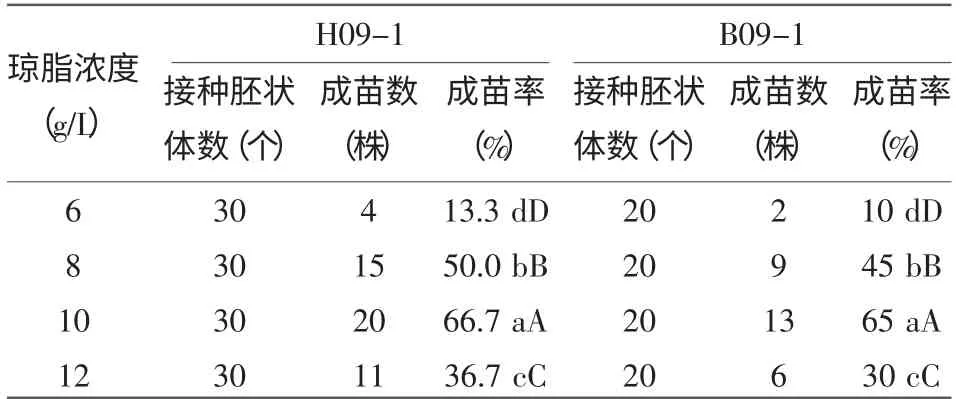
表3 琼脂浓度对胚状体成苗的影响
3 小结与讨论
3.1 基因型与胚状体的诱导
材料的基因型的差异是影响菜薹小孢子培养出胚率的主要因素,这一现象在其他蔬菜小孢子培养中普遍存在[3-4]。在供试的8份不同基因型材料中,只有4份材料诱导出了胚状体,其他4份材料即便采取了很多措施仍然无法诱导出胚,这说明是基因型的差异导致的结果。试验发现,通过将出胚率低的品种与出胚率高的品种杂交之后,取其F1代的花蕾再进行小孢子培养,其出胚率会得到提高。笔者认为这可能是由于出胚率高的品种及其后代的基因中携带有这种控制出胚的基因,且这种基因是呈显性遗传的。
3.2 小孢子浓度与胚状体的诱导
小孢子培养时小孢子浓度的高低对胚状体的诱导有一定的影响。浓度过高或过低均不利于小孢子胚的发生。试验中4个基因型的研究结果均表明,菜薹小孢子培养最适宜的小孢子浓度为2×105个/mL,低于这一浓度胚状体产生大大降低,笔者认为这可能是由于小孢子胚发育过程中,小孢子之间会产生一种相互促进的物质,这种物质也需要小孢子达到一定浓度才会产生的密集效应;而当小孢子浓度过高时,小孢子间相互争夺生存空间和营养物质,胚状体产率反而下降,也可能是由于小孢子发育过程中会分泌一些有害物质,这些有害物质积累到一定程度反而造成胚产率的下降,这有待进一步研究。
3.3 激素种类和浓度配比与胚状体的诱导
小孢子培养时,通过向培养基中添加适当的激素对胚状体的诱导有一定的增效,这一措施在很多作物小孢子培养中都有运用。国内外的学者添加的激素多为2,4-D、KT、6-BA、NAA,因材料的基因型不同,添加的激素种类和浓度不尽相同,需通过多次试验来确定最佳的激素种类和浓度的配比[5-6]。
试验结果表明在一定范围内添加不同的激素种类和浓度,其胚状体诱导率均不同。6-BA对胚状体诱导率的影响比NAA大,6-BA的作用主要表现在提高了胚状体或愈伤组织的诱导率,但随着浓度的升高,子叶型胚的比例呈下降趋势,畸形胚的比例呈上升趋势。NAA的作用主要表现为在一定范围内可以提高子叶型胚的比例,降低畸形胚的比例,但浓度过高会对胚状体的发生起抑制作用。在菜薹的小孢子培养中最佳的胚状体诱导培养基配方为NLN-13+1.0mg/L 6-BA+0.4mg/L NAA。
3.4 胚状体植株再生
小孢子培养产生的胚状体诱导再生植株的成苗率很低,这一现象在很多其他植株小孢子培养中普遍存在[7]。试验将琼脂的浓度由6~7 g/L提高到10~12 g/L,大大提高了胚状体再生成苗率。这可能是小孢子胚成熟后需要一个相对干燥的生长环境造成的,也可能同合子胚成熟后逐渐干燥进入休眠状态的机理有些相似[8]。所以改变水势对胚产生一定的水分胁迫作用,可提高成苗率和再生植株的质量。
[1]肖 辉,徐跃进,李正丽.红菜薹游离小孢子培养的影响因素研究[J].安微农业科学,2008,36(17):7240-7241,7265.
[2]邓耀华,周国林,黄新学,等.气候条件对红菜薹游离小孢子培养的影响[J].长江蔬菜,2010,(24):15-16.
[3]耿建峰,侯喜林,张晓伟,等.影响白菜游离小孢子培养关键因素分析[J].园艺学报,2007,34(1):111-116.
[4]李必元,叶国税,王五宏,等.结球白菜游离小孢子培养与植株再生[J].浙江农业科学,2012,(4):503-506.
[5]王涛涛,李汉霞,张继红,等.红菜薹游离小孢子培养与植株再生[J].武汉植物学研究,2004,22(6):569-571.
[6]赵前程,吉立柱,蔡荣旗,等.花椰菜游离小孢子培养及植株再生研究[J].华北农学报,2007,22(6):65-68.
[7]邓 英,陶 莲,李正丽,等.大白菜游离小孢子的培养及植株再生[J].贵州农业科学,2012,40(6):19-21.
[8]邓晓辉,邱正明,聂启军,等.红菜薹游离小孢子培养和植株再生的关键因素研究[J].湖北农业科学,2009,10(10):2348-2350.
