脑源性神经营养因子对持续惊厥后海马凋亡调控基因表达的影响①
2013-09-23苑爱云蒋莉侯梅李欣
苑爱云,蒋莉,侯梅,李欣
国内外动物实验均证实,持续惊厥发作将导致选择性海马区神经元死亡,产生不可逆性脑损伤。大量实验提示,脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)是神经元生长、存活的必需因子。研究发现,BDNF对惊厥持续状态(status convulsivus,SC)后海马神经元的凋亡有一定抑制作用[1-2]。本研究观察外源性BDNF对惊厥后大鼠海马凋亡调控基因表达的影响,探讨BDNF对惊厥性脑损伤可能的调控机制。
1 材料和方法
1.1 模型制备和分组 健康成年Wistar大鼠64只,重庆医科大学实验动物中心提供。其中32只采用氯化锂-匹罗卡品(SIGMA公司)腹腔注射诱发SC模型(SC)[3]。在惊厥发作30 min后腹腔注射水合氯醛(上海禾丰制药有限公司)300 mg/kg止惊。另32只为正常对照组(NC)。所有大鼠行侧脑室内注射,根据注射内容不同,进一步分为生理盐水(NS)注射组、BDNF注射组、抗BDNF抗体注射组(美国PEPROTECH公司)和无注射组,每组8只。
1.2 脑室内注射 按鼠脑解剖图谱确定侧脑室定位参数。在前囟尾侧3.7 mm、中线左侧4.1 mm、颅骨表面以下5.5 mm为定向部位,手术刀尖钻透颅骨后,10 μl微量注射器缓慢注入 0.1 μg/μl BDNF 4 μl(SC-或NC-BDNF 组)、200 μg/ml抗 BDNF 抗 体 2 μl(SC-或NC-抗BDNF组)或者生理盐水2 μl(SC-或NC-NS组),于10~15 min内注射完毕,留针2 min后拔出注射器。右侧海马未做处理。
脑室内注射后6 h(为SC后海马细胞凋亡早期事件变化最明显时点[4])断头取脑,取双侧海马,分别留取约50 mg海马组织;余海马组织分别采用免疫组化和原位杂交(In Situ Hybridization,ISH)观察bcl-2蛋白/mRNA、c-jun蛋白/mRNA的分布,并进行半定量分析。
1.3 免疫组化检测 海马连续冠状冰冻切片,片厚8 μm,按SP法进行免疫组化染色(兔抗鼠bcl-2、c-jun多抗及SP免疫组化试剂盒均购自武汉博士德生物工程有限公司)。每只大鼠取3张切片,分别在海马CA1区、CA3区和齿状回各随机取3个视野(20×10),应用北航CM-2000B型生物医学图像分析系统测定其平均光密度(OD)。
1.4 原位杂交 取与免疫组化相邻的脑组织切片原位杂交观察bcl-2和c-jun mRNA的表达(bcl-2、c-jun原位杂交检测试剂盒购自武汉博士德生物工程有限公司)。测定每张切片的OD。
1.5 RT-PCR检测 对预留的50 mg海马组织,采用RT-PCR检测bcl-2和c-jun mRNA的表达(RNA提取试剂盒和RT-PCR检测试剂盒购自大连宝生物工程有限公司)。引物由上海生物工程有限公司合成(表1)。采用凝胶成像分析系统测定扩增产物条带平均光密度。将bcl-2、c-jun条带OD值与相应β-actin光密度值比较,计算平均OD比值。

表1 RT-PCR引物序列及长度
2 结果
2.1 bcl-2 在注射(左)侧,NC各组海马c-jun蛋白和mRNA表达均无显著性差异;SC各组中,bcl-2蛋白和mRNA表达由高到低依次为:BDNF组>无注射组=NS组>抗BDNF组(α=0.05)。注射对(右)侧,海马bcl-2蛋白和mRNA表达各组无显著性差异。见表2~表4。
2.2 c-jun 在注射(左)侧,NC组中,NS组、抗BDNF组海马bcl-2蛋白和mRNA表达较其他两组增高;SC各组中,c-jun蛋白和mRNA表达由高到低依次为:抗BDNF组>NS组>BDNF组=无注射组(α=0.05)。注射对(右)侧,NC各组海马c-jun蛋白和mRNA表达无显著性差异,SC各组海马c-jun蛋白和mRNA表达也无显著性差异,但均高于NC-无注射组。见表5~表7。
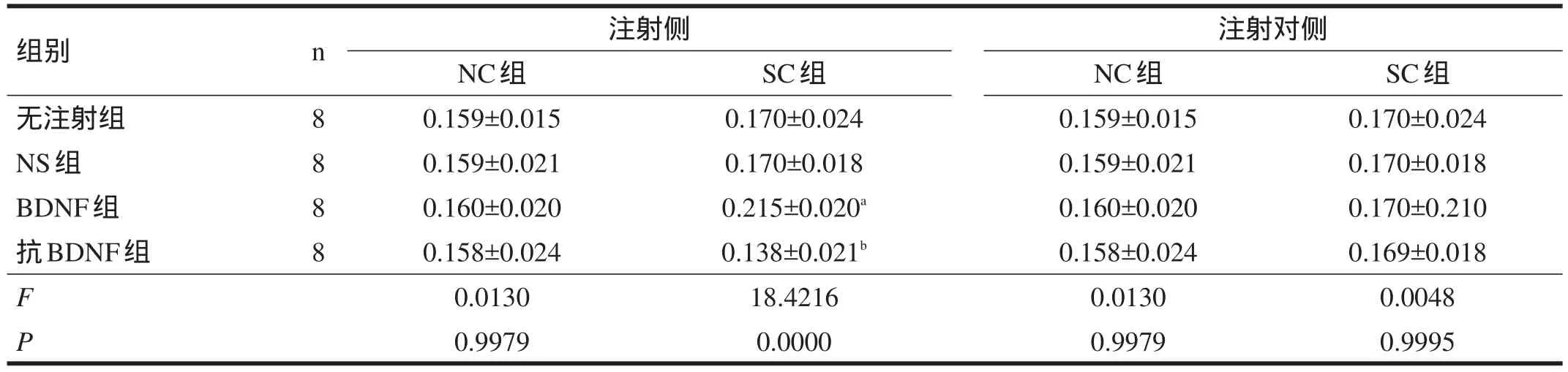
表2 各大鼠海马Bcl-2蛋白表达(OD)
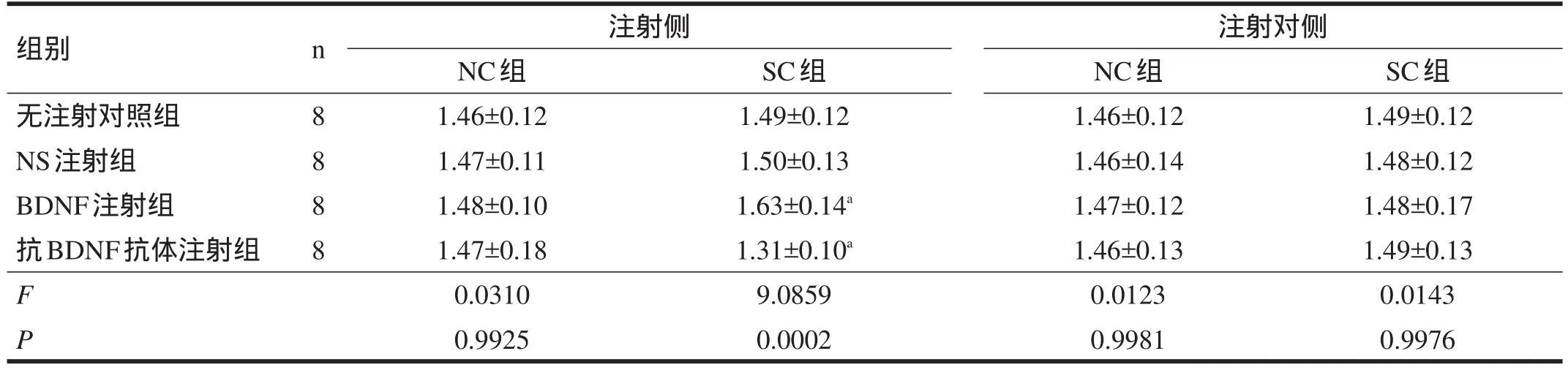
表3 各大鼠海马bcl-2 mRNA表达(RT-PCR法,OD比值)

表4 各大鼠海马bcl-2 mRNA表达(ISH法,OD)
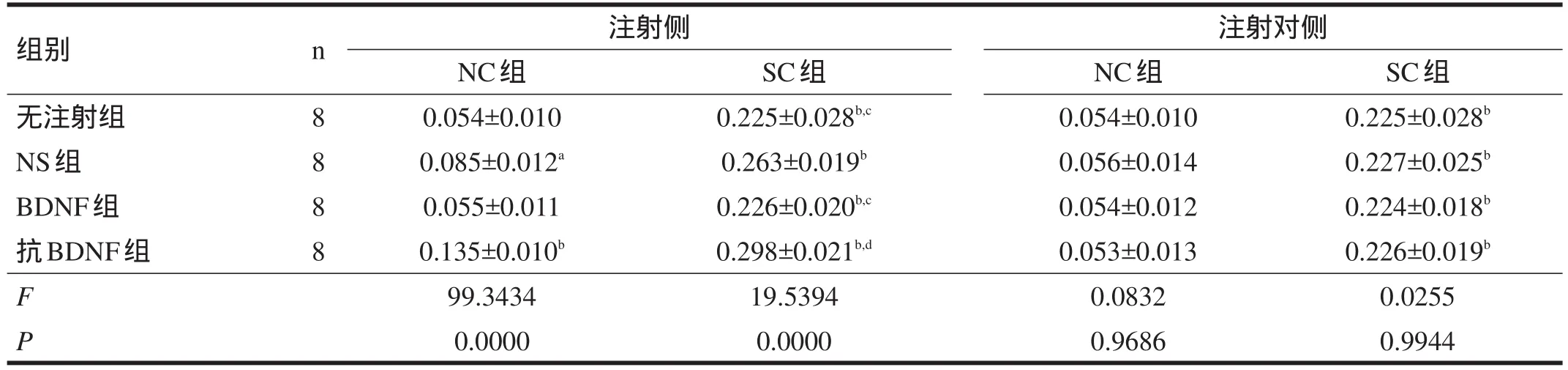
表5 各大鼠海马c-Jun蛋白表达(OD)

表6 各大鼠海马c-jun mRNA表达(RT-PCR法,OD比值)
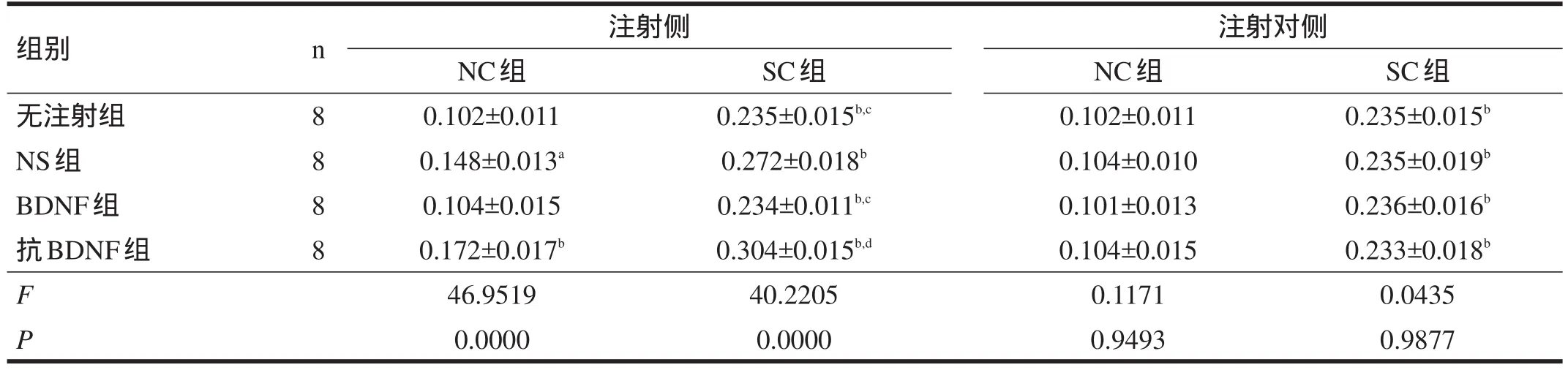
表7 各大鼠海马c-jun mRNA表达(ISH法,OD)
3 讨论
BDNF作为神经营养素家族的重要成员,与神经元的生长、再生密切相关。我们的前期实验发现,BDNF可以抑制SC后海马神经元的凋亡[2],本研究进一步在凋亡调控基因的水平探讨BDNF对惊厥性脑损伤的作用及其调控机制。
凋亡是细胞受基因调控的程序性死亡过程,c-jun和bcl-2均是调控细胞凋亡的关键基因。bcl-2与细胞凋亡密切相关,具有“主开关”的作用[5]。bcl-2编码的蛋白具有线粒体膜稳定功能,可阻止线粒体凋亡早期因子的释放,抑制细胞凋亡过程。因此,bcl-2被认为是细胞凋亡中的潜在抑制因子。c-jun编码的蛋白在正常情况下可参与细胞生长、发育、分化等生理过程;病理状况下,可通过对bcl-2家族的抑制,促进线粒体功能障碍,诱导细胞凋亡[6]。
大量研究证实,BDNF可减轻和阻止癫痫发作,对脑损伤具有保护作用[1-2,7]。bcl-2家族的调节可能是BDNF抵抗神经元凋亡的机制之一[1];BDNF还可抑制c-jun的活化[8]。Jeanneteau等证实,BDNF可通过促分裂素原活化蛋白激酶磷酸酶1(MKP-1)引起c-jun氨基末端激酶(JNK)的灭活[9]。新生鼠视皮质切除后可引起背侧膝状体快速而几乎完全的神经元变性,外源性BDNF可以显著削弱上述神经元病变[10]。
本组研究显示,在诱发SC后,注射BDNF可上调注射侧海马bcl-2表达,下调c-jun表达;而注射抗BDNF抗体能对抗这一作用。提示对凋亡调控基因的调节可能是BDNF脑损伤作用的机制之一。
本研究还显示,注射对侧海马bcl-2及c-jun的表达无显著改变,提示脑室内注射BDNF,其在脑内扩散有限。由于脑室内注射为有创损伤,且临床操作困难、实用性差,在临床的应用受到限制。而BDNF易被肝脏摄取灭活,且难以通过血脑屏障,经口服或外周血管给药均不能在中枢神经系统发挥作用。促进内源性BDNF表达,寻找更安全、方便的给药途径,将成为今后研究的重点。
[1]Almeida RD,Manadas BJ,Melo CV,et al.Neuroprotection by BDNF against glutamate-induced apoptotic cell death is mediated by ERK and PI3-kinase pathways[J].Cell Death Differ,2005,12(10):1329-1343.
[2]胡越,蒋莉,李欣.脑源性神经营养因子对大鼠惊厥性脑损伤的作用及调控因素[J].中国循证儿科杂志,2008,3(3):208-211.
[3]胡越,蒋莉.有效控制氯化锂-匹罗卡品诱发惊厥持续状态发作的实验研究[J].儿科药学杂志,2003,9:5-8.
[4]苑爱云,蒋莉,王贞,等.年龄和惊厥持续时间对持续惊厥后大鼠海马细胞线粒体膜电位的影响[J].中国康复理论与实践,2010,16(11):1027-1029.
[5]Martinou JC,Youle RJ.Mitochondria in apoptosis:Bcl-2 family members and mitochondrial dynamics[J].Dev Cell,2011,21(1):92-101.
[6]Schenkel J.Activation of the c-Jun transcription factor following neurodegeneration in vivo[J].Neurosci Lett,2004,361(1-3):36-39.
[7]Isokawa M.N-methyl-D-aspartic acid-induced and Ca-dependent neuronal swelling and its retardation by brain-derived neurotrophic factor in the epileptic hippocampus[J].Neuroscience,2005,131(4):801-812.
[8]Yamagishi S,Matsumoto T,Yokomaku D,et al.Comparison of inhibitory effects of brain-derived neurotrophic factor and insulin-like growth factor on low potassium-induced apoptosis and activation of p38 MAPK and c-Jun in cultured cerebellar granule neurons[J].Brain Res Mol Brain Res,2003,119(2):184-191.
[9]Jeanneteau F,Deinhardt K,Miyoshi G,et al.The MAP kinase phosphatase MKP-1 regulates BDNF-induced axon branching[J].Nat Neurosci,2010,13(11):1373-1379.
[10]Madeddu F,Naska S,Bozzi Y.BDNF down-regulates the caspase 3 pathway in injured geniculo-cortical neurones[J].Neuroreport,2004,15(13):2045-2049.
