HCV多表位抗原基因pcxz的三串联表达及其在小鼠体内免疫原性的研究
2013-09-22杨桂梅任大明
周 平,杨桂梅,余 龙,任大明
(复旦大学 生命科学学院 遗传工程国家重点实验室,上海200433)
丙型病毒性肝炎,是一种由丙型肝炎病毒(Hepatitis C virus,HCV)感染引起的病毒性肝炎,据世界卫生组织统计,全球HCV的感染率约为3%,估计约1.8亿人感染了HCV,每年新发丙型肝炎病例约3.5万例.丙型肝炎呈全球性流行,可导致肝脏慢性炎症坏死和纤维化,部分患者可发展为肝硬化甚至肝细胞癌(HCC).一些数据显示,未来20年内与HCV感染相关的死亡率(肝衰竭及肝细胞癌导致的死亡)将继续增加,对患者的健康和生命危害极大,已成为严重的社会和公共卫生问题.研究人员对研制有效的丙肝病毒疫苗做了很多有益的尝试,采取了如重组病毒疫苗[1-3]、DNA疫苗[4,5]、融合蛋白疫苗[6-8]、口服疫苗[4]等策略以及新兴的 RNA 干扰技术,研究的热点从包膜蛋白、核心蛋白到现在的非结构蛋白NS3和NS5.但目前HCV疫苗还没有成功的报道.
现代疫苗学研究认为单个表位的抗原只能诱导针对一种表位的免疫反应,而利用重组的多表位抗原或合成肽表位的混合物进行免疫可以获得同时针对多个靶点的免疫反应.由于合成肽存在溶解度、氨基酸的化学修饰以及价格昂贵等问题,因此多表位抗原疫苗成为重要的研究方向,目前已在肿瘤[9]、艾滋病[10-11]、疟疾[12]、丙肝[13-15]等方面进行广泛开展了相关研究.然而,将重组的多表位抗原进行串联重复形成更大分子量的多表位抗原的研究很少见报道.由于HCV的高度变异性[16]、抗HCV抗体无明显的中和性[17]等特点,以及缺乏小动物模型[18]等因素的制约,目前还没有有效的 HCV疫苗问世[19].陈丽珊等[14]将单拷贝的多表位PCX串联形成3个拷贝的PCX3,发现与单拷贝的多表位PCX抗原相比,具有3个拷贝的PCX3能够诱发更强的免疫反应.杨桂梅等[20]发现PCXZ比PCX3具有更强的免疫反应效果,因此,在杨桂梅等[20]的基础上将3段pcxz基因串联后表达形成多表位抗原3PCXZ,并检测了其抗原特异性等.结果表明本文合成的多表位抗原3PCXZ不仅诱导所免疫的BALB/c小鼠产生高滴度的IgG抗体反应,而且能刺激CD4+T细胞分泌INF-γ细胞因子以及产生特异性的细胞毒T细胞效应.
1 材料与方法
1.1 材料
大肠杆菌DH5α、BL21(DE3),质粒pET-28b(+)、和pET-28b(+)/pcxz为本实验室保存.DNA限制性内切酶、T4DNA连接酶、DNA Marker等购自Fermentas(MBI Fermentas);HRP-羊抗人IgG、HRP-羊抗鼠IgG购自Merck公司;Suprafuge 22型高速冷冻离心机(德国Heraeus公司);DNA测序由上海生工生物技术有限公司完成.抗HCV阳性血清和正常血清由上海市第一人民医院提供.BALB/c P815细胞来自中国科学院上海生物化学与细胞生物学研究所.BALB/c小鼠购自上海实验动物中心,健康6~8周龄小鼠17~21g,雄性.每组小鼠8只.
1.2 方法
1.2.1 3pcxz基因的构建
以杨桂梅[20]构建的pET-28b/pcxz为模板PCR扩增带不同酶切位点的3段pcxz片段.

表1 本文中所用PCR引物Tab.1 Primers used in this paper
PCR扩增体系如下:ddH2O 39μL,10×PCR反应缓冲液5μL,2.5mmol/L dNTP 2μL,10μmol/L上游引物1μL,10μmol/L下游引物1μL,质粒pUC/pcx 1μL,Taq酶(5U/μL)1μL,总体积50μL.
上述溶液在0.25mL离心管中充分混匀后按下列条件扩增:95℃5min,94℃30s,60℃30s,72℃30s,30个循环后72℃10min.1.0%琼脂糖凝胶电泳检测扩增条带.产物经胶回收纯化.片段A同pET-28b载体分别经BamHⅠ&EcoRⅠ双酶切,然后两者相连构建pET-28b/A;提取pET-28b/A质粒同B片段一起各经EcoRⅠ&SalⅠ双酶切,再相连构建pET-28b/AB;提取pET-28b/AB质粒再同C片段一起分别经SalⅠ&XhoⅠ双酶切,再相连构建pET-28b/ABC即pET-28b/3pcxz.琼脂糖凝胶电泳和测序验证质粒构建的效果.
1.2.2 目的基因的原核表达及纯化
目的基因的小量表达:将pET-28b(+)/3pcxz转化E.coli BL21(DE3)菌株,另外挑E.coliBL21单菌落接种于2mL LB培养基中(不含抗性)作为对照.37℃摇床培养,OD600为0.4~0.6时,加IPTG至终浓度为1mmol/L,37℃诱导4h.5 000r/min离心10min,收集菌体.12%SDS-PAGE鉴定表达情况.
大量发酵表达:重组菌株E.coliBL21(DE3)pET-28b(+)/3pcxz接种于50mL的LB培养基培养过夜,取5mL种子液于250mL含卡那抗性的发酵培养基中37℃摇床培养4h,用浓度为1mmol/L的IPTG进行诱导,继续培养4h后收菌.冷冻离心机4 000r/min离心15min,菌体冻于-20℃待纯化.
纯化:根据Ni2+-NTA-agarose亲和层析柱变性条件下的蛋白质纯化方法.冻存的菌体超声破碎后,1 2000r/min离心20min,上清液与50%Ni2+-NTA-agarose以4∶1的体积比混合,室温下200r/min振荡15~60min,将混合液加入到空的柱子中,打开柱子底部的盖子,收集流出液,加入洗涤缓冲液洗涤后用0.5mL洗脱液F(100mmol/L NaH2PO4,10mmol/L Tris-Cl,8mmol/L Urea,pH4.5)进行洗脱,洗脱4次.收集各步骤流出液,SDS-PAGE电泳检测.
收集变性条件下纯化的蛋白质溶液后,先用适量的PEG20000浓缩后透析,最后进行蛋白质浓度测定.
1.2.3 Western blot检测3pcxz与抗-HCV抗体反应的特异性
蛋白质进行SDS-PAGE电泳后转移到硝酸纤维素膜上,经过封闭处理后加入HCV病人阳性血清或正常人血清(含5%脱脂奶粉PBS 1/50稀释),37℃振荡2h,用PBST(含有1/1 000Tween20的PBS)洗涤后加入HRP-羊抗人IgG(5%脱脂奶粉PBST稀释),37℃振荡2h,PBST洗涤后加入反应液显色.
1.2.4 免疫
6到8周龄的BALB/c小鼠随机分为6组,每组8只.将纯化的3PCXZ抗原用适量的PBS稀释后,加等体积的完全弗氏佐剂(CFA)乳化或无佐剂,用于皮下多点注射BALB/c小鼠,免疫量分别为50μg/只.之后于第3,5周取相同剂量的3PCXZ抗原用适量的PBS稀释后,加等体积的不完全佐剂或无佐剂各免疫1次,第7周用每只10μg 3PCXZ的抗原量尾静脉加强.分别于免疫前(0周)及第3,5,7,9周采集血清1次.
1.2.5 细胞免疫的检测
1.2.5.1 ELISPOT检测T淋巴细胞分泌IFN-γ细胞因子
于免疫后第9周,取小鼠脾脏制备单细胞悬液,用淋巴细胞分离液,去除血红细胞及细胞碎片.取分离所得的细胞100μL(2×106细胞/mL),置于96孔培养板(MultiScreen,Millipore),培养板预先以抗鼠-IFN-γ单克隆抗体包被,培养基为含10%的热失活胎牛血清的RPMI1640.分别以3PCXZ、不相关蛋白BSA为刺激抗原加入各培养孔中,于含5%CO2的孵箱中37℃孵育40h.根据U-CyTech公司的ELISPOT试剂盒说明进行洗板,加入检测抗体,以及斑点显色.通过ELISPOT专用读板机对各孔进行斑点计数.每个斑点分别代表1个分泌IFN-γ的细胞.
1.2.5.2 细胞毒T淋巴细胞效应(CTL效应)
于免疫后第9周,取小鼠脾脏制备单细胞悬液,约2×107mL-1,置于6孔培养板中培养,培养基为含10%的热失活胎牛血清以及25U/mL IL-2的RPMI1640,加3PCXZ抗原至终浓度为10μg/mL,于5%CO2的孵箱中37℃培养.第5天,取同品系的未免疫过的小鼠脾淋巴细胞,同3pcxz(100μg/mL)共孵育15~20min,然后经丝裂霉素处理细胞.将此刺激细胞以1∶3的比例分别加入之前培养的6孔板细胞中,继续培养2天左右.第7天,收集刺激后的淋巴细胞,用RPMI1640洗涤2~3次,再以含5%FBS的RPMI1640培养基重悬作为效应细胞.取靶细胞P815细胞,分别同3PCXZ或BSA蛋白抗原,37℃孵育15~20min,然后依次用含10%FBS的PBS,RPMI1640洗涤2~3次,最后以含5%FBS的RPMI1640培养基重悬,调整细胞浓度至2×105mL-1.效应细胞/靶细胞(E:T)按50∶1,25∶1,12.5∶1比例各50μL加入U型底的96孔板中,每组设3个复孔,对照用100μL RPMI1640取代效应细胞的3孔为自然释放孔,100μL 10%Triton X-100取代效应细胞的3孔为最大释放孔.作用4h后,250r/min离心4min,取上清50μL测定各孔的乳酸脱氢酶的活性.
2 结 果
2.1 原核表达载体pET-28b(+)/3pcxz构建
将合成的多表位基因pcz同pcx基因相连构建多表位HCV抗原基因pcxz[20],将其装载于表达载体pET-28b(+)中构建pET-28b(+)/pcxz原核表达系统.以pcxz基因为模板PCR扩增带有不同酶切位点的3段pcxz片段A,B和C,再将其依次克隆至pET-28b(+)表达载体的多克隆位点中,构建pET-28b(+)/3pcxz表达系统,克隆步骤见图1(a),PCR扩增后鉴定结果见图1(b),进一步的测序结果也证明克隆序列完全正确(未列出).

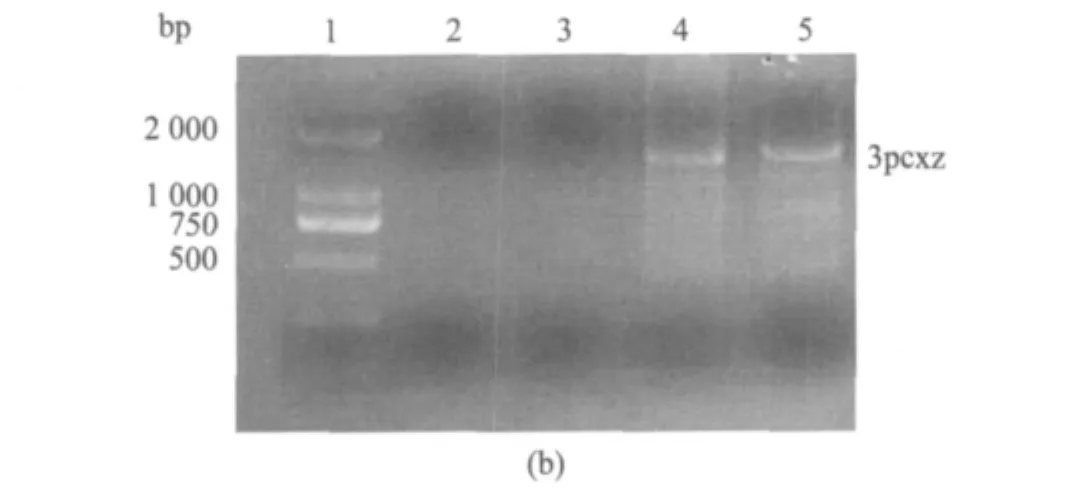
图1 多表位抗原pcxz和3pcxz基因示意图(a)和酶切验证(b)Fig.1 Map of pcxz &3pcxz multiepitope gene(a)and detection of enzyme digestion(b)
2.2 多表位抗原3PCXZ的表达与纯化
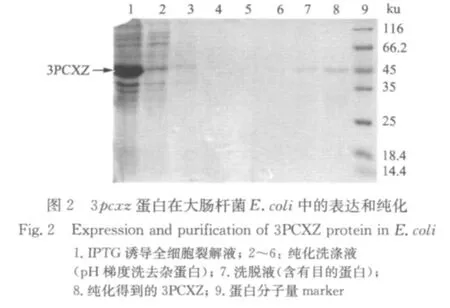
重组质粒pET-28b(+)/3pcxz转化大肠杆菌E.coliBL21(DE3)菌株,1mmol/L IPTG诱导后得到分子质量为50ku左右的蛋白(图未显示).大量表达后,利用重组蛋白上带有的6个His标签与Ni2+亲和层析柱特异结合,经Ni2+-NTA-agarose层析柱快速纯化后,得到3PCXZ蛋白(图2).蛋白分子质量在48 ku左右,与预期一致.
2.3 Western blot
Western blot结果(图3)显示重组表达的3PCXZ蛋白能被丙型肝炎患者血清识别,而不被正常人血清识别,表明多表位抗原3PCXZ蛋白具有丙肝病毒抗原的特异性.

2.4 多表位抗原诱导的特异性体液免疫应答
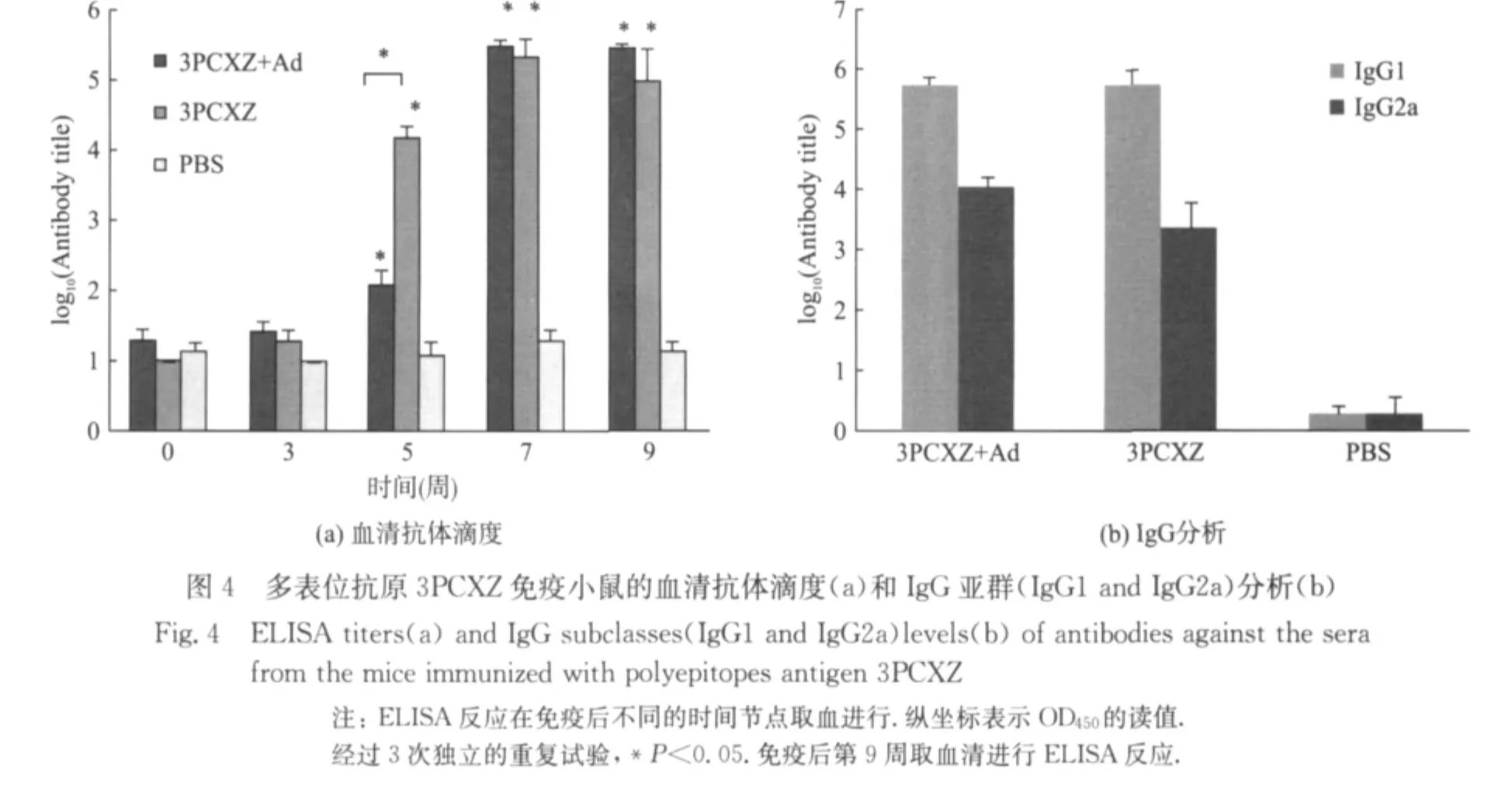
重组表达的多表位抗原3PCXZ免疫BALB/c小鼠,于第2次免疫后第5周检测到特异性IgG抗体产生,并且裸蛋白免疫组抗体滴度显著高于弗氏佐剂联合蛋白组(图4(a)).随着时间推移和免疫次数的增加,IgG抗体滴度在升高.IgG1和IgG2a亚型的比例是评价免疫反应的重要指标.对3PCXZ免疫小鼠的血清中的IgG1和IgG2a抗体滴度分别进行了检测,结果见图4(b).抗原蛋白3PCXZ引起的主要是IgG1型反应,也就是基于Th2的免疫反应.
2.5 多表位抗原诱导的特异性细胞免疫应答
2.5.1 INF-γ细胞因子分泌
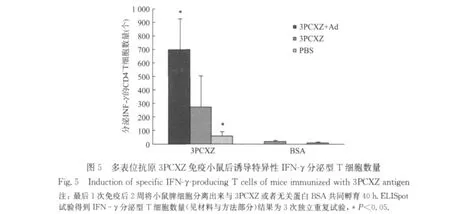
于免疫后第9周取免疫小鼠脾淋巴细胞,检测特异性分泌INF-γ细胞因子的CD4+T细胞(图5).以重组抗原3PCXZ体外再刺激免疫小鼠的脾淋巴细胞,3PCXZ+Ad组分泌INF-γ的CD4+T细胞数最多,每106个细胞中达到(698±229)个.统计学分析表明3PCXZ+Ad组同免疫对照组PBS组相比,差异显著(*P=0.023<0.05).以BSA体外刺激免疫小鼠的脾淋巴细胞,各组均未显著分泌相应的INF-γ.
2.5.2 细胞毒T淋巴细胞反应
于免疫后第9周分别用抗原3PCXZ、不相关蛋白BSA作为刺激物刺激免疫小鼠的脾细胞,结果诱发了较高水平的特异性CTL应答(图6,见第110页).用3PCXZ蛋白作为刺激物,最高溶解率达到40.54%(3PCXZ+Ad组),显著高于对照组(PBS)(图6(a)).而以BSA作为体外刺激原,各组所产生的溶解率均低于10%(图6(b)).
3 讨 论
与传统全基因疫苗相比,人工合成的多表位抗原基因有着无法比拟的优点[21,22]:1)具有更广的选择范围,无论是同一基因的不同区域还是不同基因甚至同一病原体不同阶段,从而能提供更广更强的免疫保护;2)作为一种合成疫苗更安全而且价廉又易于生产及储存;3)由于表位片段都是很短的多肽,其保守性相当较高,而且可以只针对保守区选择免疫表位,这对一些高变异的病原体比如HCV,HIV等而言尤为重要.因此目前已成为许多疾病疫苗研究的一个重要方向,具有重要的理论意义及潜在的应用价值.
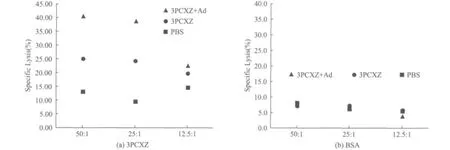
图6 多表位抗原3PCXZ免疫小鼠后的CTL反应Fig.6 CTL response of mice immunized with 3PCXZ antigen against 3PCXZ recombined protein
为了使得合成的多表位抗原能有效引起B细胞应答产生特异的抗体,另外根据陈丽珊等[14]的研究结果,3串联HCV多表位抗原PCX形成的多表位HCV抗原PCX3所引起的免疫反应显著强于PCX,所以,本文将pcxz串联成3pcxz,以合成的抗原蛋白免疫BALB/c小鼠,结果显示针对蛋白抗原的特异性IgG抗体滴度最高达到5.8×105,说明合成的多表位抗原能有效诱发小鼠产生特异性体液免疫.然而,杨桂梅等[20]以PCXZ为抗原免疫BALB/c小鼠得到约6.56×105IgG抗体滴度,本文在pcxz基础上串联表位合成的3pcxz较之前在B细胞免疫上并没有提高.
一个理想的疫苗必须同时含有B细胞及T细胞表位,特别是针对那些在体内主要介导细胞免疫应答的病原体,如HIV、HCV及流感病毒等.本文合成的多表位抗原3PCXZ不仅诱导所免疫的BALB/c小鼠产生较高滴度的IgG抗体反应,而且能刺激CD4+T细胞分泌INF-γ细胞因子以及产生特异性的细胞毒T细胞效应.3pcxz抗原免疫后,在1×106脾淋巴细胞中最多达(698±229)个分泌INF-γ的CD4+T细胞.用佐剂一组的免疫效应要强于不用佐剂的一组.而杨桂梅等[20]构建的PCXZ抗原免疫BALB/c小鼠能够产生(675±135)个CD4+T细胞.可见pcxz和3pcxz的免疫原性并没有多大差异,同时3pcxz抗原的CTL杀伤率与PCXZ抗原的CTL杀伤率都达40.54%,说明合成抗原3PCXZ也能有效引起细胞免疫应答但是并没有比PCXZ提高.究其原因可能是PCX抗原较小(10ku),而小蛋白抗原不能有效引起体液免疫应答,而PCXZ抗原约有21ku足够引起相应的免疫应答.如果再加上其串联重复序列,也许只是单纯的增加了抗原的大小,并没有从根本上增加抗原的复杂性,那么在引起细胞免疫应答的时候,就并不能提高和增强细胞的各种免疫应答效应,而当序列增加到一定长度以后,由于空间构象的变化等,抗原的免疫原性可能不会单纯的因为其本身的大小而增加免疫原性,以后在设计多表位抗原的时候,应该从增加抗原本身多肽表位的复杂性这一方面考虑.另外,本文所选用的弗氏佐剂并未显著增强无论是细胞免疫还是体液免疫应答.今后可以考虑选择其他佐剂,比如CRL-1005聚合物和ISA-720山小星蒜碱.所以,在以后设计针对HCV的多表位抗原的时候,有必要考虑抗原结构的复杂性和表位的异质性,另外也同时可以考虑在免疫的时候,使用不同的佐剂以增加抗原的免疫原性.
[1]Lucas M,Tsitoura E,Montoya M,etal.Characterization of secreted and intracellular forms of a truncated hepatitis C virus E2protein expressed by a recombinant herpes simplex virus[J].JGenVirol,2003,84(3):545-554.
[2]Lasarte J J,Sarobe P,Boya P,etal.Arecombinant adenovirus encoding hepatitis C virus core and E1 proteins protects mice against cytokine-induced liver damage[J].Hepatology,2003,37(2):461-470.
[3]Seong Y R,Choi S,Lim J S,etal.Immunogenicity of the E1E2proteins of hepatitis C virus expressed by recombinant adenoviruses[J].Vaccine,2001,19(20/22):2955-2964.
[4]Wedemeyer H,Gagneten S,Davis A,etal.Oral immunization with HCV-NS3transformed Salmonella:Induction of HCV-specific CTL in a transgenic mouse model[J].Gastroenterology,2001,121(5):1158-1166.
[5]Lagging L M,Meyer K,Hoft D,etal.Immune responses to plasmid DNA encoding the hepatitis C virus core protein[J].JVirol,1995,69(9):5859-5863.
[6]Hunziker I P,Zurbrig gen R,Glueck R,etal.Perspectives:Towards a peptide-based vaccine against hepatitis C virus[J].MolImmunol,2001,8(6):475-484.
[7]Nemchino V L G,Liang T J,Rifaat M M,etal.Development of a plant-derived subunit vaccine candidate against hepatitis C virus[J].ArchVirol,2000,145(12):2557-2573.
[8]Esumi M,Rikihisa T,Nishimura S,etal.Experimental vaccine activities of recombinant E1and E2 glycoproteins and hyper variable region 1peptides of hepatit is C virus in chimpanzees[J].ArchVirol,1999,144(5)973-980.
[9]Song S,Wang F,He X,etal.Evaluation of antitumor immunity efficacy of epitope-based vaccine with B16cell line coexpressing HLA-A2/H-2kb and CTL multiepitope in HLA transgenic mice[J].Vaccine,2007,25(25):4853-4860.
[10]Woodberry T,Gardner J,Mateo L,etal.Immunogenicity of a human immunodeficiency virus(HIV)polytope vaccine containing multiple HLA A2HIV CD8+cytotoxic T-cell epitopes[J].JVirol,1999,73(7):5320-5325.
[11]Lu Y,Xiao Y,Ding J,etal.Immunogenicity of neutralizing epitopes on multiple-epitope vaccines against HIV-1[J].IntArchAllergyImmunol,2000,121(1):80-84.
[12]Kaba S A,Price A,Zhou Z,etal.Immune responses of mice with different genetic backgrounds to improved multiepitope,multitarget malaria vaccine candidate antigen FALVAC-1A [J].ClinVaccine Immunol,2008.15(11):1674-1683.
[13]Li Q,Dong C,Wang J,etal.Induction of hepatitis C virus-specific humoral and cellular immune responses in mice and rhesus by artificial multiple epitopes sequence[J].ViralImmunol,2003,16(3):321-333.
[14]Chen L,Gao T,Yang N,etal.Immunization with a synthetic multiepitope antigen induces humoral and cellular immune responses to hepatitis C virus in mice[J].ViralImmunol,2007,20(1):10.
[15]Huang J,Peng C,Xie Y,etal.Specific immune responses induced by multi-epitope antigen of HCV in mice and rabbit[J].ChinSciBull,2000,45(10):6.
[16]Choo Q L,Richman K H,Han J H,etal.Genetic organization and diversity of the hepatitis C virus[J].ProcNatlAcadSciUSA,1991.88(6):2451-2455.
[17]Brillanti S,Foli M,Perini P,etal.Long-term persistence of IgM antibodies to HCV in chronic hepatitis C[J].JHepatol,1993,19(1):185-186.
[18]Ploss A,Rice C M.Towards a small animal model for hepatitis C [J].EMBOReports,2009,10(11):1220-1227.
[19]Stoll-Keller F,Barth H,Fafi-Kremer S,etal.Development of hepatitis C virus vaccines:Challenges and progress[J].ExpertRevVaccines,2009,8(3):333-345.
[20]Yang G,Chen S,Zhu X,etal.A synthetic multi-epitope antigen enhances hepatitis C virus-specific B-and T-cell responses[J].ViralImmunology,2011,249(2):109-118
[21]Bukh J,Miller R H,Purcell R H.Genetic heterogeneity of hepatitis C virus:quasispecies and genotypes[J].SeminLiverDis,1995,15(1):41-63.
[22]Alexander J,Oseroff C,Dahlberg C,etal.A decaepitope polypeptide primes for multiple CD8+IFN-gamma and Th lymphocyte responses:Evaluation of multiepitope polypeptides as a mode for vaccine delivery[J].JImmunol,2002,168(12):6189-6198.
