响应面法优化榆耳多糖脱蛋白工艺
2013-09-19蒋春燕,李代,侯红漫,张公亮
蒋 春 燕,李 代,侯 红 漫,张 公 亮
(1.大连工业大学 食品学院,辽宁 大连 116034;2.辽宁省大连海洋渔业集团公司,辽宁 大连 116113)
0 引 言
榆耳别名榆蘑,是一种树生腐生真菌,其子实体及发酵菌丝体可入药,榆耳子实体含有蛋白质、多糖和多种维生素等营养成分[1]。榆耳多糖属于真菌多糖,真菌多糖具有抗肿瘤、抗氧化、调节免疫等多种生物功效[2-3]。关于榆耳子实体、发酵液及发酵产物的生物活性[4]报道较多,榆耳多糖作为榆耳中主要的活性成分,也已开始受到人们关注[5]。多糖脱蛋白时多采用传统Sevag法,该法有机溶剂用量大、复杂、费时,通常需要重复多次,存在多糖损失等问题[6]。酶法反应温和,酶可以水解少量与多糖结合牢固或被多糖包裹的蛋白,将糖释放出来,从而提高多糖粗产品得率,脱蛋白常用的酶有木瓜蛋白酶、胰蛋白酶和中性蛋白酶[7]。实验选用多种酶脱蛋白以确定最佳蛋白酶,再根据单因素和响应面分析法[8]确定了脱蛋白最佳条件。
1 实 验
1.1 材料与仪器
榆耳菌丝体,深层发酵培养技术获得;木瓜蛋白酶,酶活(1.29±0.32)×105U/g,pH 6.0、60℃下测定;碱性蛋白酶,酶活(2.23±0.19)×105U/g,pH 9.0、50℃下测定;复合蛋白酶,酶活(1.11±0.39)×105U/g,pH 6.0、50℃下测定;中性蛋白酶,酶活(2.35±0.21)×105U/g,pH 7.0、50℃下测定;均为分析纯,广西南宁庞博生物有限公司。
SC-3610低速离心机,科大创新股份有限公司中佳分公司;UV2100型紫外分光光度计,尤尼柯(上海)仪器有限公司;冷冻离心机,天美科学仪器有限公司;电子精密天平,梅特勒-托利多仪器(上海)有限公司。
1.2 实验方法
1.2.1 榆耳菌丝体多糖的提取
称取榆耳菌丝体粉末30g,按水料比40∶1加入蒸馏水,80℃下热水浸提8h,离心(4 000r/min,10min)。反复提取3次,收集上清液浓缩至原体积的1/5,加3倍体积无水乙醇,4℃过夜,离心(4 000r/min,10min),收 集 沉 淀。 将 沉 淀 于40℃烘干,用去离子水复溶,离心(4 000r/min,15min)得上清液即为水溶性粗多糖[9-10]。用苯酚硫酸法和考马斯亮蓝法测定水溶性粗多糖溶液中多糖和蛋白含量。
1.2.2 不同酶法脱蛋白
取4份10mL(10mg/mL)榆耳粗多糖溶液,分别加入相同活力单位的木瓜蛋白酶、碱性蛋白酶、中性蛋白酶、复合蛋白酶,调至相应酶反应的最适pH,在最适温度下水浴3h后煮沸灭酶10min,使酶失活沉淀(每种酶作3个平行),离心(10 000r/min,10min),取上清液,加入无水乙醇(使乙醇占整个体积的80%),4℃条件下放置过夜,离心,将多糖沉淀烘干,复溶,最后测蛋白和多糖的含量,根据蛋白去除率和多糖损失率确定最佳蛋白酶。
1.2.3 木瓜蛋白酶法脱蛋白的单因素实验
木瓜蛋白酶溶液的制备:用100mL pH 6.0的去离子水溶解木瓜蛋白酶,使酶液终浓度为2 000U/mL。木瓜蛋白酶的单因素条件:酶液与多糖溶液体积比分别为0.10∶1、0.15∶1、0.20∶1、0.25∶1、0.30∶1,酶解时间分别为1.0、1.5、2.0、2.5、3.0h,酶解温度分别为40、50、60、70、80℃,pH 分别为3.5、4.5、5.5、6.5、7.5。
1.2.4 分析方法
(1)榆耳菌丝体多糖含量的测定:苯酚-硫酸法。
(2)蛋白含量的测定:采用考马斯亮蓝G-250法。

式中:A0为脱蛋白前样品中蛋白质量分数,A1为脱蛋白后样品中蛋白质量分数。
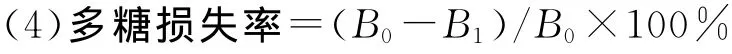
式中:B0为脱蛋白前样品中多糖质量分数,B1为脱蛋白后样品中多糖质量分数。
1.2.5 酶法脱蛋白条件的响应面分析
采用Box-behnken实验方案,根据单因素的实验结果,运用RSREG(response surface regression)程序对实验点的响应值进行系统分析。
2 结果与讨论
2.1 不同酶法除蛋白结果
根据“1.2.2”的实验方法分别用木瓜蛋白酶、碱性蛋白酶、中性蛋白酶、复合蛋白酶脱除榆耳粗多糖蛋白后得多糖组分,分别命名为 M、N、S、T。由葡萄糖标准曲线y=0.123x-0.006 3,R2=0.999及蛋白质标准曲线y=0.005 5x+0.012 1,R2=0.994 9和“1.2.4”中公式计算所得结果如图1所示。
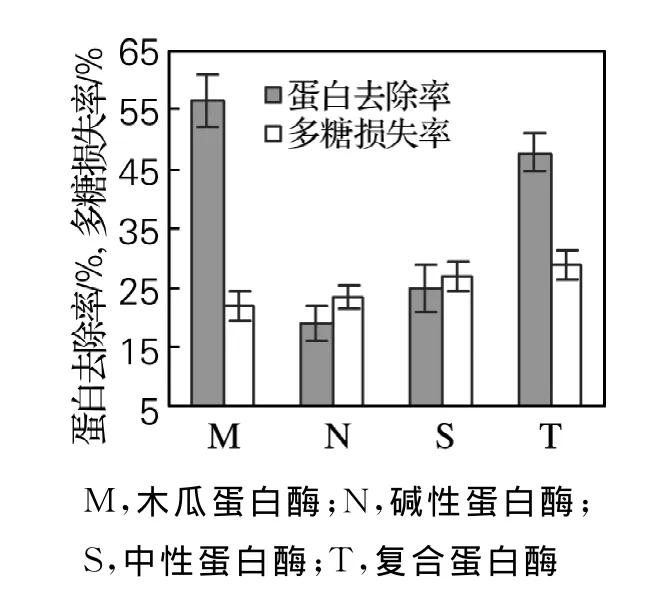
图1 4种酶的脱蛋白效果比较Fig.1 The results of deproteinization by four enzymes
由图1可看出,在4种酶中,木瓜蛋白酶的脱蛋白效果最好(P<0.01),蛋白去除率为56%;其次为复合蛋白酶,蛋白去除率达47%;碱性蛋白酶和中性蛋白酶脱蛋白效果不理想。这一结果与不同酶对红松松塔粗多糖和大枣多糖除蛋白工艺的研究结果基本相符[11-12]。因此,在多糖损失率相差不大的条件下选择木瓜蛋白酶作单因素实验,探索其除蛋白的最佳条件。
2.2 木瓜蛋白酶除蛋白单因素条件探索
2.2.1 酶液与多糖样液体积比对水解反应的影响
从图2可以看出,当溶液pH为6.0,在60℃水浴中水解3h后,随酶加入量的增大,反应越来越完全。当酶液与样液体积比为0.20∶1时,蛋白去除率较高而多糖损失率相对较小。这一结果与赵燕珠等[13]的研究结果基本相符。因此,确定后续单因素实验中酶液与糖液体积比为0.20∶1。

图2 酶液与样液体积比对脱蛋白的影响Fig.2 Influence of different ratio of liquid on deproteinization
2.2.2 酶解时间对水解反应的影响
由图3可看出蛋白去除率随酶解时间延长而增加,在3.0h时蛋白去除率最大为71.5%,随后趋于稳定。多糖损失率则随时间的延长变化幅度不大,保持在7.8%~17.5%,这一结果与高星烨等[11]的研究结果类似。因此,在多糖损失率变化幅度不大的情况下,确定最佳酶解时间为3h。
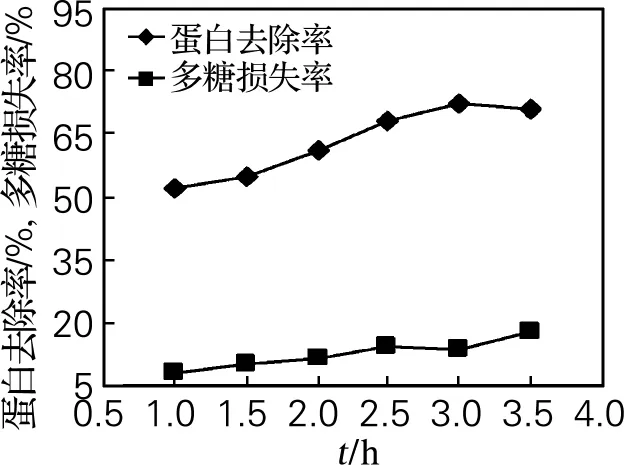
图3 酶解时间对脱蛋白的影响Fig.3 Influence of time on deproteinization
2.2.3 酶解温度对水解反应的影响
从图4可以看出,蛋白去除率在40~60℃随着温度的升高而变大,在60℃后变化不大;多糖损失率在40~70℃变化不大,但70℃后逐渐增大。这是因为木瓜蛋白酶作用时,需要一定的温度来提高酶的活力,温度升高,可增加酶液在溶液中的渗透动力,酶才能与蛋白质分子充分作用,但温度过高则会导致酶失活。因此,在保持较低多糖损失率情况下,确定60℃为最佳蛋白脱除效果的酶解温度。
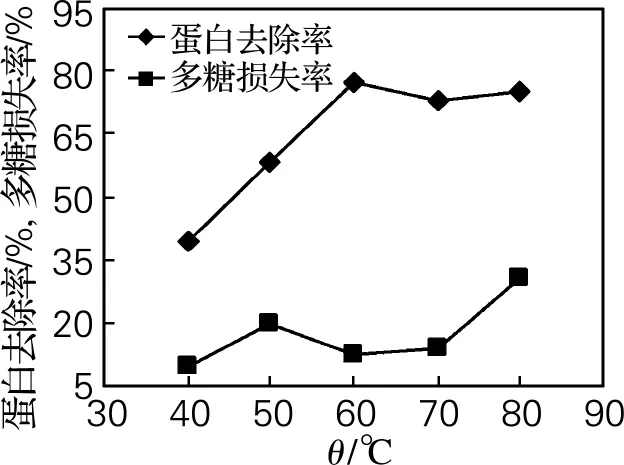
图4 酶解温度对脱蛋白的影响Fig.4 Influence of temperature on deproteinization
2.2.4 pH对水解反应的影响
从图5可以看出,蛋白去除率在pH 3.5~6.0随着时间的增加而变大,随后呈现下降趋势;多糖损失率随pH的增大呈现波动状态。这可能是由于木瓜蛋白酶的化学本质是一种蛋白质,它在水解体系中的解离状态和行为要受溶液pH的影响。因此,在保持较高蛋白去除率情况下,确定最佳pH为6.0。

图5 pH对脱蛋白的影响Fig.5 Influence of pH on deproteinization
2.3 中心复合响应面优化实验
根据单因素实验结果,水解时间选为3h,以酶解温度、酶液与糖液的体积比和pH为变化量,以蛋白去除率/多糖损失率(即蛋白去除率与多糖损失率的比值)为响应值Y,运用响应面程序,对木瓜蛋白酶除蛋白的条件进行优化。响应面分析水平和结果见表1和表2。
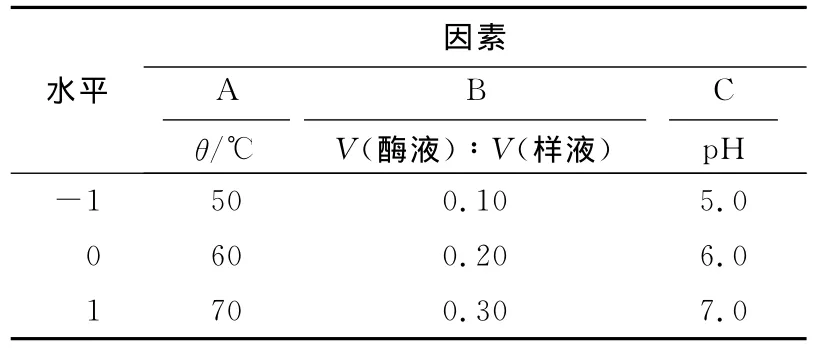
表1 酶法脱蛋白的响应面分析水平和因素Tab.1 Design of experimental factors and levels of deproteinization by enzyme
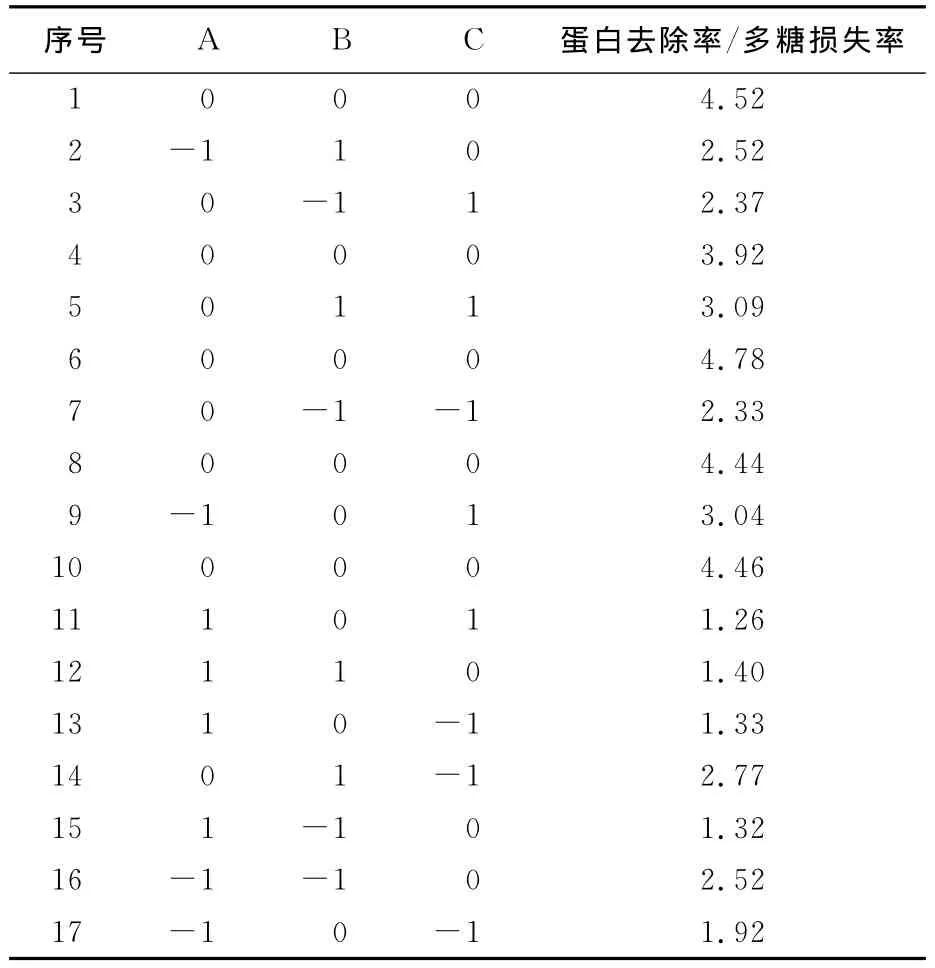
表2 酶法脱蛋白的响应面分析方案和结果Tab.1 Design and results of response surface experimental of deproteinization by enzyme
为了能准确估计实验误差,需要对中心点进行5次平行实验。继续用RSREG程序对表2中所得结果进行程序分析,结果见表3。
由表3中数据分析可得榆耳多糖的Y与不同提取因素间的拟合方程:
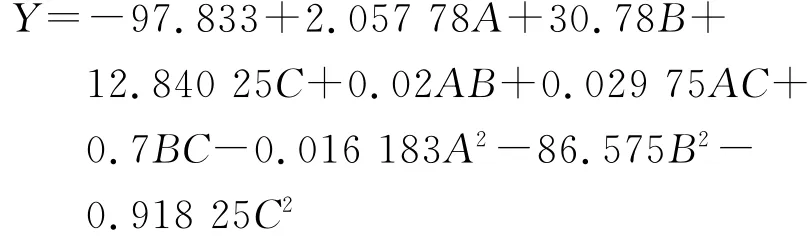
回归方程P值越小,与之对应变量的显著性就越高,A、A2、B2和C2对响应值的变化起了明显的作用,3个影响因素与Y的变化不是单一的线性关系。其中,复相关系数R2=0.974 8可以解释方程拟合度很高。所以,可以用此方程来优化酶法除蛋白方法。通过分析结果可以作出相应的等高线图及其曲面图,以确认温度、酶液与样液体积比和pH 3个因素对蛋白去除率与多糖损失率的比值的影响,结果见图6。
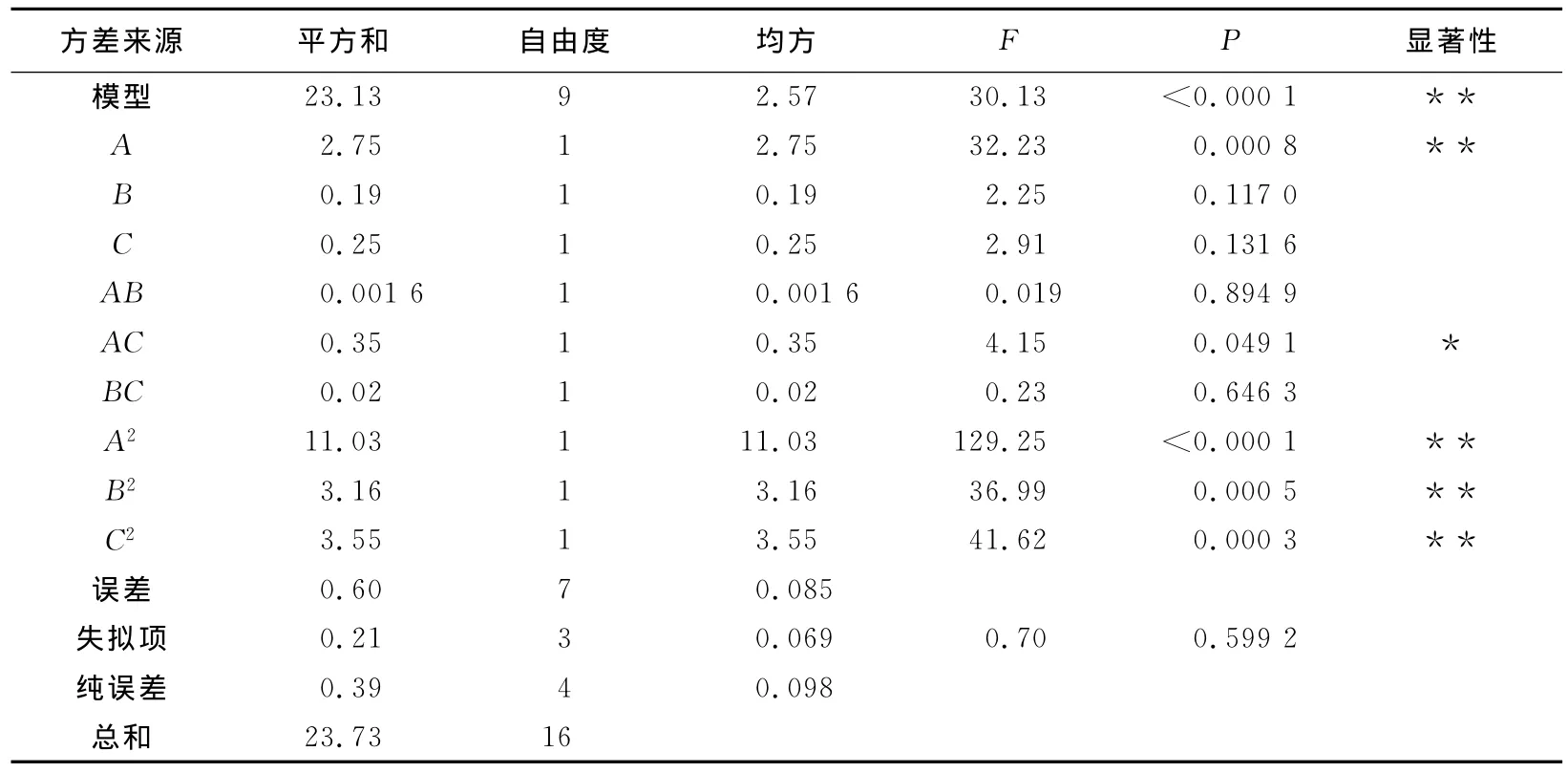
表3 酶法脱蛋白的回归结果与分析Tab.1 Regression results and analysis of deproteinization by enzyme
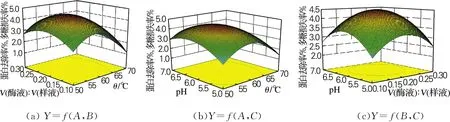
图6 响应面立体分析图Fig.6 Responsive surface plot
由图6(a)可以看出,当C取中心水平时,A和B对Y(蛋白去除率与多糖损失率的比值)的交互作用不显著。当A取不同值时,B对Y的影响表现出不同程度的变化;同理,当B取不同值时,A对Y的影响也表现出不同程度的变化。从单个因素对Y的影响看,A的变化对Y的显著性要大于B,即温度对Y影响的显著性大于酶液与样液体积比。
由图6(b)可以看出,当B取中心水平时,A和C对Y的交互作用显著。但从单个因素对Y的影响看,A的变化对Y的显著性要大于C,即温度对Y影响的显著性大于pH。
由图6(c)可以看出,当A取中心水平时,B和C对Y的交互作用不太显著。从单个因素对Y的影响看,C影响的显著性要大于B,即pH对Y影响的显著性大于酶液与样液比。
为检验响应面法所得结果的可靠性,确定木瓜蛋白酶除蛋白的最优条件,根据软件优化出的各因素水平最佳取值,经软件计算得:酶解温度=58℃,V(酶液)∶V(样液)=0.21∶1,pH=6.13;此条件下蛋白去除率为67.52%,多糖损失率为15.57%。
3 结 论
分别用木瓜蛋白酶、碱性蛋白酶、中性蛋白酶和复合蛋白酶去除榆耳多糖中蛋白,结果显示木瓜蛋白酶除蛋白效果较好。对木瓜蛋白酶除蛋白进行单因素和响应面优化实验最后确定最优条件为:酶液与糖液的体积比为0.21∶1,酶解时间为3h,酶解温度为58℃,pH为6.13。经软件计算此条件下所得蛋白去除率与多糖损失率比值理论值为4.499,实测值为4.337,预测值与理论值接近,偏差较小。
[1]张金霞,崔俊杰.榆蘑的营养成分[J].中国食用菌,1993,13(6):29-31.
[2]周林珠,杨祥良,周井炎,等.多糖抗氧化作用研究进展[J].中国生化药物杂志,2002,23(4):210-212.
[3]樊锦艳,王秋颖.食药用真菌多糖的研究与开发利用[J].食品工业科技,2003,24(12):106-107.
[4]杨景峰,罗志刚,罗发兴.物理波在真菌多糖提取中的应用[J].粮油食品科技,2007,15(5):55-58.
[5]宋宏,姚方杰,唐峻,等.榆耳研究概况[J].中国食用菌,2008,27(1):3-4.
[6]孟凡欣,蒋朝军,于笑坤,等.刺五加多糖的提取与含量测定[J].食品工业科技,2005,(26)7:110-112.
[7]马丽,覃小林,刘雄民,等.不同的脱蛋白方法用于螺旋藻多糖提取工艺的研究[J].食品科学,2004,25(6):116-118.
[8]MYERS R H,MAYS D P.Design and analysis for a two-level factorial experiment in the presence of variance heterogeneity[J].Computational Statistics and Data Analysis,1997,26(2):219-233.
[9]王应男,张公亮,刘洋,等.榆耳菌丝体多糖的体外抗氧化活性研究[J].食品工业科技,2012,33(12):194-196.
[10]徐兢博,朱作林,金凤燮,等.麦冬多糖的分离纯化及其组分的初步分析[J].大连工业大学学报,2010,29(6):418-419.(XU Jing-bo,ZHU Zuo-lin,JIN Feng-xie,et al.Purification and components preliminary analysis ofOphiopogonjaponicus[J].Journal of Dalian Polytechnic University,2010,29(6):418-419.)
[11]高星烨,杨鑫,董爱军,等.红松松塔粗多糖酶法脱蛋白工艺的研究[J].中国甜菜糖业,2010(1):13-16.
[12]姚文华.大枣多糖脱蛋白的研究[J].食品研究与开发,2009,30(5):49-51.
[13]赵燕珠,柯百胜,吴周和,等.啤酒酵母多糖脱蛋白方法的应用研究[J].食品工业科技,2009,30(10):244-246.
