LAMP与FQ-PCR技术检测HBV DNA的特异性和灵敏度比较
2013-09-21邓正华晏丽黄远帅彭瑛温先勇
邓正华,晏丽,黄远帅,彭瑛,温先勇
(泸州医学院附属医院检验科,泸州 646000)
乙型肝炎病毒(hepatitis B virus,HBV)是一种引起急慢性肝炎、肝硬化和肝癌的DNA病毒,其感染已成为全世界的一个重要的公共卫生问题[1,2]。我国是乙肝高流行区,目前大约有60%人群感染HBV,10%的人群乙肝表面抗原呈阳性[3]。快速、特异、敏感地检测HBV,对于早期诊断、观察抗病毒药物的疗效、筛查病毒核酸和阻断母婴传播等均有重要意义。近年来各种基于免疫学的方法或基于PCR的方法已被用于HBV的诊断检测,由于各种基于PCR的检测方法具有较高的敏感性和较好的特异性,应用最为广泛。FQ-PCR和LAMP技术是在传统PCR技术基础上发展起来的两种新型体外核酸扩增方法,是目前国际上公认的灵敏度较高和特异性较好的分子检测方法,已应用到HBV DNA的检测。然而,目前对于这两种新型检测技术在特异性和灵敏度方面的相关报道还比较少。因此,我们在建立LAMP检测HBV DNA方法的同时,与FQ-PCR方法的结果进行比较,并对它们的特异性和灵敏度进行了比较。
1 材料与方法
1.1 标本来源
经泸州医学院附属医院检验科检测确诊的HBV复制活跃的病人血清,HPV和EB病毒感染患者的分泌物,经细菌室培养、分离、纯化的大肠埃希氏菌、金黄色葡萄球菌、鲍曼不动杆菌、铜绿假单胞菌菌落,免疫室用时间分辨技术检测过的血清免疫标志物为阴性的正常健康人血清标本。
1.2 仪器与试剂
美国 Applied Biosystems公司 Real-time PCR荧光定量扩增仪(型号:ABI7500fast);美国Bio RAD公司的PCR扩增仪(型号:C1000);美国Bio RAD公司的凝胶成像仪;普通离心机及高速冷冻离心机;恒温金属浴。HBV DNA定量检测试剂盒(PCR-荧光探针法)由深圳凯杰生物工程有限公司提供;DNA扩增试剂盒(LAMP法)由日本荣研化学株式会社提供。
1.3 方法
1.3.1 引物的合成 引物通过查阅参考文献[4],由上海生工生物工程有限公司合成,共2对。
内 引 物 为:BIP:5-GATAAAACGCCG CAGACACATCCTCTTAACCTCTCCAA-3,FIP:5-CCTGCTGCTATGCCTCATCTTTTTGACAA ACGGACCTT-3
外 引 物 为:B3:5-CAAAATTCGCAGTCCCC AAC-3,F3-5-GGTGGTTGATGTTCCTGGA-3
1.3.2 总DNA的提取 取HBV感染患者血清,HPV和EB病毒感染患者分泌物,大肠埃希氏菌、金黄色葡萄球菌、鲍曼不动杆菌、铜绿假单胞菌菌落,正常人血清,使用深圳凯杰生物工程有限公司的基因组DNA提取试剂盒提取基因组总DNA。在100μL样本中加入100μLDNA提取液1,振荡混匀,13 000rpm离心10min,吸弃上清(离心时注意固定离心管方向、尽可能吸弃上清而不碰沉淀);再加入25μLDNA提取液2,震荡混匀至沉淀完全溶解,100℃干浴或沸水浴10min,13 000rpm离心10 min,保留上清。如果样本裂解产物当天不使用,则保存在-20℃中。
1.3.3 LAMP技术检测HBV DNA方法的建立检测HBV DNA的LAMP反应体系为:1)样本反应混合液:2×RM(PH8.8的 Tris-HCL、KCL、MgSO4、(NH4)2SO4、Tween20、Betaine、dNTPs)12 μL,FIP和BIP各4μL,F3和B3各0.5μL,Bst DNA聚合酶1.0μL,FM1.0μL,总体积为23μL。2)质控反应混合液:2×RM12.5μL,PM DNA2.5 μL,Bst DNA聚合酶1.0μL,DW 7.0μL,总体积为23.0μL。再加反应样品2μL,阳性质控加PC DNA2μL,阴性质控加DW 2μL,总体积为25μL。将PCR扩增仪调至65℃60min;80℃5min后,把上述反应液置于其中反应;反应结束,在凝胶成像仪中直接观察反应液荧光强度的变化。
1.3.4 LAMP与FQ-PCR技术检测 HBV DNA灵敏度的比较分析 对同一HBV DNA模板进行10倍梯度稀释作为扩增模板,待扩增拷贝数分别为:2.38E7、2.38E6、2.38E5、2.38E4、2.38E3、2.38E2、23.8,2.38copy/mL;分别用 LAMP与FQPCR方法检测,进行灵敏度比对实验。
1.3.5 LAMP与FQ-PCR技术检测 HBV DNA特异性的比较分析 将提取的HBV、HPV、EB病毒、大肠埃希氏菌、金黄色葡萄球菌、鲍曼不动杆菌、铜绿假单胞菌以及正常人基因组DNA分别作为扩增模板;分别用LAMP与FQ-PCR方法检测,进行特异性比对实验。
2 结果
2.1 LAMP与FQ-PCR技术检测HBV DNA灵敏度的比较
将同一 HBV DNA(2.38×107copy/mL)以10倍梯度进行系列稀释,取每一数量级的稀释液作为两种方法的扩增模板。结果显示:FQ-PCR方法的最低检测限度为10-5(见图1),LAMP方法的最低检测限度达到10-7(见图2),说明我们所建立的LAMP技术检测HBV DNA的灵敏度高于FQPCR方法。
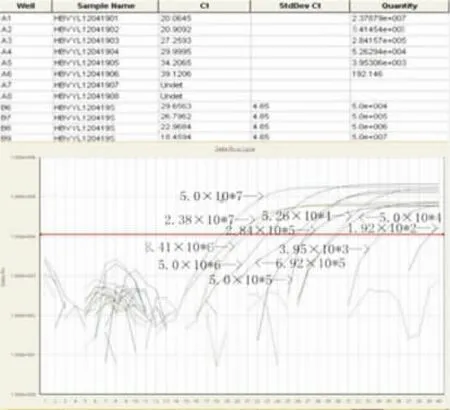
图1 FQ-PCR方法检测HBV DNA的扩增产物
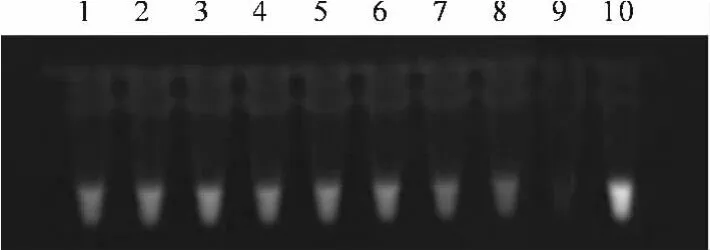
图2 LAMP技术检测HBV DNA的扩增产物
2.2 LAMP与FQ-PCR技术检测HBV DNA特异性的比较
选择HBV、HPV、EB病毒、大肠埃希氏菌、金黄色葡萄球菌、鲍曼不动杆菌、铜绿假单胞菌以及正常人基因组DNA作为两种方法的扩增模板。结果显示:HPV、EB病毒、大肠埃希氏菌、金黄色葡萄球菌、鲍曼不动杆菌、铜绿假单胞菌以及正常人基因组DNA用两种方法检测均为阴性(见图3、4)。结果表明LAMP与FQ-PCR技术都能特异地检测HBV DNA。

图3 FQ-PCR技术扩增产物
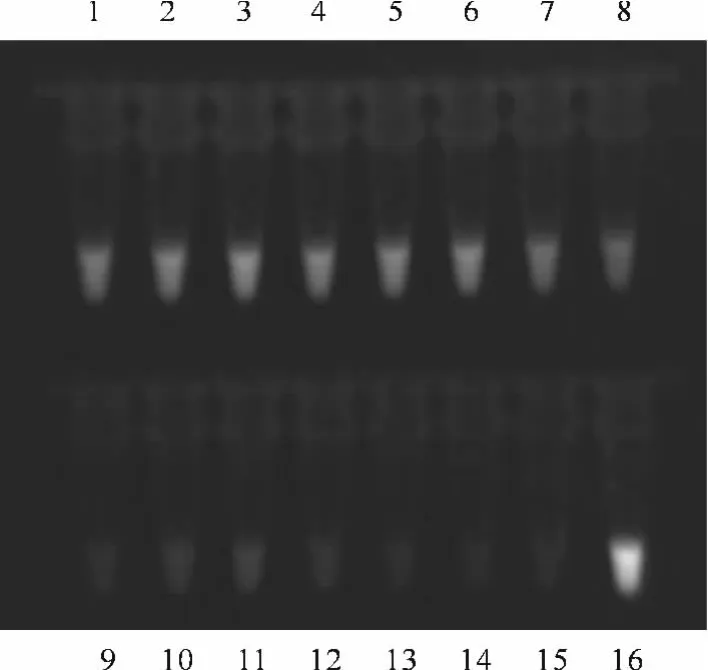
图4 LAMP扩增产物
3 讨论
FQ-PCR技术是目前灵敏度较高、特异性较好、重现性稳定的核酸分子定性、定量检测标准方法之一,克服了传统PCR技术的假阳性及不能定量等缺点,在病原体测定和基因表达研究等方面有着广泛的应用前景。但该技术有其特殊的要求:技术含量高,对人员要求也高,需要投入昂贵的仪器,结果的分析也较复杂。鉴于上述原因,FQ-PCR技术不利于在基层实验室推广应用,限制了其发展。因此,如果要让核酸扩增技术广泛普及于临床检测,特别是病原菌检测,需要对其进行改造加工。
为了解决上述不足,科学家努力寻求操作更简便、特异性更强、扩增速度更快的核酸扩增方法。2000年日本学者Notomi等[5]发明了一种新型的环介导等温扩增法(LAMP),短短几年,该技术已成功地应用于SARS、禽流感、HBV、HIV、疟原虫、结核分枝杆菌等疾病的检测中[6-10]。近年来已逐渐在科研、疾病监测与临床检测中开展起来,在2009年的甲型H1N1流感事件中,日本荣研化学公司接受WHO的邀请进行H1N1LAMP试剂盒的研制。通过荣研公司近十年的推广,LAMP技术已广泛应用于日本国内各种病毒、细菌、寄生虫等引起的疾病检测、食品化妆品安全检查及进出口快速诊断中,并得到了欧美国家的认同。与PCR技术相比,该技术针对靶基因的6个区域设计4条特异引物,增强了反应的特异性;不需要模板的热变性、长时间温度循环,利用一种链置换 DNA 聚合酶(Bst DNA polymerase)在等温条件下就能完成反应,缩短了检测时间;扩增产物呈特征性梯状条带,加入荧光染料,观察反应液的颜色变化,直接用肉眼判读结果,不需要繁琐的电泳和紫外观察等过程,操作简单、方便;不需使用昂贵的热循环仪,凝胶电泳和紫外检测等设备,成本较低,适合于病原微生物的现场快速检测、战时野外及基层普及应用。本研究中,建立的LAMP技术检测HBV DNA,通过大约60min的等温反应即可检测到2个DNA拷贝量,灵敏度高于FQ-PCR技术,且都能特异地检测HBV DNA,根据以上分析,LAMP技术更适合基层检测机构的推广使用。
由于LAMP是一种全新的核酸扩增新技术,对某一基因扩增是否成功受诸多因素的影响,可能还有某些目前所未能发现的缺陷,笔者认为基因位点的选择、引物设计的技巧、反应体系的优化等方面是今后攻关的重点。相信LAMP在今后的实践中一定能得到不断地完善和发展。
[1]Chang MH.Hepatitis B virus infection[J].J Semin Fetal Nenatal Med,2007,12:160-167.
[2]李雅娟,庄辉,李杰,等.乙型肝炎病毒感染者病毒基因型和亚型分布及其临床意义[J].中华肝脏病杂志,2005,13(10):724-729.
[3]陈园生,梁晓峰,陈丽娟,等.中国儿童乙型肝炎疫苗预防接种效果分析[J].中国计划免疫,2006,12(2):84-87.
[4]李青雅,徐秋英,刘妮,等.快速检测 HBV DNA的环状介导等温 DNA 扩增法[J].生物技术通讯,2005,16(6):647-648.
[5]Notomi T,Okayama H,Masubuchi H,etal.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Research,2000,28(12):e63-e63.
[6]李启明,马学军,高寒春,等.逆转录环介导等温核酸扩增技术(RT-LAMP)在 H5N1禽流感病毒基因检测中的应用[J].病毒学报,2008,24(3):178-184.
[7]Cai T,Lou G Q,Yang J,etal.Development and evaluation of real-time loop-mediated isothermal amplification for hepatitis B virus DNA quantification:a new tool for HBV management[J].Journal of Clinical Virology,2008,41(4):270-276.
[8]Lucchi NW,Demas A,Narayanan J,etal.Real-time fluorescence loop mediated isothermal amplification for the diagnosis of malaria[J].PLoS One,2010,5(10):e13733.
[9]Curtis KA,Rudolph DL,Owen SM.Rapid detection of HIV-1 by reverse-transcription, loop-mediated isothermal amplification(RT-LAMP)[J].Journal of Virological Methods,2008,151(2):264-270.
[10]Geojith G,Dhanasekaran S,Chandran SP,etal.Efficacy of loop mediated isothermal amplification(LAMP)assay for the laboratory identification of Mycobacteriumtuberculosis isolates in a resource limited setting [J].Journal of microbiological methods,2011,84(1):71-73.
