犬细小病毒JN株的分离鉴定及VP2基因序列分析
2013-09-21姜燕霞张淑玲王金良申识川
姜燕霞,张淑玲,王金良,申识川
(1.滨州医学院附属医院,山东滨州256603;2.滨州市妇幼保健院,山东滨州256600;3.山东省滨州畜牧兽医研究院,山东滨州256600;4.湖南省宁远县畜牧水产局,湖南宁远425600)
犬细小病毒病(Canine parvovirus disease,CPVD)是由犬细小病毒(Canine parvovirus,CPV)引起的犬的一种急性、烈性传染病,该病于1978年在美国首次发现,目前呈世界范围内流行,是危害犬类的最重要传染病之一,每年都给全球养犬业和宠物行业带来了巨大的经济损失[1-5]。CPV属于细小病毒科(Parvoviridae)细小病毒属(Parvovirus),基因组为单股线状DNA病毒,全长为5.0kb,编码2个结构蛋白(VP1、VP2),其中VP2蛋白是保护性颗粒抗原,可诱导机体产生中和抗体,VP2中的几个关键碱基和氨基酸的变化就可改变病毒的抗原特性和宿主范围[4-6]。近年来,CPV不断出现新的变异情况,分离鉴定CPV的当地流行毒株以及对结构蛋白VP2基因进行序列分析是了解和掌握CPV变异趋势的主要方法[4.6-7]。本研究从疑似犬细小病毒感染犬粪便中成功分离鉴定一株CPV,并进行了VP2基因序列分析,旨在丰富我国CPV分子流行病学资料,为CPV新型疫苗与诊断试剂的研究提供依据。
1 材料与方法
1.1 材料
1.1.1 病料 2012年4月山东济南某宠物医院收诊一例病犬,其临床症状表现主要为呕吐、体温升高、精神沉郁、排血便。其血便经犬细小病毒胶体金快速诊断试纸条检测为阳性。采集疑似犬细小病毒感染病犬的血便作为病料。
1.1.2 细胞与菌株 胎猫肾传代细胞(FK81),大肠埃希菌菌株DH5α,均由本实验室保存。
1.1.3 主要试剂 ExTaq酶、dNTP、pMD18-T载体为宝生物工程(大连)有限公司产品;DNA多功能胶回收试剂盒、质粒提取试剂盒为北京百泰克生物科技有限公司产品。
1.2 方法
1.2.1 样品的采集与处理 将采集的临床病料加入约5倍体积的灭菌生理盐水,反复冻融3次,12 000r/min离心20min,吸取上清液经0.22μm滤膜过滤,即得待分离病毒样品,置-20℃保存备用。
1.2.2 病毒分离 将待分离病毒样品接种单层猫肾细胞(FK81),同时设不接种的正常细胞作为对照,置37℃培养24h后,将细胞生长液弃去,换成细胞维持液,继续培养,每日早晚观察细胞病变,待有约80%以上细胞出现病变后,收获病毒,再传3代,置-70℃保存。
1.2.3 分离病毒血凝性的测定 取第4代病毒,按文献血凝试验(HA)的操作方法测定其对于猪红细胞的血凝性[8]。
1.2.4 分离病毒组织细胞半数感染量(TCID50)的测定 将分离的病毒株依次进行10倍系列稀释,每个稀释度分别接种96孔细胞培养板培养FK81细胞,每个稀释度接种8孔,0.1mL/孔,同时设不接种的正常细胞作为对照,观察至120h,记录病变细胞数目,按 Reed-Muench法计算分离病毒的TCID50。
1.2.5 动物回归试验 选取CPV抗体阴性犬4只,2只经皮下注射分离病毒1mL(含有104.5个TCID50),另2只犬注射灭菌生理盐水作为对照,隔离饲养,观察14d。每日观察犬的食欲、精神、粪便等状况,早晚各测量犬的体温一次,采集犬的粪拭子进行血凝测定。
1.2.6 VP2基因序列分析
1.2.6.1 引物设计与合成 利用 Oligo6.0生物学软件设计扩增CPV VP2全长基因的一对特异性引物,上 游 引 物 F:5′-ATGAGTGATGGAGCAGTTCAA-3′,下游引物 R:5′-TTAATATAATTTTCTAGGTGCTAGTTG-3′,引物由上海生工生物工程技术服务有限公司合成。
1.2.6.2 病毒基因组DNA的提取 按常规方法分别取冻融后的待分离病毒样品、收获的第4代病毒液的病毒基因组DNA。
1.2.6.3 VP2基因PCR扩增 以提取的病毒基因组DNA为模板,按常规方法进行PCR扩增。PCR扩增反应结束后,取5μL PCR扩增产物经10 g/L琼脂糖凝胶电泳初步鉴定。
1.2.6.4 VP2基因的克隆与序列分析 用DNA多功能胶回收试剂盒回收第4代病毒液VP2基因PCR扩增产物,将其与克隆载体pMD18-T于4℃连接过夜,转化DH5α感受态细胞。培养12h后,挑取单菌落,加LB液体培养基培养12h后用质粒提取试剂盒提取质粒DNA,利用EcoRⅠ/SalⅠ双酶切鉴定得到pMD-VP2阳性重组质粒,送上海生工生物工程技术服务有限公司进行测序测定,将测序结果应用DNA Star生物学软件与GenBank中8株CPV VP2基因序列进行比较分析。
2 结果
2.1 病毒分离结果
将病料样品接种单层FK81,5d后可见细胞特征性病变非常明显,细胞逐渐圆缩,死亡细胞聚集在一起出现明显的拉网现象,脱落(图1A)。收获病毒,继续传3代后,细胞特征性病变依然存在。收获第4代病毒,将其命名为JN株,置-70℃冷冻保存。
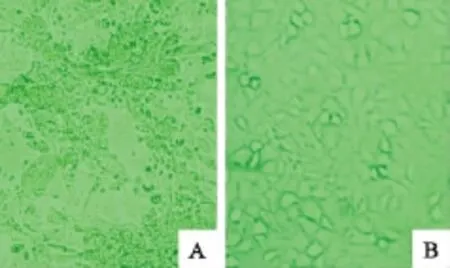
图1 FK81细胞病变情况Fig.1 The FK81cytopathogenesis
2.2 病毒血凝性测定结果
按常规血凝试验方法测定JN株第4代病毒对猪红细胞的血凝效价为1∶512。
2.3 病毒TCID50的测定结果
按Reed-Muench法计算JN株病毒的TCID50为10-3.5/0.1mL。
2.4 动物回归试验结果
2只犬在攻毒后4d开始表现食欲减退,精神沉郁,腹泻、血便,同时体温开始升高,犬的粪拭子开始具有血凝性。第10天和第11天2只攻毒犬先后死亡,剖检病死犬可见全身脱水和消瘦,空肠和回肠局部充血,肠管内壁弥漫性出血,肝脏出血,脾脏肿大。对照组2只犬没有表现任何临床症状。
2.5 VP2基因PCR扩增结果
PCR扩增产物经10g/L琼脂糖凝胶电泳(图2),在位于约1 755bp处可见特异性DNA扩增条带,与预期大小一致。
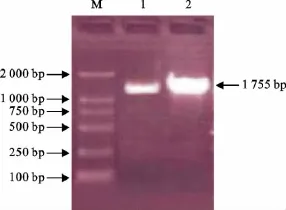
图2 VP2基因PCR扩增结果Fig.2 The PCR products of VP2gene
2.6 VP2基因的序列鉴定结果
JN株第4代分离毒VP2基因的PCR扩增产物纯化后,连接到PMD18-T克隆载体上构建pMDVP2重组质粒,经EcoRⅠ/SalⅠ双酶切鉴定得到了约2 700bp片段(pMD18-T载体)和1 755bp片段(VP2基因)(图3),将pMD-VP2重组质粒送上海生工生物工程技术服务有限公司测序,测序结果与GenBank中的8株CPV VP2基因同一序列进行核苷酸序列同源性比较分析发现(图4和图5),JN株属于CPV-2a亚型,与其他8株CPV的核苷酸同源性在98.7%~99.6%之间。

图3 重组质粒pMD-VP2酶切鉴定Fig.3 Identification of recombinant plasmid pMD-VP2by enzyme digestion
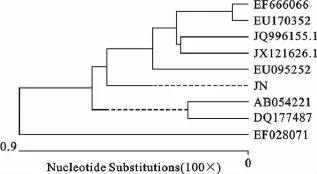
图4 不同毒株的VP2基因系统进化树分析Fig.4 Different strains of VP2gene phylogenetic tree analysis

图5 不同毒株的VP2基因序列核苷酸同源性Fig.5 The nucleotide homology of VP2gene sequences in different strains
3 讨论
本研究从山东省济南某宠物医院临床表现为呕吐、高温、精神沉郁、排血便的犬中分离得到一株CPV毒株,命名为JN株。该病毒对猪红细胞的血凝效价为1∶512;Reed-Muench法测定该株病毒的TCID50为10-3.5/0.1mL;动物回归试验中经皮下注射该病毒1mL的健康犬4d开始表现呕吐、血便、发热等典型的细小病毒症状,病死率达100%,表明该毒株为强毒株。将该病毒的VP2基因克隆后测序,结果显示该病毒为CPV-2a亚型,VP2基因序列与GenBank中的8株CPV VP2基因序列核苷酸同源性在98.7%~99.6%之间。鉴于VP2蛋白在诱导抗病毒感染反应中所起的免疫保护性作用,VP2基因成为细小病毒新型疫苗与诊断试剂研究的热点,也是CPV分子流行病学调查的首选基因。CPV自被发现以来一直在不断变异,已引起很多学者的普遍关注。随着我国养犬业和宠物行业的不断发展,国内犬数量不断增加,CPV发病率也一直居高不下,严重阻碍我国养犬业的健康发展,急需加强CPV诊断与流行病学方面研究工作,了解不同地方CPV发病及流行情况,对预防和控制CPV具有十分重要的现实意义[8-12]。本研究成功分离了CPV JN株病毒并进行了该毒株VP2基因的序列分析,丰富了国内CPV分子流行病学资料,同时也为本实验室进行CPV基因工程疫苗与新型诊断试剂的研究奠定了基础。
[1] 史利军,曾 妮,李 刚.犬细小病毒生物学特征及检测技术研究进展[J].动物医学进展,2010,31(4):82-85.
[2] Gray L K,Crawford P C,Levy J K,et al.Comparison of two assays for detection of antibodies against canine parvovirus and canine distemper virus in dogs admitted to a Florida animal shelter[J].J Am Vet Med Assoc,2012,240(9):1084-1087.
[3] Pinto LD,Streck A F,Goncalves K R,et al.Typing of canine parvovirus strains circulating in Brazil between 2008and 2010[J].Virus Res,2012,165(1):29-33.
[4] Muz D,Oguzoglu T C,Timurkan M O,et al.Characterization of the partial VP2gene region of canine parvoviruses in domestic cats from Turkey[J].Virus Gen,2012,44(2):301-308.
[5] Filipov C,Decaro N,Desario C,et al.Canine parvovirus epidemiology in Bulgaria[J].J Vet Diagn Invest,2011,23(1):152-154.
[6] 毕峻龙,毛爱国,杨贵树,等.一株犬细小病毒云南毒株生物学特性分析[J].中国畜牧兽医,2011,38(7):91-95.
[7] 梁璐琪,张 恒,魏胜男,等.藏獒源犬细小病毒的分离鉴定[J].中国兽医科学,2012,42(2):144-149.
[8] 赵桂秀,王 冰,韩小蕾.犬细小病毒病的诊断及不同年龄治愈率的效果观察[J].畜禽业,2012,282(10):96-97.
[9] 李 润,李 宁,印春生,等.犬细小病毒DD株的分离鉴定和VP2基因序列分析[J].中国兽药杂志,2011,45(10):7-9.
[10] 肖博仁,罗 维,刘崇灵,等.长沙9个犬细小病毒毒株的分离与鉴定[J].湖南农业大学学报,2012,38(3):296-299.
[11] 马 辉,赵绪永.犬细小病毒VP2主要抗原表位区的原核表达载体构建及诱导表达[J].郑州牧业工程高等专科学校学报,2012,32(2):9-11.
[12] 孙 宁.犬细小病毒自家灭活疫苗的血凝抑制抗体测定[J].浙江畜牧兽医,2012(4):38-39.
