猪流行性腹泻病毒HB/FN株S基因的克隆、原核表达及免疫原性分析
2013-09-21王晨枫左玉柱裴丽华范京惠
王晨枫,左玉柱,裴丽华,杨 震,范京惠
(河北农业大学动物科技学院,河北保定071001)
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由冠状病毒科冠状病毒属的猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)[1]引起的以严重腹泻和仔猪高致死率为主要特征的传染病。该病首次报道于英国,随后许多国家相继报道[2],我国于1976年发现此病[3]。目前该病已成为中国甚至亚洲最常见的猪腹泻性传染病之一[4]。因此,PED的防控研究具有重要的意义。PED呈地方流行性,PEDV在流行的过程中为更好地适应环境,会发生变异,不同地区的毒株有显著差异,地区相距越远、环境差异越大的地方毒株差异越大。研究发现,S基因相比较于其他基因更易发生变异[5-8],S蛋白是诱导机体产生中和抗体和提供免疫保护作用的主要结构蛋白[9-10],具有高度免疫原性,此外,感染PEDV猪血清中的抗S蛋白抗体持久,可在长时间中检测到S蛋白的抗体。这些特性使其成为猪流行性腹泻的主要早期诊断蛋白。本研究对PEDV S基因抗原性较高的片段进行克隆并测序,利用大肠埃希菌表达系统对重组S蛋白进行表达和纯化,为建立PEDV的快速、敏感、特异的免疫学检测方法提供物质基础。
1 材料与方法
1.1 材料
1.1.1 毒株与实验动物 猪流行性腹泻病毒华北抚宁株(HB/FN)由河北农业大学兽医微生物实验室保存;6周龄~8周龄SPF级Balb/c小鼠购于北京东大实验动物中心。
1.1.2 主要试剂 Trizol为GIBCO公司产品;MMLV反转录酶、Taq DNA聚合酶、T4DNA连接酶、限制性内切酶BamHⅠ、XhoⅠ、pMD19-T载体、250bp DNA Marker、DNA Marker DL 5 000等为宝生物工程(大连)有限公司产品;DNA胶回收试剂盒、小量质粒纯化试剂盒、HRP标记的羊抗兔IgG羊及抗鼠IgG为CWBIO公司产品;E.coli DH5α感受态细胞和蛋白Marker为TransGen公司产品;蛋白纯化试剂盒B-PER(r)6×His Spin Purification kit为PIERCE公司产品;TMB、完全弗氏佐剂(FCA)和不完全弗氏佐剂(FCIA)为SIGMA公司产品;pET-28a(+)载体、pET-32a(+)载体、pGEX-6p-1载体、Vero细胞、E.coli BL21(DE3)以及兔抗PEDV的阳性血清由河北农业大学兽医微生物实验室制备。
1.2 方法
1.2.1 引物的设计与合成 参照GenBank中发表的PEDV中国LZC株S基因序列(登录号EF185992.1),并且根据pMD 19-T 克隆载体的特点,用Primer5.0软件设计了一对引物,在上游引物引入BamHⅠ酶切位点,下游引入XhoⅠ酶切位点,预期扩增产物大小为1 080bp。引物序列为:SP1:5′-ATGTATTCTGTTACGCCATG-3′;SP2:5′-TTATACGGTAAGTTGGGTCA-3′。
1.2.2 S基因的克隆与序列测定 猪流行性腹泻病毒HB/FN株于Vero细胞上培养72h,反复冻融3次。取250μL病毒培养液,加入750μL Trizol抽提RNA并进行反转录,得到的产物进行PCR扩增。将PCR产物与pMD19-T经T4连接酶连接,转化到E.coli DH5α感受态细胞,挑取白色菌落,接种于氨苄LB培养基中,37℃培养12h后用小量质粒提取试剂盒提取质粒,对该质粒进行PCR及酶切鉴定和测序。
1.2.3 优势抗原表位的选取和重组表达载体的构建 测序结束后,将基因序列登陆于GenBank。对扩增片段进行抗原性分析,选取抗原性较高的一段设计对应的引物:SP1(Bam2145)5′-GGATCCATGGTTATTTCTAGTTTG -3;SP2(Xol2800)5′-CTCGAGTTAGACTAGATCTGCCA-3,扩增得到一段655bp的基因序列,同样连到pMD19-T载体上,命名为SFN-T。分别将SFN-T和表达载体用限制性内切酶BamHⅠ和XhoⅠ双酶切后回收带有相互匹配黏性末端的SFN和表达载体,经T4DNA连接酶连接,构建出重组表达载体pET-28a(+)-SFN、pET-32a(+)-SFN、pGEX-6p-1-SFN。将表达载体转化Rosetta(DE3)感受态细胞后,用小量质粒提取试剂盒提取质粒并进行电泳检测和酶切鉴定。
1.2.4 PEDV S基因的表达及表达产物的SDSPAGE分析 将表达载体空载体菌种分别接于LB培养基中,200r/min振摇培养12h,取500μL菌液转接于50mL LB培养基中,37℃振摇培养至对数生长期(OD 600nm值=0.6~1.0),加入终浓度为1 mmol/L的IPTG,在20℃振摇诱导培养,分别于诱导后0、2、3、4、5h取样1mL,12 000r/min离心1 min,弃上清。沉淀用50μL PBS重悬后,加入等体积的上样缓冲液,变性仪变性5min,12 000r/min离心1min取上清进行SDS-PAGE电泳。
1.2.5 重组蛋白的纯化及 Western blot分析 将在28℃条件下用终浓度为1mmoL IPTG诱导5h后的菌体离心,PBS重悬后进行超声波裂解,分别收集上清沉淀进行SDS-PAGE检测。按PIERCE公司的B-PER(r)6×His spin purification kit蛋白纯化试剂盒的纯化程序对菌体蛋白进行纯化。将纯化的蛋白进行SDS-PAGE电泳,采用湿转法将蛋白及Marker转印到NC膜,将NC膜放入封闭液中37℃慢摇封闭1h,用PBST洗膜3次,每次10min;加入为1∶100的兔抗PEDV的阳性血清。室温下轻摇1h,用PBST洗膜3次,每次10min;然后加1∶1 000稀释的HRP标记的羊抗兔IgG,室温下轻摇1 h,再用PBST洗涤2次,每次10min;最后置于DAB显色液中避光显色15min后用蒸馏水终止反应。
1.2.6 ELISA检测方法的建立 取PEDV HB/FN毒株在Vero细胞上的培养72h的培养液反复冻融3次后,8 000r/min离心15min后沉淀,上清液以20 000r/min超速离心2h,把上清液浓缩,测定蛋白浓度后分装。按常规ELISA程序进行试验确定最适工作条件。
1.2.7 纯化蛋白的免疫原性分析 纯化的S蛋白经SDS-PAGE和Western blot分析后,使用超微量紫外分光光度计(Micro-Spectrophotometer)测定蛋白浓度。将纯化的S蛋白分别用弗氏完全佐剂和弗氏不完全佐剂按1∶1比例混合乳化,接种6周龄~8周龄SPF级Balb/c小鼠5只,并设对照组。分别于免疫前、首免后7d、14d、21d和30d时测定小鼠抗体水平以确定纯化蛋白的免疫原性。
接种程序:弗氏完全佐剂首免,以后每隔7d用弗氏不完全佐剂免疫小鼠。
2 结果
2.1 PEDV S基因的PCR扩增及鉴定
以加入限制性内切酶BamHⅠ和XhoⅠ酶切位点的SP1/SP2为引物,进行PCR扩增,得到的DNA于10mg/L琼脂糖凝胶中电泳观察结果,在约1 000 bp处出现一条特异的DNA带,与预期扩增的S基因大小相符。将此片段用试剂盒回收,回收产物连入pMD19-T,构建重组质粒。参照pMD19-T载体图谱,用限制性内切酶BamHⅠ和XhoⅠ对重组质粒进行进行双酶切,出现一条1 080bp左右的目的片段和一条2 692bp左右的pMD19-T载体片段,与预期结果相符(图1)。将阳性重组质粒进行序列测序,测序结果表明,扩增基因片段长1 080bp,与GenBank参考株的PEDV S基因进行Blast序列比对,同源性一致。将克隆得到的S基因登陆于Gen-Bank,获得序列号JQ862712。
2.2 S基因优势抗原表位基因克隆载体的建立与鉴定
对S基因进行抗原性分析,选取抗原性较高的655bp基因作为连入表达载体的目的基因,同样连到pMD19-T载体上,命名为SFN-T。用限制性内切酶BamHⅠ和XhoⅠ对重组质粒进行进行双酶切,出现一条约655bp的目的条带和一条约2 692bp的pMD19-T载体片段,与预期结果相符(图2)。
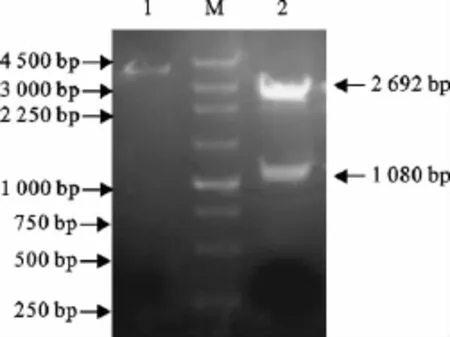
图1 重组质粒的双酶切鉴定Fig.1 Identification of the recombinant plasmid by double enzyme digestion
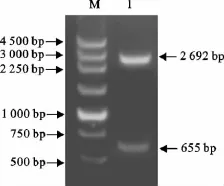
图2 重组质粒SFN-T的双酶切鉴定Fig.2 Identification of the plasmid SFN-T by double enzyme digestion
2.3 重组表达载体的构建及表达
用BamHⅠ、XhoⅠ对重组质粒pET-28a(+)-SFN进行双酶切及PCR鉴定(图3),分别出现一条5 000bp和650bp左右的条带,说明目的基因正确插入到表达载体。将含有阳性重组载体的大肠埃希菌在IPTG诱导下,不同诱导时间的产物经SDSPAGE检测,结果在约25ku处可见表达条带,与预期蛋白大小相一致(图4),而未诱导菌和空载体菌均没有出现此蛋白条带,与诱导前对照菌相比,诱导5h时表达量最高。
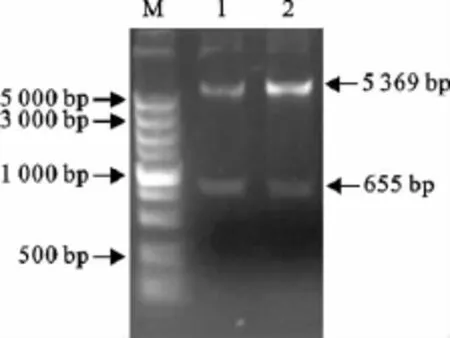
图3 重组质粒pET-28a(+)-SFN的双酶切鉴定Fig.3 Identification of the plasmid pET-28a(+)-SFN by double enzyme digestion
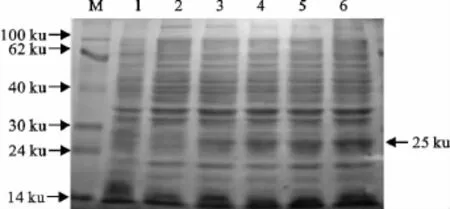
图4 诱导不同时间重组菌的SDS-PAGE分析Fig.4 SDS-PAGE of the expressed recombinant protein induced in different time
2.4 纯化S蛋白的Western blot检测
收集诱导5h后的菌体沉淀进行超声波裂解,对裂解上清和裂解沉淀进行SDS-PAGE分析可知蛋白是以包涵体形式进行表达。对裂解沉淀进行处理后用His标签纯化试剂盒对菌体裂解蛋白进行对纯化。SDS-PAGE分析可知纯化效果较好,洗脱峰1和2蛋白量较大(图5)。用兔抗PEDV的阳性血清作为一抗,HRP标记的羊抗兔IgG作为二抗,对洗脱峰2进行Western blot检测。结果显示,在一抗为1∶100和二抗为1∶1 000时pet-28a(+)-SFN阳性菌表达产物就可出现大小约25ku的特异性反应条带(图6),表明重组蛋白可被PEDV阳性免疫血清识别。
2.5 ELISA检测方法
经过多次试验分析,最终确定了ELISA检测方法的条件:HB/FN病毒抗原经4℃包被过夜,洗涤;用封闭液(含50mL/L犊牛血清的PBST)37℃封闭1h;加入用封闭液进行1∶100倍稀释的待检血清100μL,于37℃反应1h,洗涤;加入用封闭液进行1∶1 000倍稀释的二抗100μL,于37℃反应45 min,洗涤;加入100μLTMB显色液避光显色15 min;加入终止液50μL后测定OD450nm值。
2.6 重组蛋白的免疫原性分析
纯化的S蛋白用SDS-PAGE和 Western blot分析后用超微量紫外分光光度计测蛋白浓度,重复5次。分别为0.409,0.413,0.391,0.399,0.402 mg/mL,取其平均值约为0.4mg/mL。将纯化的S蛋白分别用弗氏完全佐剂和弗氏不完全佐剂按1∶1比例混合乳化,接种6周龄~8周龄SPF级Balb/c小鼠5只,每只250μL,对照组不接种。分别于免疫前、首免后7、14、21d时尾静脉采血,检测小鼠抗体(表1)。在第14天时小鼠的抗体水平明显超过对照组,在免疫后21d血清OD450nm值达到1.0以上。
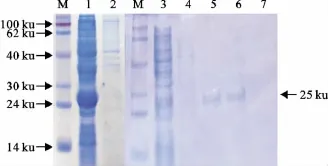
图5 S蛋白纯化的SDS-PAGE分析Fig.5 SDS-PAGE analysis of S protein purification
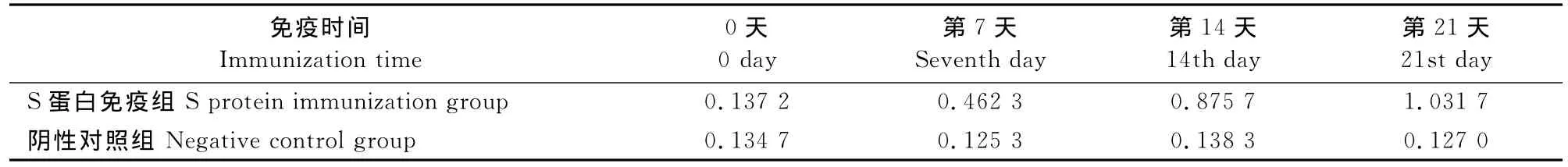
表1 抗体效价的ELISA检测结果均值(OD450nm)Table 1 Average results of antibody titers detected by ELISA(OD450nm)

图6 纯化S蛋白的Western blot检测Fig.6 Western blot detection of purified S protein
3 讨论
近年来,各类病毒引起的仔猪腹泻极为流行,严重影响仔猪的生长发育,给养猪业带来巨大的经济损失。中国农科院哈尔滨兽医研究所对猪的几种腹泻病进行RT-PCR检测的结果显示[6],我国的养猪业因病毒感染而导致腹泻的主要病毒中,PEDV占46%,猪轮状病毒(Porcine rotavirus,PRV)占8%,猪传染性胃肠炎病毒(Transmissible gastroenteritis virus,TGEV)占15%,可见PEDV俨然成为当前国内猪群腹泻流行的最主要原因。PEDV感染无特效治疗药物,且PED与其他腹泻类疾病在临床上区别难度大。研究发现,PEDV最早排毒出现在感染后2d到6d,在症状出现前即排毒,临床症状消失后很长一段时间仍可在其粪便中要检出[11]。因而,建立新型科学便捷的检测方法可有效防止病毒传染。
病毒可以作为抗原包被ELISA板建立检测方法,但PEDV细胞培养病毒难度大,病毒产量低,一定程度限制了检测抗原的大量制备[12-13],使得细胞毒临床应用价值低,仅局限于实验室检测。目前,检测PEDV抗体的主要诊断技术有病毒中和试验(VN)、免疫荧光抗体试验(IFA)和ELISA 等[1],但缺点是耗时和昂贵,胶体金试纸条作为新兴的检测方法,具有快速准确方便等特点,符合基层的需要。河北农业大学兽医微生物实验室已经得到了华北地区的7段M基因[14],5段S基因,全部登陆于Gen-Bank。国内其他实验室的PEDV M蛋白的单抗制备也在进行中[15]。由于S基因全长4 152bp,编码1 383个氨基酸残基,完整的S基因扩增和表达难度大,所以国内外的抗原研究集中在M蛋白上,对于S蛋白和N蛋白等的研究还很少。S蛋白是暴露于病毒表面的纤突蛋白,且产生的抗体水平持续时间比M蛋白要长,用S蛋白作为检测抗原更可靠。
综上所述,对从PEDV HB/FN株中扩增得到的S基因片段进行克隆,选取其中一段抗原性较高的片 段,构 建 pET-28a(+)-SFN、pET-32a(+)-SFN、pGEX-6p-1-SFN 3种表达系统。作为原核表达体系的优化,表达的温度和IPTG的浓度对表达水平影响也很大。一般在15℃~42℃之间都能获得成功表达,但表达每一种特定蛋白质的最适温度范围则可能很窄,只有2℃~4℃的范围[16]。经分析,这3种表达载体在IPTG终浓度为1mmol/L,28℃诱导后都出现了对应的目的条带。表达载体pET-28a(+)-SFN表达的S蛋白量大,且分子质量小,仅为25ku。利用pET-28a(+)载体带有特异的6×His标签,对重组蛋白进行纯化得到了0.4 mg/mL的S蛋白。Western blot分析可看出纯化的S蛋白可以与兔免疫PEDV血清反应。将纯化的S蛋白免疫小鼠,小鼠抗体水平在免疫后14d抗体水平明显高于对照组,试验说明纯化的S蛋白具有很好的免疫原性,可用作免疫蛋白进行后续研究。利用亲和层析纯化带有6×His的重组S蛋白,可以作为一种新型制备PEDV检测抗原的方法。将制备基于S蛋白的PEDV免疫胶体金检测试纸条,从而快速检测PEDV抗体,用于猪流行性腹泻病毒的早期检测。
[1] 殷 震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997:439-440.
[2] 斯特劳B E.猪病学[M].8版.赵德明,张仲秋,沈建忠,译.北京:中国农业大学出版社,2000:181-187.
[3] 程庆华,牛小迎,叶成玉.青海地区猪流行性腹泻病调查[J].青海畜牧兽医杂志,1992,22(3):22-23.
[4] Sun D B,Feng L,Shi H Y,et al.Identification of two novel B cell epitopes on porcine epidemic diarrhea virus spike protein[J].Vet Microbiol,2008,131(1/2):73-81.
[5] Straw B E,Zimmerman J J,Allaire S D,等.猪病学[M].9版.赵德明,张仲秋,沈建忠,等,译.北京:中国农业大学出版社,2008:399-406.
[6] 甘振磊,汤德元,李春燕.猪流行性腹泻流行特点及流行现状的研究[J].猪业科学,2010(12):24-28.
[7] 陈建飞,冯 力,时洪艳.猪流行性腹泻病毒CH/S株N蛋白基因的遗传变异及其原核表达[J].中国预防兽医学报,2007(11):177-181.
[8] 杨 敏.猪流行性腹泻病毒结构蛋白基因的克隆与特征分析[D].甘肃兰州:甘肃农业大学,2007.
[9] Chang S H,Bae J L,Kang T J,et al.Identification of the epitope region capable of inducing neut ralizing antibodies against the porcine epidemic diarrhea virus[J].Molecul Cell,2002,14:295-299.
[10] Kang T J,Seo J E,Kim D H,et al.Cloning and sequence analysis of the Korean strain of spike gene of porcine epidemic diarrhea virus and expression of its neut ralizing epitope in plants Protein[J].Exp Purification,2005,41:378-383.
[11] 徐国栋,李 峰,张广峰.国内猪流行性腹泻防治概况[J].畜牧与兽医,2011,43(12):88-89.
[12] Kim O,Chae C.In situ hybridization for t he detection and localization of porcine epidemic diarrhea virus in t he intestinal tissues from naturally infected piglets[J].Vet Pathol,2000,37(1):62-67.
[13] 孙东波,冯 力,时洪艳,等.猪流行性腹泻病毒分子生物学研究进展[J].动物医学进展,2006,27(10):11-14.
[14] Fan J H,Zuo Y Z,Li J H,et al.Eterogeneity in membrane protein genes of porcine epidemic diarrhea viruses isolated in China[J].Virus Gen,2012,45(1):113-117.
[15] 张志榜,陈建飞,冯 力.等.猪流行性腹泻病毒 M蛋白单克隆抗体的制备及鉴定[J].中国预防兽医学报,2011,33(7):569-570.
[16] 易立.犬细小病毒的分离鉴定、序列分析及VP2基因的融合表达[D].北京:中国农业科学院,2008.
