禽呼肠病毒S1733株σNS 单克隆抗体的制备及其特性鉴定
2013-09-21谢志勤谢芝勋刘加波庞耀珊邓显文谢丽基罗思思
谢志勤,谢芝勋,刘加波,庞耀珊,邓显文,谢丽基,范 晴,罗思思
(广西壮族自治区兽医研究所 广西畜禽疫苗新技术重点实验室,广西南宁530001)
鸡关节炎是由禽呼肠病毒(Avian reovirus,ARV)引起的危害商品雏鸡的一种病毒病,随着养鸡业的发展,该病的发生也越来越来常见。由禽呼肠病毒引起的临床症状主要为雏鸡关节炎、腱鞘炎,严重时出现鸡关节肿大,站立不稳,从而导致吸收障碍,抵抗力下降,很容易继发其他病原的感染而导致死亡,造成很大的经济损失[1]。
禽呼肠病毒是双股RNA病毒,属于呼肠病毒科、呼肠病毒属,其基因组由大(L)、中(M)和小(S)三组基因组成,分为10个节段,σNS基因属于S基因组中S4基因,其编码的蛋白是一种较小的非结构蛋白,具有单股RNA(ssRNA)结合活性,目前已知的σNS蛋白功能与病毒中mRNA有关,并且与基因组的复制有关[2-4]。
目前,对禽呼肠病毒的检测已建立了很多方法,主要有病毒中和试验、琼脂扩散试验、ELISA[5]、RT-PCR[6]和荧光定量 RT-PCR[7-9]等,基于单克隆抗体(mAb)建立的免疫检测技术,具有特异性强和敏感度高的优点,在疾病诊断方面已得到了广泛的应用。目前,未见有针对ARVσNS的单克隆抗体,本研究利用σNS蛋白筛选出抗ARVσNS蛋白的特异性单克隆抗体,并对其生物学特性进行鉴定,为建立一种敏感、特异、快速、简便的ARV临床检测方法奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株 ARV S1733毒株,由美国康州大学Khan博士惠赠;骨髓瘤细胞SP2/0由美国宾夕法尼亚州州立大学动物诊断中心刘教授惠赠;ARV R1、ARV R 2以及鸡新城疫病毒(LaSota,NDV)、H9亚型禽流感病毒(AIV H9)、鸡传染性支气管炎病毒M41(IBV M41)、鸡传染性喉气管炎病毒(ILTV)、鸡传染性法氏囊病病毒(IBDV)由广西畜禽疫苗新技术重点实验室保存。
1.1.2 鸡胚和实验动物 SPF种蛋购自北京梅里亚公司,经本实验室于37℃严格无菌孵化,供病毒增殖用;Balb/c小鼠,购自广西医科大学实验动物中心。
1.1.3 主要酶与剂试 预染低分子质量蛋白MarkerⅢ,购自天根生物公司;弗氏完全佐剂,弗氏不完全佐剂,胎牛血清,1640改良培养基,细胞融合剂(PEG-4000),HRP/FITC 标 记的 羊 抗 鼠IgG,BCIP/NBT,HAT,HT选择培养基,丙烯酰胺,甲叉双丙烯酰胺,TEMED,Tris碱和过硫酸铵,均购自Sigma公司;其他试剂为分析纯国产试剂。
1.2 方法
1.2.1 抗原的增殖 将ARV S1733毒株用灭菌的PBS溶液进行100倍稀释后,卵黄囊腔接种8日龄的SPF鸡胚0.2mL,37℃培养,弃去24h内的死胚,收获24h~96h内死胚的尿囊液和尿囊膜。尿囊膜用灭菌研钵进行研磨,然后与尿囊液混合,在-70℃冻融3次,直接用于病毒的纯化或置-70℃保存备用。
1.2.2 抗原的浓缩与纯化 将收获的病毒液以8 000r/min离心15min,收集上清液用病毒浓缩仪和浓缩过滤器(Master Flex console driver,7520-47,美国Thermo Fisher Scientific产品)进行1/5浓缩;经浓缩的病毒液用250g/L~700g/L的蔗糖进行密度梯度离心纯化,40 000r/min离心4h,收集病毒,用PBST溶液洗涤,20 000r/min离心2h,收集沉淀即为纯化的病毒,用SDS-PAGE分析并用碧云天BCA蛋白浓度测定试剂盒(碧云天生物技术研究所,产品编号:P0012)测定病毒浓度。
1.2.3 免疫Balb/c小鼠 取健康6周龄Balb/c小鼠3只,将纯化的病毒测定浓度后,按首免注射100 μg的剂量与等体积弗氏完全佐剂乳化,二免、三免各注射100μg的剂量与等体积弗氏不完全佐剂乳化,腹腔注射免疫Balb/c小鼠,四、五次免疫不用佐剂,各免注射100μg的剂量。首次与二次免疫间隔20d,三、四、五次免疫间隔3d~7d不等,五次免疫3d后尾静脉采血,测定静脉血中的抗体效价,选效价高的小鼠进行细胞融合试验。
1.2.4 间接ELISA筛选方法的建立 将纯化的ARV按一定的浓度包被ELISA板,包被液为4℃保存的0.05mol/L 碳酸缓冲液(pH9.6),然后用小鼠制作的ARV阳性血清进行系列稀释后作为一抗,浓度从1∶100倍比稀释到1∶6 400,加到ARV包被的ELISA板进行方阵试验,以确定最佳的抗原包被浓度以及抗体稀释度浓度,确定阴阳性临界值,以阳性血清和抗原的OD值最接近于1.0时的最大稀释浓度作为抗原抗体的最适工作浓度,建立间接ELISA检测方法。
1.2.5 融合细胞的筛选和单克隆抗体的制备 细胞融合、腹水制备、单克隆抗体的纯化按常规方法[10]进行。利用已建立好的间接ELISA方法进行筛选。
1.2.6 单克隆抗体效价的测定及鉴定 利用已建立的间接ELISA方法检测小鼠腹水效价;对杂交瘤细胞分泌的单克隆抗体(细胞上清液)用Southern-Biotech公司出产的SBA ClonotypingTM System/HRP单克隆抗体分型试剂盒进行鉴定,操作步骤按试剂盒说明书进行。
1.2.7 单克隆抗体特异性鉴定
1.2.7.1 Western blot检测 采用变性还原SDSPAGE,浓缩胶配制为60g/L,分离胶配制为120 g/L,σNS蛋白上样量每孔为20μL含30mg/mL,与上样溴酚蓝混合,沸水中煮5min,60V电压至分离胶与浓缩胶交汇处,然后改用120V电压至溴酚蓝到达底部。用Invitrogen公司生产的电转移仪iBlot(型号:10048044)及转移试剂盒 (iBlot Gel Transfer Stacks PVDF,Regular,型号:IB4010-01)将病毒蛋白转移到硝酸纤维膜上,用50g/L的脱脂奶固定1h,用PBST溶液洗膜3次,用制备的单抗腹水按1∶200稀释后加到硝酸纤维膜上,37℃作用1h后,用PBST溶液洗膜3次,加入磷酸酶标志的羊抗鼠二抗,37℃作用1h后,用PBST溶液洗膜3次,加入BCIP/NBT进行显色10min。
1.2.7.2 Dot-ELISA 检测 将纯化的σNS蛋白、ARV S1733、ARV R1和ARV R2以及NDV、AIV、IBV、ILTV、IBDV各10μL分别点在NC膜上,在超净工作台干燥后加入50g/L的脱脂奶粉于37℃封闭1h,PBS洗涤后分别加入经稀释的单克隆抗体及SP2/0骨髓瘤细胞培养上清,37℃作用1h后,加入磷酸酶标记的羊抗鼠IgG抗体,37℃作用1h后,用PBS液洗涤3次,每次5min,然后加入显色液进行显色,观察结果。
1.2.7.3 直接免疫荧光(DFA)法检测 用9日龄的SPF鸡胚制备鸡胚成纤维细胞,细胞在24孔板中长成单层后,用ARV S1733毒株感染鸡胚成纤维细胞,37℃培养30h后,在显微镜下观察有细胞病变出现,用丙酮和乙醇进行固定30min,比例为3∶2,吸出固定液,然后分别加入用FITC标记的σNS蛋白单克隆抗体及SP2/0骨髓瘤细胞培养上清,37℃作用1h,用PBS溶液洗涤3次后,荧光显微镜下观察结果。
1.2.7.4 病毒中和试验 参照文献[11]的方法测定ARV的EID50,采用固定病毒的方法,将单克隆抗体倍比稀释后与相同体积的200EID50/0.2mL的ARV S1733毒株充分混匀,同时设ARV S1733阳性和阴性对照,37℃作用1h,然后接种于生长良好的96孔细胞板单层的成纤维细胞中,于体积分数为5%的CO2培养箱中37℃培养48h。用直接免疫荧光(FA)的方法进行病毒中和检测,记录细胞的病变和荧光情况。
2 结果
2.1 抗原的浓缩与纯化
利用病毒浓缩仪和浓缩过滤器收集的病毒,再经过蔗糖密度梯度离心获得的纯化病毒,经测定浓度为40.5mg/mL。
2.2 间接ELISA筛选方法的建立
将纯化的ARV测定其浓度后包被酶标板,加入一抗和二抗后经方阵试验,确定最佳的σNS蛋白抗原工作浓度为25μg/mL,抗体稀释度浓度为1∶800,封闭液为10g/L的BSA,37℃孵育1h;酶标二抗稀释度为1∶1 000,37℃孵育1h;洗液为含0.5mL/L吐温-20的PBS。
2.3 杂交瘤细胞分泌抗体的测定
应用建立的σNS蛋白ELISA检测方法对杂交瘤细胞分泌的抗体进行测定,初步判为阳性的有3孔,再次筛选阳性为1个孔,然后进行3次亚克隆,最后获得1株能稳定分泌抗ARVσNS蛋白抗体的阳性杂交瘤细胞株,命名为SB2-1K3。扩大培养获得的细胞株,离心收集细胞后注入Balb/c小鼠腹腔并制备出腹水,经测定效价为1∶10 000以上。
2.4 单克隆抗体亚类的鉴定
用SBA ClonotypingTM System/HRP单抗分型系统对制备的1株分泌单克隆抗体进行鉴定,鉴定结果为IgG 1亚类单克隆抗体,其轻链均为κ链(表1)。
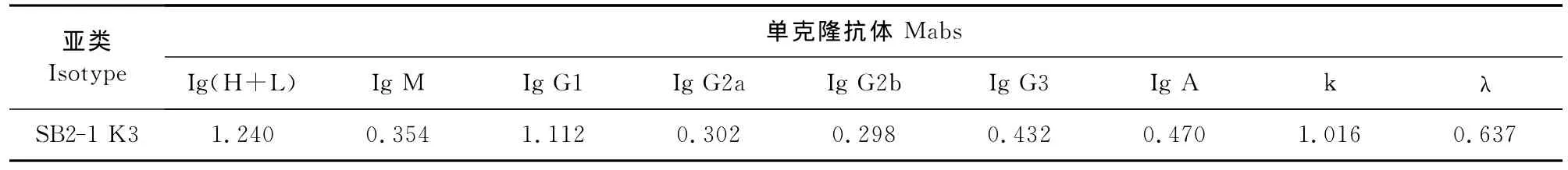
表1 细胞上清反应性与单克隆抗体亚类的鉴定结果Table 1 The results of reactivity of hybridoma supernatant and isotype of monoclonal antibodies
2.5 Western blot检测
纯化的σNS蛋白经SDS-PAGE变性电泳,考马斯亮蓝染色后出现了2条分别约为66ku和27 ku的蛋白带,经Western blot后,ReoS1733和分离株R1只出现约为66ku的蛋白带(图1)。
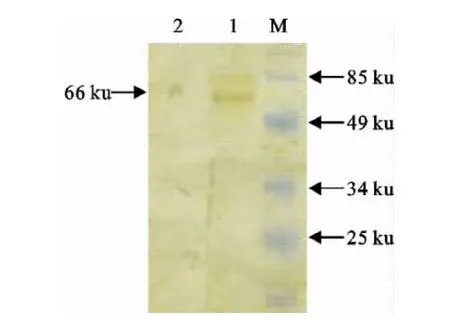
图1 单抗Western blot检测结果Fig.1 The detection results of monoclonal antibody by Western blot
2.6 Dot-ELISA检测
将σNS蛋白、ARV S1733、ARV R1和ARV R 2以及对照的病毒液各10μL分别点在NC膜上进行Dot-ELISA试验,以阳性鼠血清作为阳性对照,SP2/0骨髓瘤细胞培养上清作为阴性对照。2株MAb SF6-3K3和SB2-1K3只与未经变性处理的ARV毒株发生特异性反应,出现棕色的反应斑,与NDV、AIV、IBV、ILTV、IBDV 等对照株均无交叉反应,骨髓瘤细胞培养上清也没有出现反应斑,证明1株单克隆抗体有良好的特异性(图2和表2)。
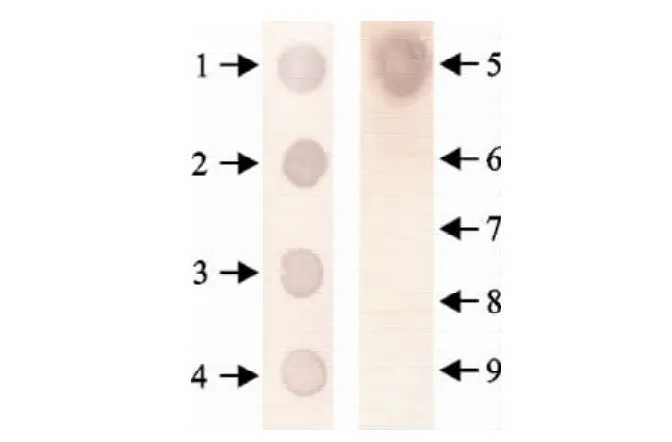
图2 Dot-ELISA检测单克隆SB2-1的特异性结果Fig.2 The specific test results of monoclonal antibody SB2-1by dot-ELISA

表2 单克隆抗体SB2-1K3的Dot-ELISA特异性鉴定结果Table 2 Specificity identification of monoclonal antibody SB2-1K3by Dot-ELISA
2.7 直接免疫荧光(DFA)法检测
将ARV S1733感染鸡胚成纤维细胞后,用丙酮和乙醇进行固定,然后用FITC标记的单克隆抗体进行染色,洗涤后在荧光显微镜下,结果ARV S1733感染的鸡胚成纤维细胞出现荧光,而用SP2/0骨髓瘤培养上清以及没有感染的细胞没有出现荧光(图3)。

图3 直接免疫荧光法检测 MAbs SB2-1与感染禽呼肠病毒S1733的反应结果Fig.3 Direct immunofluorescence detection of fibro cells infected with Reo S1733strain by MAbs SB2-1
2.8 病毒中和试验
将单克隆抗体倍比稀释后与相同体积的200 EID50/0.2mL的ARV S1733毒株充分混匀感染鸡胚成纤维细,结果所有稀释的单抗组与病毒对照一样均出现细胞病变,而阴性对照则没有细胞病变;用直接免疫荧光(FA)方法进行染色检测,在荧光显微镜下,试验组与阳性病毒组一样出现荧光,阴性对照没有荧光出现。
3 讨论
在畜禽传染病方面,已有很多单克隆抗体的制备和鉴定[12-13]。正是由于单克隆抗体具有特异性高、敏感性强的特点,已被广泛应用于各类传染病病原的血清学检测和诊断中。本研究是根据禽呼肠病毒在检测方面的需要,有针对性地进行单克隆抗体的制备和特性鉴定,从而为进一步建立快速诊断技术奠定基础。
进行单克隆抗体的制备,病毒的纯化非常关键,各种病毒的纯化根据需要有各自不同的方法,本研究所用的病毒是鸡胚增殖的病毒,其病毒含量不够纯,在病毒纯化是首先采用低速离心,去掉一部分的杂物,然后采用病毒浓缩仪和过滤器进行浓缩,将大部分的水分去掉,再通过蔗糖密度梯度离心,获得的纯化病毒,其纯度较高,在用于免疫和包被抗原时,可以尽可能排除非特异反应。另外,通过这样纯化而获得的病毒,其病毒结构的构象没有发生变化,排除了因直接超速离心浓缩而带来的病毒结构构象的改变,从而在免疫时因构象改变而产生的其它分泌抗体的产生。
本试验采用FITC直接标记的单克隆抗体进行染色,在细胞培养时,适当降低培养液中血清的浓度,在接毒时延长病毒与细胞的吸附时间和洗涤时间,这样尽可能地排除了假阳性结果的出现,提高了鉴定效率。
本试验中,应用Dot-ELISA方法对制备的单克隆抗体与对照的 NDV、AIV、IBV、ILTV、IBDV 进行特异性检测,均无交叉反应,证明制备的单克隆抗体有良好的特异性。可以应用本试验制备的单克隆抗体,建立用于特异性检测禽呼肠病毒的试剂盒,为鉴别诊断禽呼肠病毒奠定了基础。
本试验通过病毒中和试验,证明本研究制备的单克隆抗体不具有中和禽呼肠病毒的能力,由此可以推断其识别的线性表位不是中和表位,只能识别禽呼肠病毒抗原的表位。本试验得到的mAb虽然不具有中和病毒的活性,但具有特异识别禽呼肠病毒的功能,因此,在建立准确诊断由禽呼肠病毒引起的疫病方面将会发挥重要的作用。
[1] 卡尔尼克B W.禽病学[M].10版.高 福,等,译.北京:中国农业大学出版社,1999:902-908.
[2] 谢芝勋,秦 宇,谢丽基,等.应用禽呼肠病毒σ3融合为抗原的ELISA 检测方法的建立[J].畜牧与兽医,2007,39(11):3-7.
[3] Benavente J,Martinez-Costas J.Avian reovirus:Structure and biology[J].Virus Res,2007,123(2):105-119.
[4] Yin H S,Lee L H.Identification and characterization of RNA-binding activities of avian reovirus non-structural protein sigmaNS[J].J Gene Virol,1998,79:1411-1413.
[5] 秦春香,谢芝勋,谢丽基,等.利用σ3和σ2重组蛋白检测禽呼肠病毒抗体ELISA 的建立[J].西南农业学报,2009,22(2):492-496.
[6] 廖 敏,谢芝勋,谢志勤,等.一步法RT-PCR检测禽呼肠病毒的研究[J].中国预防兽医学报,2003,25(1):53-55.
[7] 童桂香,谢芝勋,黄 琦,等.禽呼肠孤病毒实时荧光定量RTPCR检测方法的建立[J].中国兽医科学,2007,37(9):767-771.
[8] 罗 婵,王志强,公方强,等.SYBR Green实时荧光定量PCR检测水牛体细胞组蛋白乙酰化相关基因mRNA表达[J].中国兽医学报,2009,29(2):233-237.
[9] 熊文婕,谢芝勋,唐 熠,等.SYBR GreenⅠ实时荧光定量RT-PCR检测禽呼肠孤病毒δC和δNS基因方法的建立[J].广西农业科学,2010,41(4):366-370.
[10] Jari L,Pauliina N,Janita L,et al.Characterization of monoclonal antibodies against prostate specific antigen produced by genetic immunization[J].J Immunol Meth,2004,289(1):157-167.
[11] 廖 敏,谢芝勋,刘加波,等.鸡呼肠孤病毒分离与鉴定[J].中国家禽,2002,24(1):12-14.
[12] 杜秋明,鲁 承,高建伟,等.鹅细小病毒单克隆抗体的制备与鉴定[J].中国畜牧兽医,2011,38(2):162-164.
[13] 李晓军,张婷婷,孟凡依,等.抗Ⅰ型鸭肝炎病毒单克隆抗体的制备及其生物学特性鉴定[J].中国预防兽医学报,2011,33(6):487-489.
