菲律宾海西部海区有机悬浮颗粒观测及其分布特征*
2013-09-20方习生魏建伟石学法程振波
方习生,魏建伟,石学法,程振波
(1.国家海洋局 第一海洋研究所,山东 青岛266061;2.海洋沉积与环境地质国家海洋局重点实验室,山东 青岛266061)
海洋环境中的颗粒有机碳(POC)是生态系统中物质循环和能量流动研究的重要内容,也是评价海区初级生产力的一个重要指标。认识颗粒有机碳及颗粒物的时空分布和变化机制,对于海洋化学、海洋生物学以及海洋地质学研究都非常重要[1-2]。自20世纪50年代开始,国外许多学者就利用光学手段对海洋悬浮颗粒物质的分布特征作了研究和分析[3-8]。实践表明,透光度仪对悬浮颗粒分布极其敏感,能快速提供高分辨率的水体悬浮物质垂向分布信息,利用现场同步测得的光衰减系数及荧光数据,就可以分析有机颗粒、叶绿素a浓度以及浮游植物的分布特征[4],这在海洋悬浮物监测研究方面和对于理解海洋生物地球化学循环过程具有重要意义。赤道西太平洋具有独特的物理、化学和生物学特征,在厄尔尼诺—南方涛动(ENSO)事件中起着重要作用[9]。根据在菲律宾海西部海区现场测定的多参数综合垂向分布数据和海水取样分析,对菲律宾海水体光衰减作用、悬浮颗粒及颗粒有机碳的相关关系和空间分布变化特征进行了分析讨论。
1 材料与方法
2004年国家海洋局第一海洋研究所利用“向阳红9”科学考察船在菲律宾海进行了现场多参数综合垂直分布观测调查,观测海区如图1所示。SN断面包括2部分:东西方向的SN-1和南北向的SN-2,共有18个测站,观测时间是在2004-07(第一航段,WEaPac-1)。WE断面呈东西向分布,共包括12个测站,观测时间为2004-09-10(第二航段,WEaPac-2)。
“向阳红09”号科学考察船安装了美国SeaBird公司制造的SBE 911+型CTD,该型CTD除了配有常规的温度、盐度、压力探头外,同时还联结了浊度、p H、荧光以及透光度仪等探测系统。水体光衰减系数由配置在CTD上的Wet Labs透光度仪测得,光源的中心波长为660 nm,光程为25 cm。真光层水深Ze(1%PAR)根据现场水下光谱推导;混合层水深Zm是根据0.125σθ标准计算出的最大混合水深。颗粒有机碳分析的海水是由SBE 911+型CTD上的Niskin标准采水瓶取得,所用体积一般在5升左右,分析用滤膜选用Whatman GF/F(25 mm,0.7μm)滤膜,滤膜以及包裹滤膜所需的铝箔纸事先都在450℃条件下高温燃烧3 h。在3.04×104~5.07×104Pa压力条件下,将新鲜海水样品中的悬浮颗粒直接过滤到滤膜上。随后用蒸馏水冲洗滤膜多次,以除去多余盐分。用铝箔将载有悬浮物的滤膜包裹好,并置于-40℃深冷冰箱中保存。按照如下步骤除去滤膜上的无机颗粒碳组分:首先将盛有浓盐酸的广口容器置于干燥塔的底部,然后用玻璃培养皿(培养皿经过酸洗和450℃干燥2 h处理)装盛着滤膜一并置于干燥塔中,用盐酸烟熏约1 h;取出培养皿和滤膜,于60℃环境中干燥24 h,待测。采用双膜校正方法制备空白样品。空白膜样品同样用盐酸烟熏1 h,并于60℃环境中干燥。所有样品都在PE240型元素分析仪上进行POC含量测试。海水叶绿素a浓度连续垂向分布是由联接在SBE911+型CTD上的SeaPoint荧光计测定,为了对现场叶绿素a浓度进行校正,在实验室内用过滤萃取荧光法测定了40多个海水样品的叶绿素a浓度,再由现场叶绿素a测量数据与室内分析数据回归分析,结果显示现场测量数据与室内分析数据相关性非常高。所用的叶绿素a浓度数据为未作校正的数据。
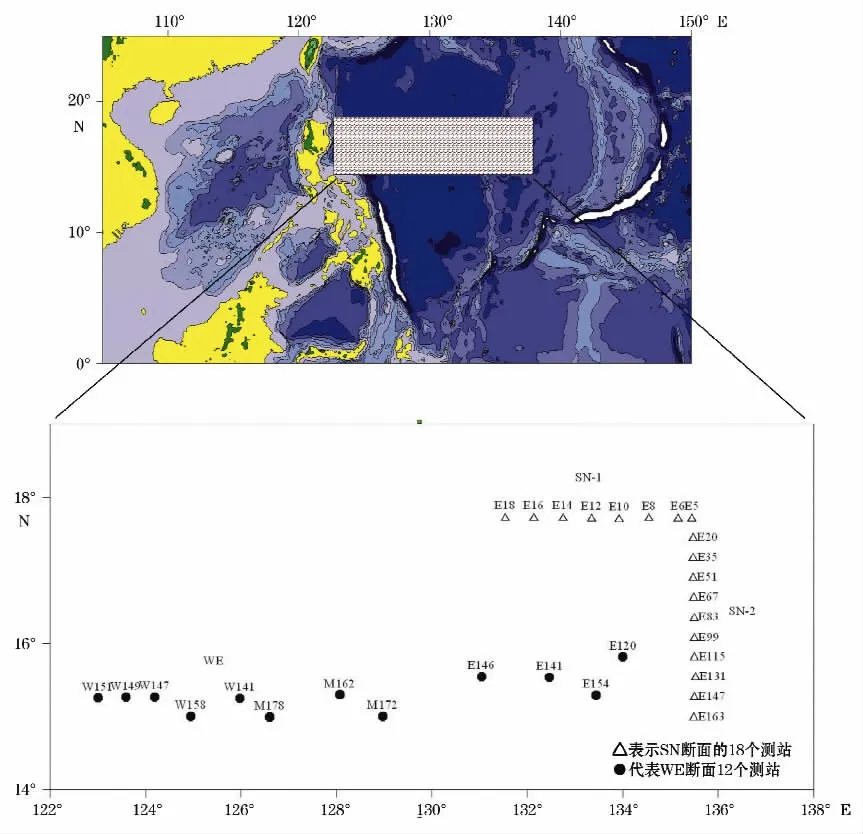
图1 菲律宾海调查断面SN和WE位置示意图Fig.1 Locations of surveying sections SN and WE in the Philippine Sea
2 结果与讨论
2.1 颗粒光衰减系数cp及其典型垂直分布
光衰减系数(c)是由3部分引起的:纯海水的衰减(cw),黄色物质的衰减(cCDOM)以及悬浮颗粒的衰减(cp)[4]。在光谱的红光波段,黄色物质的光衰减作用近似为零[4,10],可以忽略。而纯海水的光衰减系数大小约为0.364 m-1[10]。开阔大洋中,大颗粒集合体非常少,每升海水中也就有几个颗粒。而透光度仪的光程为25 cm,光束照射体积非常小(大约为44 m L),其探测到大颗粒悬浮体的几率非常低。根据研究,颗粒光衰减信号cp主要来源于那些直径小于20μm的粒子[4]。由魏建伟等[11]推导的悬浮颗粒光衰减系数可以简单地表示:

再根据悬浮体干重数据对光衰减系数作进一步的系统校正,通过推导光衰减系数cp垂直分布,可以对海水细颗粒组分的分布变化作连续的观测和分析。
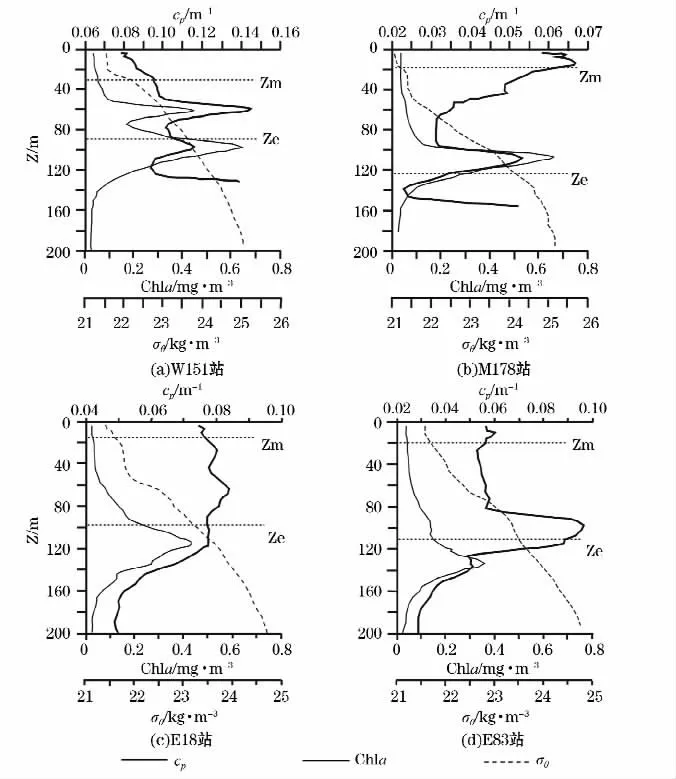
图2 菲律宾海上层水柱典型综合垂向分布特征Fig.2 Typical profiles of the upper water column in the Philippine Sea
图2给出了菲律宾海的4个站位典型综合垂直分布,包括颗粒光衰减系数cp、叶绿素a、密度等参数,其垂向分辨率都为1 m。1)W151站(123°00′00″E,15°15′36″N)距离菲律宾群岛最近,观测时间为北京时间12∶00,其叶绿素垂向分布同时具有次表层最大层(SCM)和深层叶绿素最大层(DCM)。DCM层内的叶绿素质量浓度约为0.6 mg/m3。在上层120 m水柱中,光衰减系数cp同荧光保持同步变化。2)M178站(172°E,15°N)距离菲律宾群岛以东大约600 km,观测时间为北京时间13∶00。叶绿素垂直分布具有深层最大层,其质量浓度约为0.65 mg/m3,且在60~140 m水柱内光衰减系数同叶绿素a也是同步变化。在W151和M178水柱下层水体中,即120 m(W151站)和140 m(M178站)以深,这2个站位的光衰减系数cp随着水深急剧增大,估计这可能与悬浮物质的水平扩散作用有关。3)E18站(131°31′48″E,17°43′48″N)和E83站(135°30′00″E,16°22′12″N)分别位于调查海区的东北部和最东端,属于典型的大洋环境,其观测时间分别为北京时间13∶00和14∶00。其真光层水深远远大于混合层水深:E18站真光层水深95 m,混合层深度18 m;E83站真光层厚度110 m,混合水深19 m。在真光层以深的水柱中,叶绿素a垂直分布具有典型的深层叶绿素最大层。E83站光衰减系数cp在真光层底部具有异常大的峰值带。而E18站上部120 m水柱范围内的光衰减系数变化相对较小。水柱下部(E18站的120 m水深以下,E83站的140 m水深以下)的光衰减系数cp和荧光随水深逐渐减小,这比较符合“混合规则”[12],即随着水深的增加,同一种颗粒组分的浓度会渐渐的被稀释。
2.2 颗粒有机碳估算与误差分析
在开阔大洋上层水柱中,颗粒有机质(POM)主要是由活体浮游植物及碎屑颗粒组成的,浮游动物、细菌及其降解产物仅占很小的比重。真光层内的POM主要来自于浮游植物[13],因此悬浮有机质在很大程度上能够反映浮游植物现存量。根据我们的实测结果,菲律宾海上层水体的颗粒有机碳(POC)浓度约10~100 mg/m3。其中,WEqPac-1航段(SN断面,7月)测得的POC浓度平均值为68 mg/m3,碳氮质量比C∶N约为21。WEqPac-2航段(WE断面,9-10月)的POC浓度相对较低,平均约为38 mg/m3,碳氮质量比C∶N约为8.7。根据分析知,菲律宾海与南海的POC浓度比较接近[14],高于赤道太平洋[15],比罗斯海[16]、阿拉伯海[17]以及黑潮表层水的颗粒有机碳[18]都要低,远远低于高生产力的秘鲁上升流区和西北非上升流区。
WEqPac-1航段获得的POC浓度与颗粒物质(PM)浓度具有显著的相关性(图3),回归方程为PM=20.95×POC+111.62,相关系数R2=0.483。WEqPac-2航段中POC与PM的相关性不明显(未给出散点图)。尽管如此,2个航段测得的POC与PM的比例却基本一致,大约为4%。
由于POC/PM的比率基本恒定的,因而POC可作为有机悬浮颗粒的替代指标。根据悬浮体浓度与cp的相关性分析,理论上POC同cp也应该具有一定的线性关系。为了验证,采用Model II线性回归分析方法对菲律宾海POC和cp的相关性作了分析。菲律宾海第一航段(WEqPac-1)上层水柱(200 m)POC同cp之间线性相关系数为R2=0.715,回归方程为POC=1243×cp-11.7;第二航段(WEqPac-2)POC同cp之间线性相关系数为R2=0.77,回归方程为POC=1415×cp-49。而如果对2个航段内所有POC实测结果同光衰减系数cp作相关分析,发现二者仍呈线性相关关系,回归方程为POC=876×cp-2.23,只是显著性有所降低,R2为0.33(表1)。根据这些线性拟合方程,就可以将cp垂向分布换算为POC垂向分布。
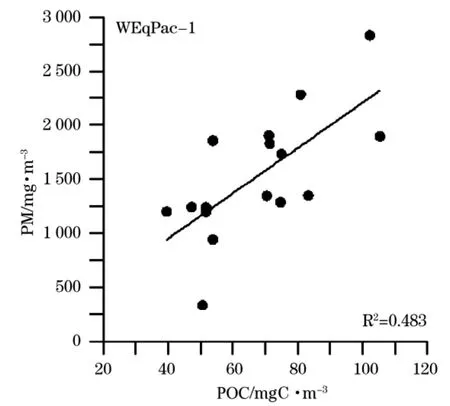
图3 WEqPac-1航段(SZ断面)PM与POC的相关散点图Fig.3 Correlation between PM and POC,based on the observations during WEqPac-1 cruise(section SZ)
通过现场数据的分析,国外同行在北大西洋[5]、阿拉伯海[7]、赤道太平洋[15]以及东北太平洋[17]等海区也观测到了cp与POC之间的线性关系,但是彼此的结果存在一定的差异,特别是回归方程的斜率有明显不同(表1)。菲律宾海cp∶POC回归方程斜率要比其他海区的斜率大2~4倍,这很可能是由浮游植物组成及生理特性所造成的。根据Bishop[10]在赤道太平洋的悬浮颗粒粒级分析,大约41%~89%的光衰减信号是由<8μm的颗粒产生的,同时大粒径的颗粒组分也会对光衰减作用产生一定影响。他认为要获得光衰减系数cp同POC之间的最佳拟合关系,必须要充分考虑到粗粒级组分的影响。从理论上讲,透光度仪的实际测量体积越大,其测得的光衰减信号就越精确。但出于现场操作方便的考虑,目前一般都采用光程等于25 cm的透光度仪[15-17],个别的采用1 m光程的设备[10]。测量设备规格的不一致,加上随后的数据推导过程的差异,都会造成现场光衰减测量数据的离散。
菲律宾海两个cp∶POC回归方程的斜率相差不是很大,分别为1243和1415。我们没有将2个航段的数据重新组合并建立新的cp∶POC回归方程,因为这在统计学分析过程中是不可取的:2个航段的数据量有明显差别,统计分析过程中必须要寻找一个权重因子来加以校正。我们分别利用2个POC/cp回归方程对相应航段中的POC分布变化作进一步的分析。
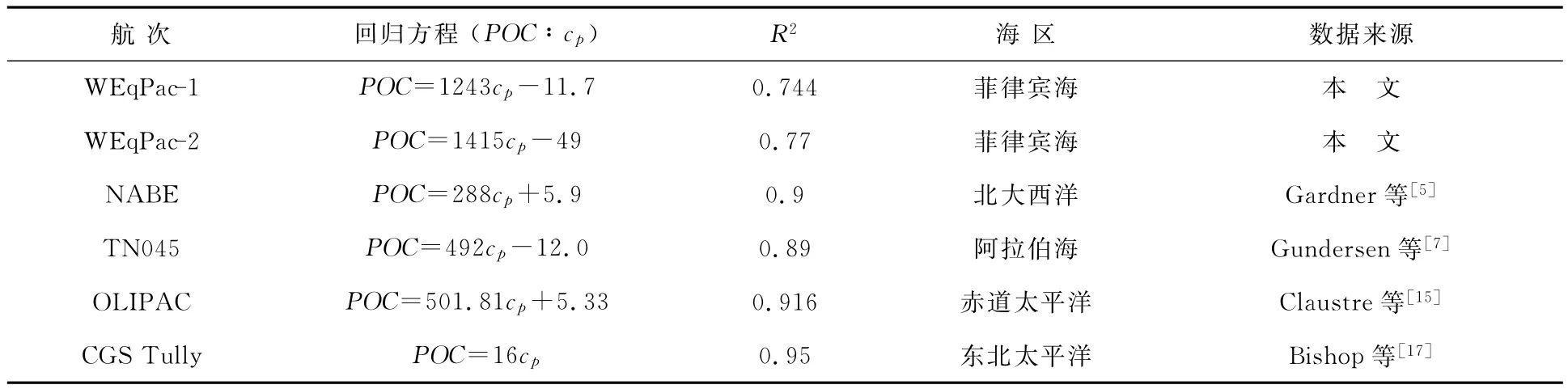
表1 光衰减系数cp与POC的线性回归分析Table 1 Regression analysis of light attenuation coefficient cp vs POC
分析了解所有可能引起POC测量值差异的原因非常必要。Altabet等[19]分别利用瓶式和现场泵式方法分析了颗粒氮(PN)的浓度及同位素组成,认为污染问题以及滤膜类型差异是造成测量值不同的主要原因。Moran等[20]则对JGOFS赤道太平洋(EqPac航次)和北冰洋断面(AOS94)的历史资料作了分析,认为溶解有机碳(DOC)吸附是测量值偏大的诱因。对于瓶式方法而言,如果过滤水样太少必然会受到DOC的影响。所以要尽量对POC样品作空白校正,以减少DOC可能造成的影响。目前有2种方法可以进行DOC吸收校正。第一种是过滤不同体积的海水,然后计算POC同其过滤海水体积的回归方程,该方程在y轴上的截距就是DOC的吸收量。通过对马尾藻海近岸、表层水、深层水的大范围取样(4 L海水)分析,Menzel[21]得出了每个空白滤膜的碳吸附量为1.7~2.1μmol(相当于0.020 4~0.025 2 mg)的结论。他认为空白滤膜很容易就能达到DOC饱和,因而达到饱和状态的滤膜的DOC吸附量是一个常数,与环境DOC浓度的高低无关。Moran等[20]也发现25 mm GF/玻璃纤维滤膜空白吸附值约为2±0.3μmolC。这些数据说明,滤膜的DOC吸附值可能是一个相对恒定的值,小于3μmol。第二种校正DOC吸附作用的方法是双膜校正[28-29],这种方法操作起来相对简单。在2004年的菲律宾海航次中(WEqPac)使用的就是这种双膜校正方法。根据我们的实测分析,菲律宾海25 mm GF/F空白膜DOC吸收值大小在0.024 5 mg(相当于2.04 μmolC),这与Moran等[20]和Menzel[21]的研究结果基本一致(如果考虑到双层空白样品膜上可能会截留少量颗粒的情况,双层空白样品值很可能就是DOC吸附校正的最大上限)。
滤膜的类型会对颗粒滞留量产生影响[19]。比如Niskin瓶式手段(小体积),采用的玻璃纤维滤膜(GF/F滤膜)的截留效率相当于0.7μm,而现场泵式手段(大体积)采用的玻璃纤维滤膜的截留效率一般为1.0μm或2.2μm,细孔径的滤膜当然就能保留相对更多的颗粒。而泵式方法采用的压力条件非常高,操作过程中会有少量细颗粒(大于滤膜孔径,如0.7μm)穿过滤膜而流失,这样容易导致POC测量值偏低[24]。Altabet等[19]所使用的现场泵式设备的压力范围是7.6×104~1.06×105Pa(LVFS)和8.11×104~8.61×104Pa(MULVFS),而Niskin瓶式方法采用的压力一般为2.03×104~5.07×104Pa[16],较小的压力差应该能更好的避免细颗粒组分的流失。Liu等[25]曾对同种类型的滤膜做了对比分析,发现压力差异不会对其测量结果造成明显影响。这个实验结果在理论上有些出乎意料,但考虑到一定的实验条件后还是可以理解的。比如说,在过滤海水体积足够多的情况下,颗粒流失产生的误差就不会非常明显。
海水取样过程中不可避免地要受到浮游动物的影响。对于泵式方法而言,其捕获小型浮游动物的几率相对要低得多[26]。瓶式取样就很容易捕获到小型浮游动物,这可能是造成瓶式结果比泵式测量结果偏高的主要原因。还有一些其他的客观因素,像污染、颗粒聚集与破碎等。目前,绝大多数实验室里所使用的还是普通的瓶式过滤设备,因此其分析数据都有可能存在小型浮游动物“污染”的问题。Gardner等[24]曾用海水高温燃烧方法分析了POC浓度,结果表明海水高温燃烧方法结果与瓶式分析结果比较接近。所以我们采用的方法:瓶式,3.04×104~5.07×104Pa,0.7μm玻璃纤维膜、5 L海水,结果还是比较可信的。
2.3 断面SN、WE上的叶绿素a、光衰减系数及颗粒有机碳分布特征
综上所述,现场光衰减系数由悬浮颗粒干重标定后再减去纯海水的光衰减系数就得到颗粒光衰减系数cp。如图4所示,图框边缘的“↑”代表测量站对应的位置,其下的一行数字表示取样时间(北京时间,24小时制);白色实线表示混合层水深(Δ0.03σθ和Δ0.125σθ)。断面SN上层水体(100 m)悬浮粒子光衰减作用相对较强,下层较弱,在大约200 m水深存在着颗粒衰减系数的极小值。其中,SN-1水柱上部(100 m)的衰减作用相差不大,而自150 m向下急剧减小。SN-2则具有与其不同的特点:100 m以浅水体的衰减作用相对稳定,到100 m深时cp骤然增大至0.1 m-1,然后又迅速减小,直到200 m左右水深时达到极小值。根据目前掌握的资料,世界大洋其他海区也具有类似的光衰减系数分布[6,15],存在光衰减深层最大层的原因很可能与跃层处营养盐充足而导致浮游植物富集等因素有关。
根据WEqPac-1航段中POC/cp的线性回归方程(POC=1 243×cp-11.7),可以得到断面SN的连续POC剖面。POC剖面分辨率可以达到CTD一般资料的水平(1 m甚至更高),这比通过大量的海水样品去分析POC要优越的多。总体上看,POC和cp断面的分布模式基本一致。在水体100~120 m范围内存在POC最大层,高于100 mgC/m3。150 m以浅水体POC浓度相对较高,200 m水深的POC含量最低。对真光层(~100 m)水柱而言,断面西侧(SN-1)区域的颗粒有机碳含量高于东侧(SN-2)。
断面SN上的叶绿素浓度非常低,具有明显的3层垂直分布结构。表层和次表层的叶绿素a浓度小于0.1 mg/m3。在水深100~150 m存在着一个深层叶绿素最大层(DCM),浓度为0.14~0.36 mg/m3。自150 m往下,叶绿素a浓度骤然降低,一般小于0.02 mg/m3。在断面SN上,叶绿素浓度深层最大层(DCM)呈现出一种特殊的韵律变化。DCM水深大小相间,其变化轨迹同混合层水深的变化趋势基本相同,估计可能与浮游植物的光适应性有关。此外,叶绿素a的垂向分布同POC的分布非常相似。
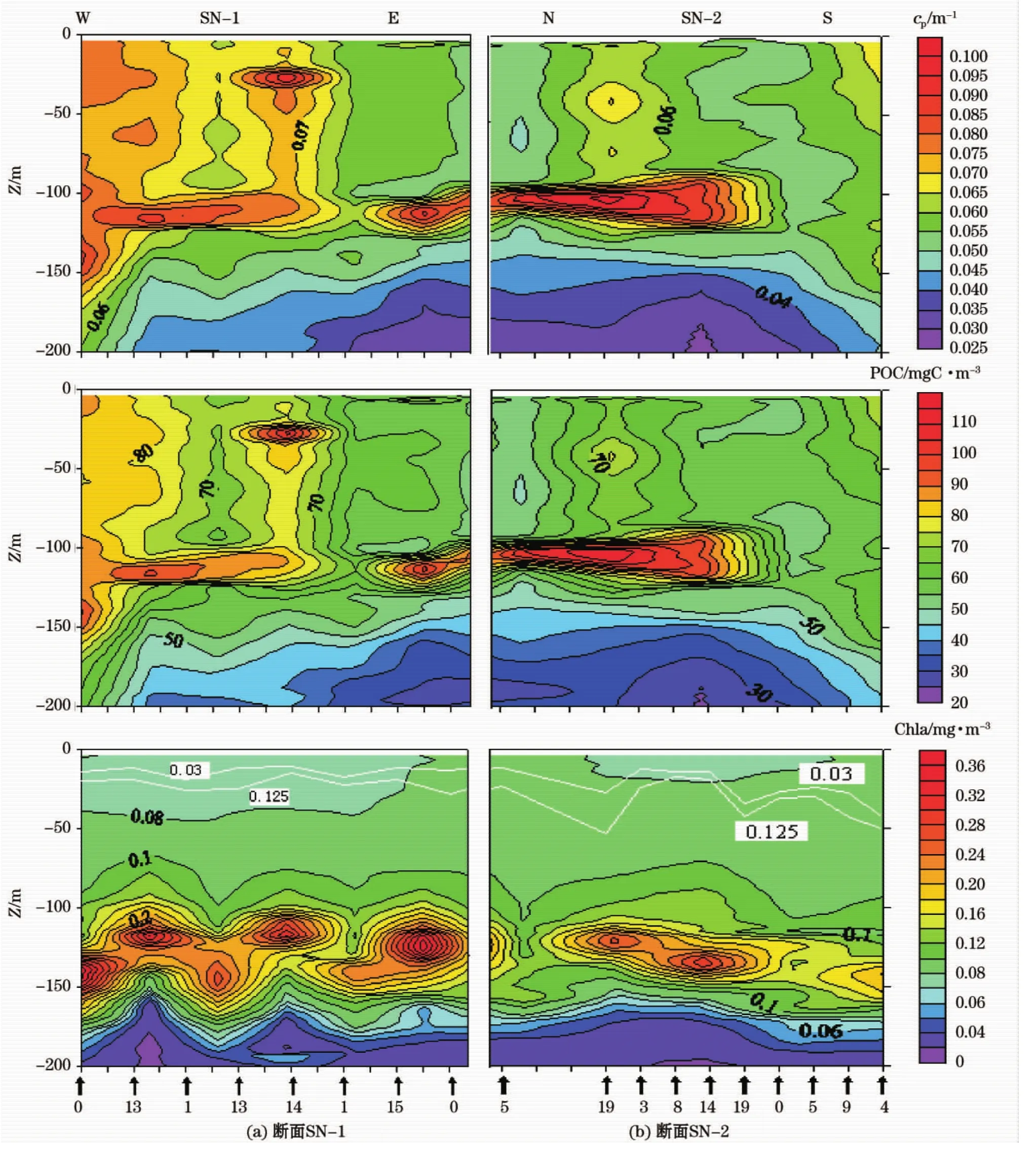
图4 断面SN光衰减系数、颗粒有机碳和叶绿素a分布Fig.4 Distributions of light attenuation coefficient cp,POC and chlorophyll a along section SN
图5 对断面WE上的叶绿素a、光衰减系数及颗粒有机碳分布格局作了总结。图框边缘标出了断面WE起始经度;位于下图框边缘的“↑”指示测量站点对应的位置;现场测量时间为北京时间11∶30-13∶30。叶绿素a含量较低,最大不到0.6 mg/m3,其垂向分布呈现出明显的“低—高—低”分布格局:即上层水体浓度低(<0.1 mg/m3),向下又升高(0.15~0.6 mg/m3),在水柱下部再次降至最低水平(<0.03 mg/m3)。断面西端靠近菲律宾群岛,浮游植物含量相对较多,垂向分布(如W151站)具有叶绿素次表层最大层(60 m)和深层最大层(100 m)。沿断面向东,浮游植物含量逐渐降低;在断面的最东端,叶绿素浓度最低。在M178,M162,M172,E141和E154处海水有轻微上涌,这会从水柱深层带入较丰富的营养盐,从而造成浮游植物富集于真光层底部的现象。
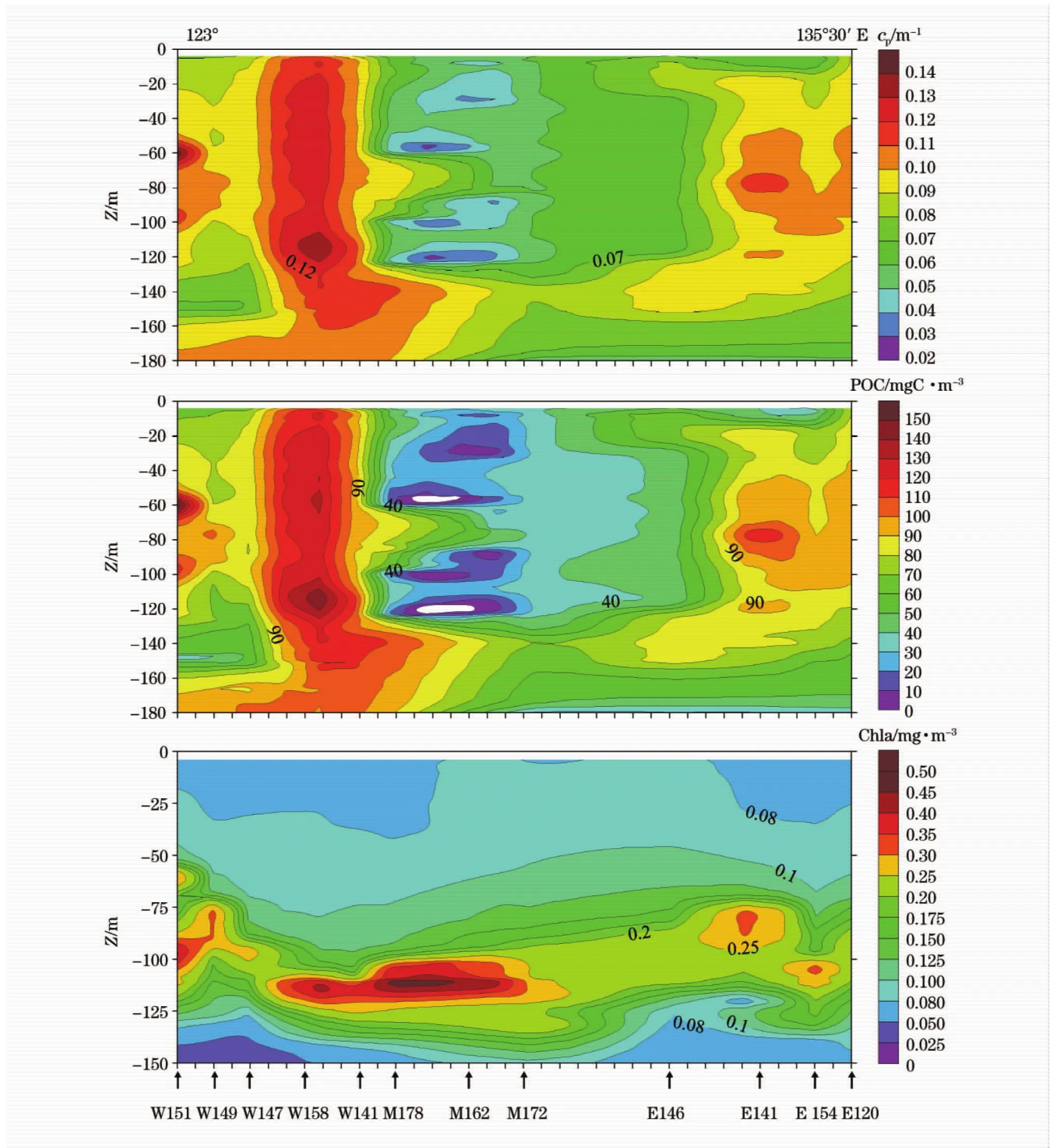
图5 断面WE光衰减系数、颗粒有机碳和叶绿素a分布Fig.5 Distributions of light attenuation coefficient cp,POC and chlorophyll a along section WE
在WE断面上,光衰减极小值一般位于水柱表层,为0.05~0.08 m-1。自极小值水深往下,光衰减系数往往随着水深而不断增大(图5)。这一点同已有的公开资料差别较大[6,7,15]:一般来说,开阔大洋中150 m以深的水体中光衰减作用已经非常小。水柱深部水体光衰减系数异常增大可能是如下2方面因素:一是光活性因子增多,例如物质的水平输运作用;二是透光度仪的信号发生了衰退。通过对WEqPac航次大量光衰减系数垂直分布的分析,发现仅仅靠近菲律宾群岛的光衰减系数垂直分布具有类似现象,而透光度仪在工作过程中并没有表现出任何异常。根据经验,我们认为水柱下部光衰减信号的异常增大应该就是物质水平搬运所致。180 m以浅水层内的颗粒光衰减系数cp基本上都小于0.14 m-1。在靠近陆地一端,水体光衰减作用偏大,尤其是在W158站位附近。
颗粒有机碳的空间分布同光衰减系数分布趋势基本一致。总体上WE断面呈现出明显的不连续特征。根据cp、POC及叶绿素a的相互关系,我们可以将断面WE粗略地分为3大部分:1)西区,具有次表层和深层叶绿素a最大层(75~100 m),且cp和POC在55~100 m具有明显的极大值,POC含量居中;2)中区,具有叶绿素a深层水最大层(DCM),叶绿素a的浓度达到了最高值,POC也达到了本航次的相对最高值;3)东区,具有叶绿素a深层水最大层(DCM),但其绝对浓度是该断面最低的。
2.4 POC/Chl a断面分布
我们由光衰减推导得到的POC数据是指海水颗粒有机碳,其中包含所有的大于0.7μm的有机物质,如异养菌,微型(nano-)、小型(micro-)和部分微微型(pico-)浮游动植物及碎屑物质,还可能会有一些中型浮游动物[27],其中浮游植物是POC的重要来源。另一方面,POC垂直分布是由光衰减系数的垂直分布推导而来,中心波长为660 nm的光衰减和散射作用主要是由0.5~20μm的粒子控制[6,28-30],而这一粒级范围在低纬度海区对叶绿素含量贡献最大,因此我们完全可以对POC和Chla做对比分析。
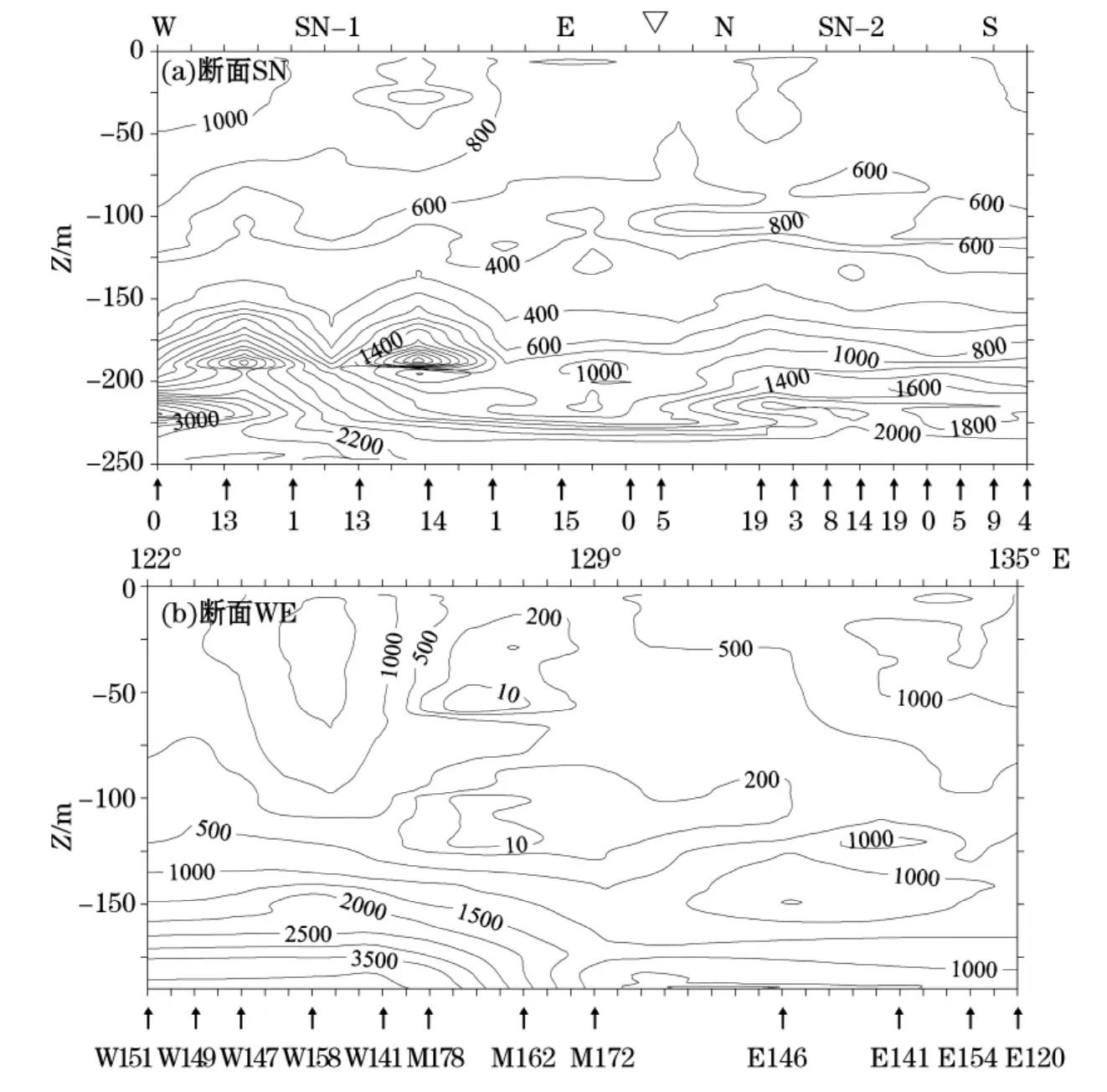
图6 断面SN和断面WE上POC∶Chla的比值Fig.6 The ratios of POC∶Chla along sections SN and WE
颗粒有机碳与叶绿素a的比值POC/Chla实际上是碳或Chla的函数。SN断面上的POC/Chla之比介于400~2 000,WE断面上POC/Chla之比在200~3 500(图6)。图6(a)中位于下图框边缘的“↑”代表测量位置,数字表示测量时刻(24 h制);图6(b)“↑”代表测量位置,数字表示站号。对于断面SN,最低的POC/Chla一般出现于叶绿素最大层或者最大层偏下方。而在表层和次表层水体中,由于碳的单位质量浓度升高,造成这里的POC/Chla偏高。断面WE上POC/Chla最低值处于50~125 m水深范围内,125 m以深处该比值超过1 000。菲律宾海的POC/Chla远远高于其他海区,如赤道太平洋的POC/Chla比值小于300[6]。
2.5 浮游植物现存量的分析
按照1 m的垂向分辨率,分别计算了两个断面上10,30,50,100和150 m水柱的累积浮游植物现存量(单位:mg/m2)。按照同样的方法,根据前面分析得到的回归方程POC=1243×cp-11.7和POC=1415×cp-49,计算得到断面SN和WE的累积颗粒有机碳现存量(单位:mgC/m2)。如图7和8所示,从水柱上部几十米的累积总量分布情况来看,IChl和IPOC都没有明显的变化。图中横轴下部的“↑”指出了测量的相对位置;混合层水深(MLD,0.03Δσθ标准)用虚线表示。图8是测量时间为北京时间11∶30-13∶30。但是100 m和150 m水柱的累积总量则有明显的波动,并且近岸区浮游植物现存量高,离岸区浮游植物存量低。
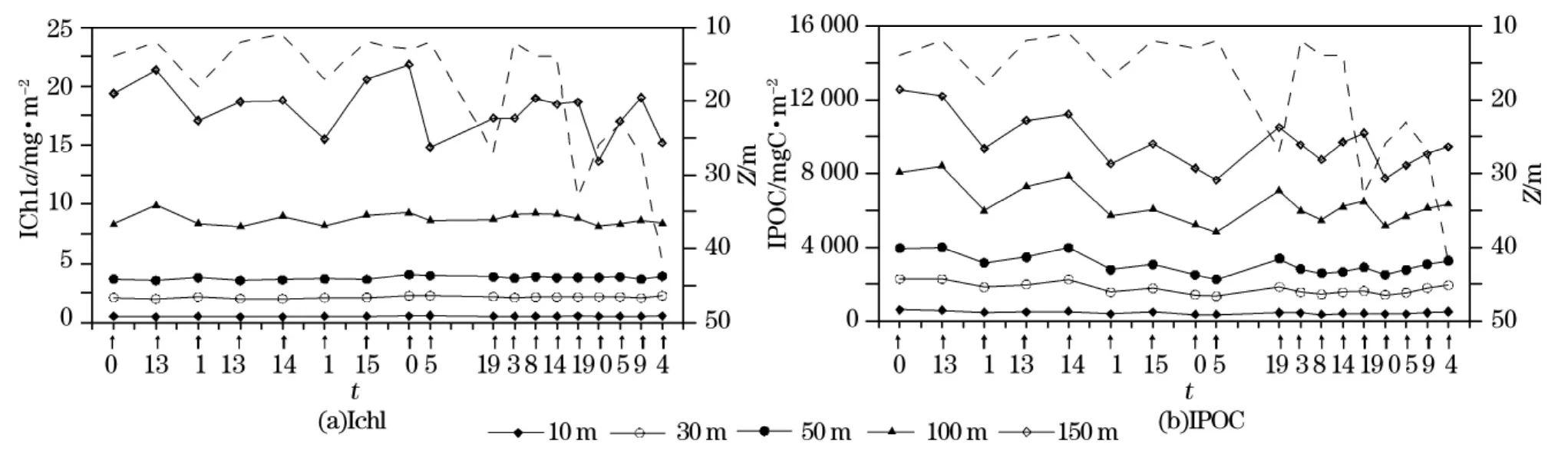
图7 断面SN上的累积浮游植物现存量IChl和累积颗粒有机碳IPOCFig.7 The accumulative standing crops of phytoplankton(IChla)and of POC(IPOC)along section SN
在2个断面上,颗粒有机碳现存量和浮游植物现存量基本上呈现出同步变化趋势。在断面SN上,100 m和150 m的IChla和IPOC随着混合水深的波动而变化:混合水深愈浅,累积总量愈大;混合层增厚时,累积总量相应降低。断面WE上也存在这种浮游植物现存量与混合水深的相关共变现象。根据“混合层泵”的作用原理[31],混合层的振荡变化是表层水垂向交换的主要动力。表层水中的小型浮游植物粒子沉速较慢,由于混合层的扰动及次生环流作用可使这些小颗粒在表层水中的滞留时间增长[32-34]。同时,混合层的扩张又使那些低浓度的深层水团与表层水混合,最终导致粒子浓度的稀释。
菲律宾海水柱累积叶绿素a和累积颗粒有机碳具有显著的线性相关关系。SN断面上的相关性最为显著,回归方程为IPOC=514.98×IChl+828.53,相关系数R2=0.92。WE断面上IPOC和IChl的回归方程为IPOC=660.17×IChl+556.20,相关系数R2=0.776。2个断面上的颗粒有机碳现存量同浮游植物现存量之比(IPOC∶IChl)分别为515和660。Gardner等[35]曾对全球海洋POC分布特征作了讨论,发现海洋表层(约30 m)叶绿素a及颗粒有机碳具有相似的分布变化。根据他们对西北太平洋海区的估算分析,IChla约占IPOC的0.2%,这同我们的分析结果基本一致。
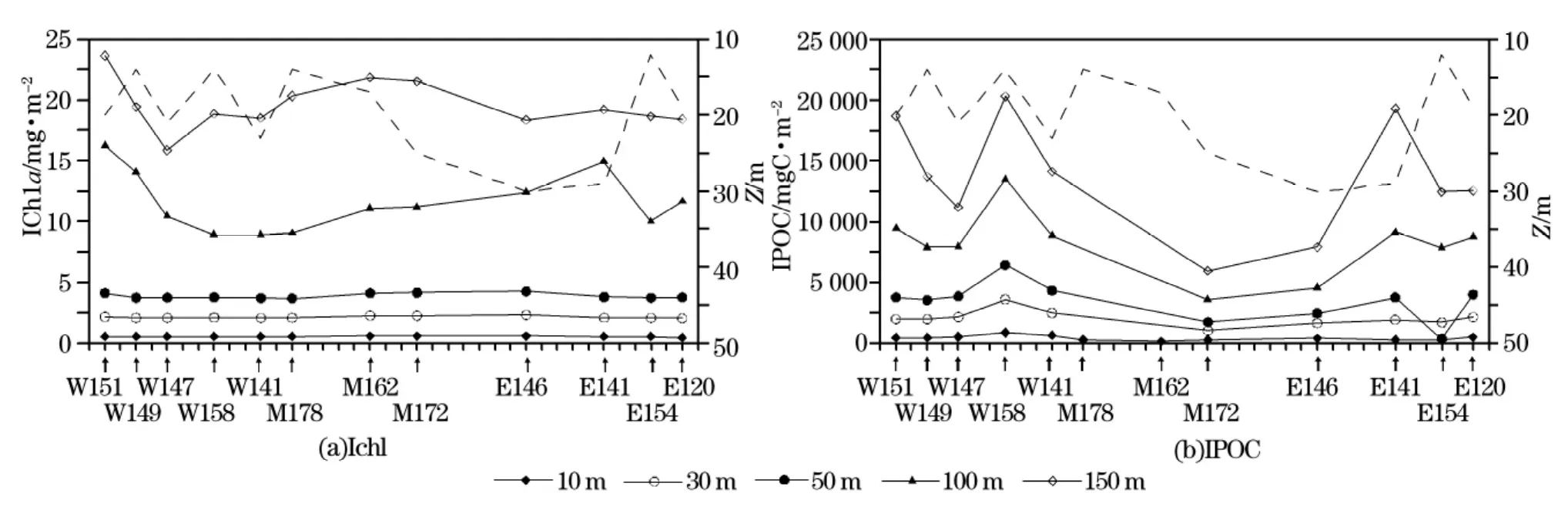
图8 断面WE上的累积浮游植物现存量IChl和累积颗粒有机碳IPOCFig.8 The accumulative standing crops of phytoplankton(IChla)and of POC(IPOC)along section WE
3 结 论
1)根据现场观测的透光度资料,获得该海区悬浮颗粒光衰减系数cp的连续垂直分布,其关系式为:cp=c-0.364。
2)根据分析WEqPac-1航段中的资料,POC同cp之间线性回归方程为POC=1243×cp-11.7,相关系数为R2=0.715;WEqPac-2航段中POC同cp之间线性回归方程为POC=1415×cp-49,相关系数R2=0.77。根据这2个回归方程,推导出了菲律宾海高分辨率的POC连续垂直分布。
3)对菲律宾海两个大断面SN和WE上的叶绿素a、光衰减系数及颗粒有机碳分布特征做了总结。SN断面上部水柱100 m内颗粒有机碳含量比较低,100~120 m范围内存在最大层(高于100 mgC/m3),自150 m往下迅速降低。WE断面明显地具有3个不同区域,每个分区内的POC分布特征差别较大;断面下部(>150 m)可能受到外源物质的水平搬运影响。
4)对2个断面的POC/Chla比值做了分析,断面累积浮游植物现存量IChl与颗粒有机碳现场量IPOC之间线性相关,这对于海洋初级生产力和碳循环研究具有重要实用价值。
:
[1] BISHOP J K B,EDMOND J M,KETTENS D R,et al.The chemistry,biology and vertical flux of particulate matter from the upper 400m of the Equatorial Atlantic Ocean[J].Deep-Sea Research,1977,24(6):511-548.
[2] BISHOP J K B,COLLIER R W,KETTENS D R,et al.The chemistry,biology,and vertical flux of particulate matter from the upper 1500m of the Panama Basin[J].Deep-Sea Research Part I,1980,27a:615-640.
[3] JERLOV N G.Maxima in the vertical distribution of particles in the sea[J].Deep-Sea Research,1959,5(2-4):173-184.
[4] PAK H,KIEFER D A,KITCHEN J C.Meridional variations in the concentration of chlorophyll and microparticles in the North Pacific Ocean[J].Deep-Sea Research Part I,1988,35(7):1151-1171.
[5] GARDNER W D,WALSH L D,RICHARDSON M J.Biophysical forcing of particle production and distribution during a spring bloom in the North Atlantic[J].Deep-Sea Research Part II,1993,40(1-2):171-195.
[6] CHUNG S P.GARDNER W D,RICHARDSON M J,et al.Beam attenuation and microorganisms:spatial and temporal variations in small particles along 140°W during 1992 JGOFS-EqPac transects[J].Deep-Sea Research II,1996,43:1205-1226.
[7] GUNDERSEN J S,GARDNER W D,RICHARDSON M J.WALSH L D.Effects of monsoons on the seasonal and spatial distributions of POC and chlorophyll in the Arabian Sea[J].Deep-Sea Research II,1998,45(10-11):2103-2132.
[8] MISHONOV A V,GARDNER W D,RICHARDSON M J.Remote sensing and surface POC concentration in the South Atlantic[J].Deep-Sea Research II,2003,50:2997-3015.
[9] WEBSTER P J,LUCAS R.The tropical ocean/global atmosphere coupled ocean-atmosphere response experiment(COARE)[J].Bulletin of American Meteorology Society,1992,73:1377-1416.
[10] BISHOP J K B.Transmissometer measurement of POC[J].Deep-Sea Research I,1999,46(2):353-369.
[11] WEI J W,SHI X F,FANG X S,et al.Abundances of three pico-planktonic particles and their optical scattering in the Philippine Sea[J].Acta Oceanolgica Sinica,2008,30(1):105-112.魏建伟,石学法,方习生,等.菲律宾海三种微微型浮游生物颗粒丰度及其光散射作用[J].海洋学报,2008,30(1):105-112.
[12] LOISEL H,MOREL A.Light scattering and chlorophyll concentration in case I waters:a re-examination[J].Limnology and Oceanography,1998,43(5):847-858.
[13] MILLERO F J.Chemical Oceanography[M].CRC Press,New York,1996:469.
[14] CHEN M,HUANG Y P,CHEN F Z,et al.Particle dynamics in the euphotic zone,VI:The utility of tracer 234Th for studying particle dynamics in the upper water column of the northeastern south China Sea[J].Tropical Oceanology,1997,16(2):91-103.陈敏,黄奕普,陈飞舟等.真光层的颗粒动力学VI:南海东北部海域上层水体颗粒动力学的示踪研究[J].热带海洋,1997,16(2):91-103.
[15] CLAUSTRE H,MOREL A,BABIN M,et al.Variability in particle attenuation and chlorophyll fluorescence in the tropical Pacific:Scales,patterns,and biogeochemical implications[J].Journal of Geophysical Research,1999,104(C2):3401-3422.
[16] GARDNER W D,RICHARDSON M J,SMITH J W.Seasonal patterns of water column particulate organic carbon and fluxes in the Ross Sea Antarctica[J].Deep-Sea Research II,2000,47:3423-3449.
[17] BISHOP J K B,CALVERT S T,SOON M Y S.Spatial and temporal variability of POC in the northeast Subarctic Pacific[J].Deep-Sea Research II,1999,46(11):2699-2733.
[18] HUANG Z Q,FU T B,ZHANG Y H.Distributive characteristics of POC in sea water in East China Sea[J].Journal of Oceanography in Taiwan Strait,1997,16(2):145-152.黄自强,傅天保,张运辉.东海水体中POC的分布特征[J].台湾海峡,1997,16(2):145-152.
[19] ALTABER M A,BISHOP J K B,MCCARTHY M J.Differences in particulate nitrogen and isotopic composition for samples collected by bottles and large-volume pumps in Gulf Stream warm core rings and the Sargasso Sea[J].Deep-Sea Research,1992,39:5405-5417.
[20] MORAN S B,CHARETTE M A,PIKE S M,et al.Differences in sea water particulate organic carbon concentration in samples collected using small-and large volume methods:the importance of DOC absorption to the filter blank[J].Marine Chemistry,1999,67(1):33-42.
[21] MENZEL D W.Bubbling of sea water and the production of organic particles:a revaluation[J].Deep-Sea Research and Oceanographic Abstracts,1976,13(5):963-966.
[22] LORDER T C,HOOD D W.Distribution of organic carbon in a glacial estuary in Alaska[J].Limnology and Oceanography,1972,17(3):349-355.
[23] SMITH W O,NELSON D M,DITULLIO G R,et al.Temporal and spatial patterns in the Ross Sea:Phytoplankton biomass,elemental composition,productivity and growth rates[J].Journal of Geophysical Research,1996,101(c8):18455-18466.
[24] GARDNER W D,RICHARDSON M J,CARLSON C A,et al.Determining true particulate organic carbon:bottles,pumps and methodologies[J].Deep-Sea Research II,2003,50(3-4):655-674.
[25] LIU Z F,STEWART G,COCHRAN J K,et al.Why do POC concentrations measured using Niskin bottle collections sometimes differ from those using in-situ pumps[J].Deep-Sea Research I,2005,52(7):1324-1344.
[26] BISHOP J K B.The correction and suspended particulate matter calibration of Sea Tech transmissometer data[J].Deep-Sea Research Part I,1986,33(1):121-134.
[27] LEGENDRE L,MICHAUD J.Chlorophyll a to estimate the particulate organic carbon available as food to large zooplankton in the euphotic zone of oceans[J].Journal of Plankton Research,1999,21(11):2067-2083.
[28] STRAMSKI D,KIEFER D.Light scattering by microorganisms in the open ocean[J].Progress in Oceanography,1991,28:343-383.
[29] CHUNG S P,GARDNER W D,LANDRY M R,et al.Beam attenuation by microorganisms and detritus particles in the equatorial Pacific[J].Journal of Geophysical Research,1998,103(c6):12669-12681.
[30] BOSS E,TWARDOWSKI M S,HERRING S.Shape of the particulate beam attenuation spectrum and its inversion to obtain the shape of the particulate size distribution[J].Applied Optics,2001,40(27):4885-4893.
[31] GARDNER W D,CHUNG S P,RICHARDSON M J,et al.The oceanic mixed-layer pump[J].Deep-Sea Research II,1995,42(2-3):757-775.
[32] WOODS J D,ONKEN R.Diurnal variation and primary production in the ocean-preliminary results of a Lagrangian ensemble model[J].Journal of Plankton Research,1982,4(3):735-756.
[33] LANDE R,WOOD A M.Suspension times of particles in the upper ocean[J].Deep-Sea Research Part I,1987,34(1):61-72.
[34] WOLF K U,WOODS J D.Lagrangian simulation of primary production in the physical environment the deep chlorophyll maximum and nutricline[J].Toward a theory of biological-physical interactions in the world ocean,1988,239:51-70.
[35] GARDNER W D,MISHONOV A V,RICHARDSON M J.Global POC Concentrations from in-situ and satellite data[J].Deep-Sea Research II,2006,53(5-7):718-740.
