藤黄酸诱导非小细胞肺癌细胞凋亡的机制及其与转铁蛋白受体的关系
2013-09-20张洪明赵新国陈季北
张洪明,赵新国,陈季北
(江苏省盐城市第三人民医院呼吸科,江苏盐城,224000)
肺癌无论是发病率还是死亡率均居全球癌症首位,其中非小细胞肺癌(NSCLC)占80% ~85%。而75%肺癌患者临床确诊时病程已达Ⅲ~Ⅳ期,所以化疗成为目前主要的治疗手段。但化疗有效率仅为30%~40%,且这个水平已达到一个平台。因此寻找新的药物成为目前肺癌治疗的热点。藤黄(Gamboge)是藤黄科植物藤黄树(Garcinia hanbaryi Hook.f.)的树干被割伤后流出的树脂,藤黄酸(GA)为藤黄的重要活性成分之一,分子式是C38H44O8(图1),不仅具有抗病毒、抗炎、抗感染作用,还具有体良好的抗肿瘤活性。

图1 GA的结构
目前研究发现,GA的抗肿瘤作用可通过抑制 TOPOⅡα 的催化活性[1]、诱导凋亡[2]、抑制端粒末端转移酶活性[3]、激活T淋巴细胞后诱导细胞凋亡[4]、细胞周期阻滞[5],抗血管生成活性[6]等途径来实现。迄今为止,GA抗肿瘤作用的确切机制还不十分清楚。Kasibhatla等[2]研究发现,GA的分子靶点为TFR,当GA和细胞表面的转铁蛋白受体结合后,影响TFR的内在化,诱导了一个独特的凋亡信号通路,引起肿瘤细胞的快速凋亡。本实验旨在进一步研究GA诱导肺癌细胞凋亡的作用与其细胞表面TFR表达水平的关系,以及促凋亡的分子机制。
1 材料及方法
1.1 材料
SPC-A1人肺腺癌细胞株及SK-MES-1人肺鳞癌细胞株购买于上海生命科学研究所。GA由江苏连云港康缘药业股份有限公司提供,GA的125I标记及Na125I由江苏原子医学研究所提供(江苏无锡)。RPMI-1640、MEM购自美国GIBCO公司。国产胎牛血清购自杭州四季青有限公司。进口胎牛血清由美国CLARK公司提供。转铁蛋白受体抗体CD71(DF1513)购自美国Santa Cruz公司。SP-9002免疫组化试剂盒购自北京中杉金桥有限公司。Annexin V-FITC凋亡试剂盒购自Bio Vision。
1.2 细胞培养
SPC-A1细胞株培养于含10%的国产胎牛血清、青霉素 100 U/mL和链霉素 150 μg/mL的PRMI-1 6 4 0培养基中,5%CO2培养箱中,37℃培养,0.25%胰蛋白酶消化传代。SK-MES-1细胞株培养于含10%的进口胎牛血清、青霉素100 U/mL和链霉素150 μg/mL的MEM培养基中,5%CO2培养箱中,37℃培养,0.25%胰蛋白酶消化传代。
1.3 免疫组化法测定细胞表面TFR的表达
取对数生长期的SPC-A1和SK-MES-1细胞爬片后,丙酮固定,晾干后树胶固定于载玻片上,PBS冲洗后加3%H2O2室温10 min,PBS冲洗后加封闭用正常山羊血清工作液室温15 min,倾去,勿洗。滴加 1∶50稀释的一抗 CD71(DF1513)(以PBS代替一抗作阴性对照),37℃,3 h,PBS冲洗后加生物素标记山羊抗小鼠IgG室温15 min,PBS冲洗后加辣根酶标记链霉卵白素工作液室温孵育15 min,PBS冲洗后加新鲜配制的DAB显色剂,显微镜下控制显色时间,自来水终止反应。酒精脱水,二甲苯透明,树胶封片。用Image-proplus软件测定光密度值分析2组细胞表面转铁蛋白受体的表达水平。
1.4 流式细胞仪检测肺癌细胞株凋亡率
根据IC50值分别用0、0.8、1.5、1.6、2.0、3.2 μM的GA处理 SPC-A1细胞24 h后,收集细胞后 PBS冲洗 2次,加入 Annexin-FITC及10μL的PI,行流式细胞仪检查,同一浓度重复3 次。根据IC50值分别用0、1.2、1.5、2.0、2.4、4.8 μM的GA处理 SK-MES-1细胞24 h后,收集细胞后 PBS冲洗 2次,加入 Annexin-FITC及10μL的PI,行流式细胞仪检查,同一浓度重复三次。
1.5 Western blotting检测 Bax,p53,Caspase2,Caspase 9,Caspase 10蛋白的表达
用 0.9%生理盐水及 0.8、1.6、3.2 μM 的 GA作用于SPC-A1细胞,以及用0.9%生理盐水和1.2、2.4、4.8 μmol/L 的 GA 作用于 SK-MES-1 细胞24 h后,胰酶消化后,分别收集2组细胞,弃上清,加入蛋白质裂解液、蛋白酶抑制剂提取总蛋白。按试剂盒说明,测定蛋白浓度后行变性聚丙烯胺凝胶电泳。分离蛋白,转移至硝酸纤维素膜,给予5%脱脂奶粉封闭1 h,加入1∶100稀释的一抗(β-actin为内参照)4℃ 过夜,TBST洗膜3次,加入1∶100稀释的HRP标记的兔抗鼠IgG室温孵育1 h,TBST洗膜3次,AP显色。每组试验重复3次。采用sensiansys凝胶图像分析系统测定条带的积分吸光度。
1.6 统计学分析
2 结果
2.1 TFR在SPC-A1和SK-MES-1细胞
表面的表达水平(图2)。
用免疫组化SP染色法测定2组肺癌细胞表面TFR的表达水平。根据光密度值结果显示:SPC-A1(A1)组细胞表面的TFR的表达强于SKMES-1(B1组)细胞。
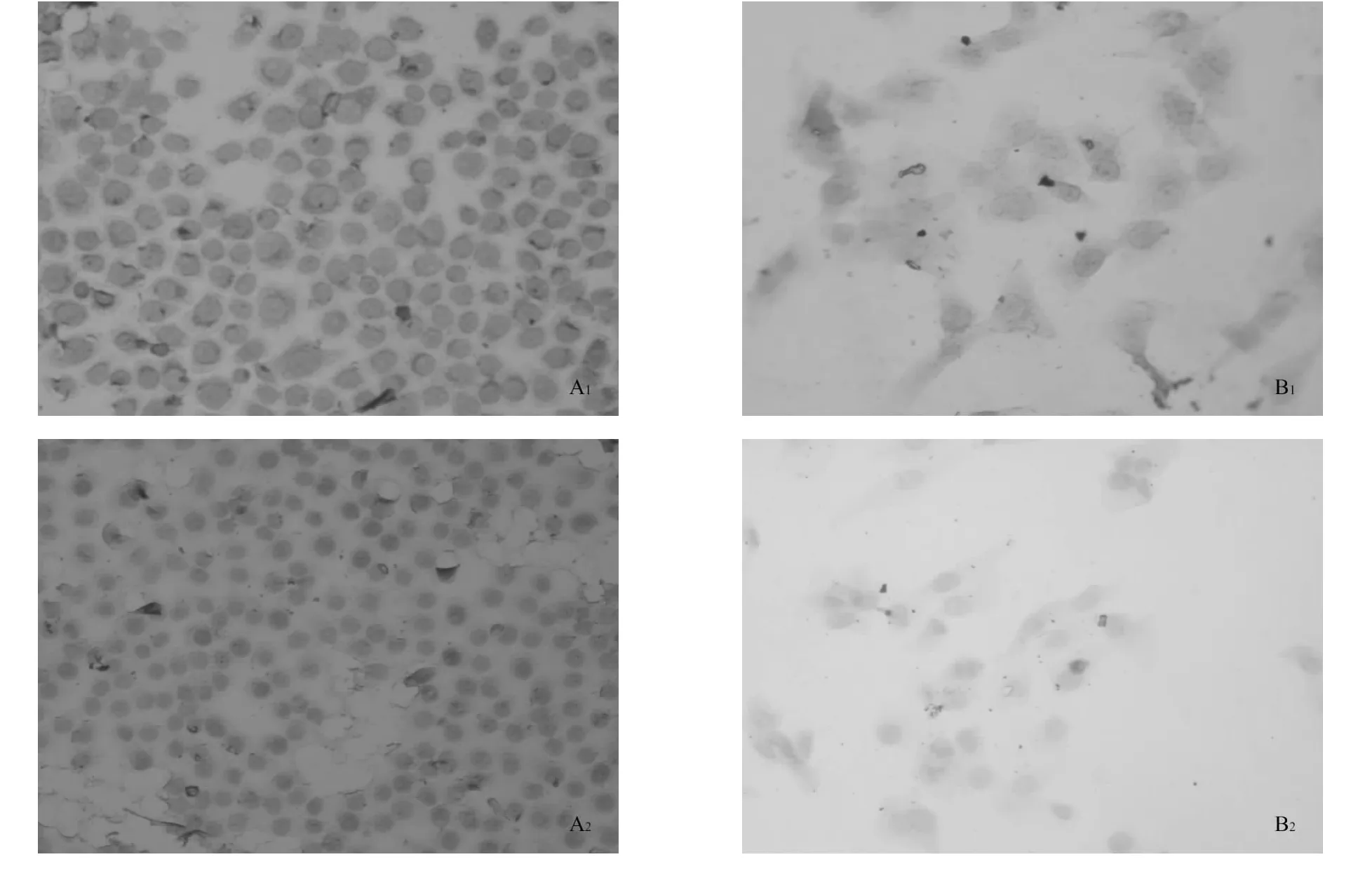
图2 2组肿瘤细胞表面TFR受体表达差异
2.2 GA诱导的肺癌细胞凋亡
不同浓度的 GA引起 SPC-A1(图3),SKMES-1(图4)细胞的凋亡率不同(凋亡率为每个图 中Q2+Q4的值)。分别用0、0.8、1.5、1.6、2.0、3.2 μmol/L 的 GA 处理 SPC-A1 24 h 后,凋亡率分别为 1.7%,6.8%,48.2%,61.6%,65.7% ,95% 。分别用0、1.2、1.5、2.0、2.4、4.8 μmol/L 的 GA 处理 Sk-MES-1 24 h 后,凋亡率分别为3.1% ,16.7% ,19.4% ,26% ,83.5%,97.3%。相同浓度(1.5 及 2.0 μmol/L)的GA作用2组细胞时,SPC-A1细胞凋亡率均大于SK-MES-1细胞(图5)。
2.3 凋亡相关蛋白Bax,p53,Caspase2,Caspase 9,Caspase10的上调
无论是SPC-A1还是SK-MES-1细胞,随着干预GA浓度的加大,Bax,p53,Caspase2,Caspase 9,Caspase 10蛋白表达逐渐增加(图 4)。但4.8 μM 的 GA作 用 于 SK-MES-1时 ,与2.4 μmol/L 相比,Bax表达不再增加。
3 讨论
TFR是一种II型跨膜糖蛋白,是由2个同源二聚体(180 kDa)的亚基通过2条二硫键交联而成。所有的正常细胞都有低水平的TFR的表达,肿瘤细胞的TFR表达增加[7-8],这可能是因为肿瘤细胞对铁的需求增加。本研究也证实肺腺癌SPC-A1细胞及肺鳞癌SK-MES-1细胞表面均有TFR表达,SPC-A1细胞表面的TFR的表达强于SK-MES-1细胞。

图3 GA引起SPC-A1细胞的凋亡率
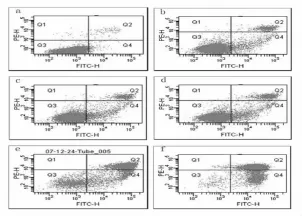
图4 GA引起SK-MES-1细胞的凋亡率

图5 相同浓度下的GA引起SPC-A1及SK-MES-1细胞的凋亡率的差异
Kasibhatla S等[2]用GA作用于TFR表达有明显差异的4组细胞5 h发现,细胞表面TFR表达(4+)的细胞的凋亡率接近80%,而细胞表面TFR表达(-)的细胞凋亡率几乎为0,与本研究结果一致。作者通过流式细胞仪发现在相同浓度(1.5及2.0 μmol/L)的 GA 作用这 2 组细胞时,SPC-A1细胞凋亡率均大于SK-MES-1细胞(P=0.000)。因此认为GA诱导肿瘤细胞凋亡的作用与肿瘤细胞表面的TFR有关,TFR的表达水平越高则肿瘤细胞对GA的敏感性越高。
引起凋亡的通路主要包括内、外源性凋亡通路。外源性途径,即死亡受体途径,主要是通过死亡受体来完成的,其中最典型的死亡受体包括Fas、DR4/DR5、TNFR1,其 中 DR4/DR5 属 于TRAIL的受体。目前只有3种TNF家族蛋白分子被报道具有诱导凋亡功能,分别是TRAIL、FasL和 TNF-α。Kasibhatla 等[2]研究发现,用 Fas-Fc及TNF-Fc嵌合蛋白干扰死亡受体信号,对GA介导的细胞凋亡没有任何影响。而Pandey等[9]研究发现,GA是通过调节NF-kappaB信号通路来加强TNF诱导的细胞凋亡。即GA究竟通过何种机制诱导细胞凋亡仍说法不一。Caspase按功能分为2类:一类是凋亡起始酶,包括Caspase-1,2,4,5,8,9,10,11,12,13;另一类是凋亡执行酶,包括Caspase-3,6,7。在细胞外凋亡途径中,当死亡配体(如Fas配体或Fas抗体)与细胞膜上的特异性死亡受体结合后,形成一个含有受体、FADD和Caspase8或10[10]的复合物,称为死亡诱导转导复合体(DISC)。
在复合物中,Caspase8或10通过自身消化而被激活成具有活性的Caspase四聚体。成熟的Caspase8,10具有蛋白酶活性,直接作用于Caspase3,6,7,从而导致细胞凋亡[11-16]。细胞内途径又称线粒体途径[12],当凋亡刺激因子引起细胞色素C从线粒体释放到胞浆时,与胞浆中的凋亡蛋白激活因子1羧基端的WD重复序列结合,形成多聚复合物,多聚复合物结合胞质中的Caspase 9前体,形成巨大复合物,导致Caspase 9前体活化成为 Caspase 9,后者再活化下游的Caspase 3,被活化的Caspase 3再发生级联反应,最终导致细胞凋亡。Kasibhatla等[2]研究发现,Caspase 8参与了GA诱导的细胞凋亡,但在TFR的免疫沉淀中没有发现DISC。本研究结果显示:凋亡起始酶Caspase2,9,10也参与了GA诱导肺癌细胞的凋亡,且随着GA浓度的加大,表达逐渐增加[17-19]。
p53基因位于人的17号染色体短臂1区3带1亚带(17p13.1),有11个外显子组成,编码393个氨基酸组成的53KD的核内磷酸化蛋白,它的启动子包含大量常见转录因子,如Sp1,NF-kappaB 或 c-Jun 的共有结合蛋白[20-23]。当细胞处于应激状态下,p53反式激活或反式抑制许多下游的不同基因而导致细胞凋亡。p53介导反式激活的凋亡相关基因包括凋亡前体蛋白Bcl-2家族成员,包括Bax及Bid等。凋亡蛋白酶激活因子1是凋亡体中的一个重要成分;Fas;CD95,DR4/DR5[24]。本实验中p53和Bax的表达均上调,说明p53和Bax都参与了GA诱导的肿瘤细胞凋亡,且p53、Bax随着GA浓度的加大表达逐渐增加。
[1] Qin Y X,Meng L H,Hu C X,et al.Gambogic acid inhibits the catalytic activity of human topoisomerase IIA by binding to its ATPase domain[J].Mol Cancer Ther,2007,6:2429.
[2] Kasibhatla S,Jessen K A,Maliartchouk S,et al.A role for transferrin receptor in triggering apoptosis when targeted with gambogic acid[J].Proc Natl Acad Sci US A,2005,102:12095.
[3] Yu J,Guo Q L,You Q D,et al.Repression of telomerase reverse transcriptase mRNA and hTERT promoter by gambogic acid in human gastric carcinoma cells[J].Cancer Chemother Pharmacol,2006,58:434.
[4] Gu H Y,You Q D,Liu W,et al.Gambogic acid induced tumor cell apoptosis by T lymphocyte activation in H22 transplanted mice[J].Int Immunopharmacol,2008,8:1493.
[5] Chen J,Gu H Y,Lu N,et al.Microtubule depolymerization and phosphorylation of c-Jun N-terminal kinase-1 and p38 were involved in gambogic acid induced cell cycle arrest and apoptosis in human breast carcinoma MCF-7 cells[J].Life Sci,2008,83:103.
[6] Qiang L,Yang Y,You Q D,et al.Inhibition of glioblastoma growth and angiogenesis by gambogic acid:An in vitro and in vivo study[J].Biochem Pharmacol,2008,75:1083.
[7] P.T.Gomme,K B.McCann,J.Bertolini.Transferrin:structure,function and potential therapeutic actions[J].Drug Discov Today,2005,10:267.
[8] M.Prutki,M.Poljak-Blazi,M.Jakopovic,D.et al.Altered iron metabolism,transferring receptor 1 and ferritin in patients with colon cancer[J].Cancer Lett,2006,238:188.
[9] Pandey M K,Sung B,Ahn K S,et al.Gambogic acid,a novel ligand for transferrin receptor,potentiates TNF induced apoptosis through modulation of the nuclear factor-{kappa}B signaling pathway[J].Blood,2007,110:3517.
[10] Sprick M R,Rieser E,Stahl H,et al.Caspase-10 is recruited to and activated at the native TRAIL andCD95 death-inducing signaling complexes in a FADD-dependent manner but can not functionally substitute caspase-8[J].EMBO J,2002,21(17):4520.
[11] Wang Y,Sun L G,Xia C H.Caspase-mediated Fas apoptosis pathway[J].World Chinese Journal of Digestology,2006,14(36):3439.
[12] Jin L F,Chen T.Proteinum Family of Bcl-2 gene and apoptosis[J].Med Recapitul,2005,1(5):446.
[13] 袁淑芬.三维适形放疗联合化疗对局限期小细胞肺癌的治疗作用[J].海南医学院学报,2011,17(8):1063.
[14] 张国明,胡礼仪,周业庭,等.晚期非小细胞肺癌患者一线化疗前后血浆核小体检测及意义[J].海南医学院学报,2011,17(7):937.
[15] 吴绍华.多西他赛联合顺铂治疗47例进展期非小细胞肺癌的疗效观察[J].海南医学院学报,2010,16(12):1615.
[16] 胡小平.健择联合顺铂时辰治疗晚期非小细胞肺癌临床观察[J].海南医学院学报,2010,16(2):234.
[17] 桑圣刚,胡敏,荣红.基质金属蛋白酶-9基因启动子甲基化在非小细胞肺癌治疗中的作用[J].中华肺部疾病杂志(电子版),2013,6(3):35.
[18] 梁丽峰,李佩佩,常蕊静,等.小细胞肺癌细胞H446及其MDR细胞H446/DDP受顺铂冲击后乳酸代谢与活性氧产生情况[J].中华肺部疾病杂志(电子版),2013,(2):30.
[19] 李艳,郭其森.βⅢ-tubulin在NSCLC中的表达与抗微管类药物耐药相关性的研究进展[J].中华肺部疾病杂志(电子版),2013,6(2):71.
[20] 王新,王雷.奥氮平联合昂丹司琼预防非小细胞肺癌化疗所致恶心呕吐的疗效观察[J].中华肺部疾病杂志(电子版),2012,5(6):12.
[21] 韩越,吕红英,姚如永,等.晚期非小细胞肺癌ERCC1 XRCC1基因多态性与铂类化疗疗效研究[J].中国实用内科杂志,2011,31(8):638.
[22] 白冲.经支气管镜介入诊断和治疗支气管肺癌[J].中国实用内科杂志,2013,33(2):109.
[23] Bouchet B P,de Fromentel C C,Puisieux A,et al.p53 as a target for anti-cancer drug development[J].Crit Rev Oncol Hematol,2006,58:190.
[24] Shu K X,Li B,Wu L X.The p53 network:p53 and its downstream genes[J].Colloids Surf B Biointerfaces,2007,55:10.
