利用双外流持续发酵系统研究植物精油对瘤胃发酵和甲烷生成的影响
2013-09-20金恩望卜登攀王加启姜雅慧包万华史浩亭沈维军李发弟
金恩望 卜登攀 王加启 姜雅慧 包万华 史浩亭 沈维军 李发弟
(1.中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京 100193;2.甘肃农业大学动物科学技术学院,兰州 730070)
瘤胃是反刍动物消化系统中最重要的器官。瘤胃中合成的微生物蛋白和挥发性脂肪酸(VFA)为反刍动物提供了其所需要的大部分蛋白质和能量[1]。然而,瘤胃发酵过程中产生的甲烷(CH4)和部分氨态氮(NH3-N)以直接或间接的方式排出体外,降低了反刍动物对能量和蛋白质的利用效率[2]。因此,通过调控瘤胃微生物发酵,提高饲粮纤维成分降解率,减少CH4生成和氮的排泄,对提高反刍动物生产性能和降低环境污染具有重大意义。很长时间以来,抗生素作为反刍动物饲料添加剂可有效调控瘤胃微生物菌群,降低瘤胃中能量和蛋白质的损失[3]。但是抗生素的添加所产生的抗药性以及其在肉和乳中的残留等问题给食品安全带来了很大挑战。目前,许多国家已经禁止或限制在反刍动物饲料中添加抗生素等添加剂。因此,寻找天然的瘤胃调控剂对提高反刍动物生产性能和保护环境具有重要的基础和现实意义。
植物精油是植物次生代谢产物,具有抗菌、抗氧化和提高免疫力等功能[4]。在反刍动物营养中,植物精油能通过选择性地抑制某些特定的微生物菌群来调控瘤胃微生物发酵[5],降低瘤胃中CH4的产生和调控瘤胃氮代谢。Jahani-Azizabadi等[6]用批次培养法研究了植物精油对瘤胃发酵特性的影响,表明添加20μL/L的莳萝油、牛至油和肉桂油等能显著降低NH3-N浓度和CH4生成。Evans等[7]的体外试验表明,添加400 mg/L的百里香酚显著降低了CH4生成,但同时也降低了瘤胃液中的乙酸和丙酸浓度。Borchers等[8]报道,瘤胃液中添加1 000 mg/L的百里香导致瘤胃液中氨基酸积累和NH3-N浓度降低,从而改变瘤胃微生物氮代谢。Castillejos等[5]通过持续培养试验指出,添加1 500 mg/L的混合植物精油能提高发酵液中总挥发性脂肪酸(TVFA)浓度,但是对有机物质降解率没有显著影响。而Busquet等[9]报道,一些植物精油(肉桂油、茶树油、丁香油和大蒜油)及其主要成分(肉桂醛、丁子香酚等)的添加浓度为3 000 mg/L时显著抑制了瘤胃微生物发酵,300 mg/L的添加浓度为影响瘤胃氮代谢的临界水平,而添加3 mg/L的这些植物精油及其主要成分对瘤胃微生物发酵均未产生显著影响。植物精油的种类繁多,不同研究者研究植物精油不同添加水平对瘤胃发酵和CH4生成影响的结论不尽一致。而且,植物精油对瘤胃发酵影响的试验大多采用短期的批次培养法。对于瘤胃微生物菌群对植物精油适应性的认识缺乏,植物精油对不同发酵时间点瘤胃发酵的影响效果还不够全面。本试验旨在采用双外流人工瘤胃法研究不同添加水平的肉桂油和留兰香油对瘤胃体外发酵模式、瘤胃氮代谢和CH4生成的影响,筛选有利于瘤胃发酵的植物精油种类和添加水平,为开发天然瘤胃调控剂提供理论参考。
1 材料与方法
1.1 供体动物饲养及瘤胃液的采集
试验动物为3头安装永久性瘤胃瘘管的泌乳期[(136±37)d]健康荷斯坦奶牛,由中国农业科学院北京畜牧兽医研究所昌平动物试验基地提供。每天于07:00和19:00饲喂全混合日粮,全天自由饮水。于晨饲前1 h采集3头供体奶牛的瘤胃液,混合均匀后用4层纱布快速过滤(同时充入二氧化碳),放入保温瓶迅速带回实验室。
1.2 植物精油和饲料样品制备
肉桂油和留兰香油购自吉安市海瑞天然植物有限公司。发酵所用饲料与供体动物所饲喂的饲粮一致,饲料原料粉碎并过2 mm筛,按配方制成颗粒料,风干后备用。饲粮组成及营养水平见表1。

表1 饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of the diet(DM basis) %
1.3 试验设计
采用单因子随机试验设计,将每种植物精油(肉桂油和留兰香油)的4种添加水平(0、100、500和1 500 mg/L)作为处理因素。将3台瘤胃模系统(见1.4)上的12个相同的双层不锈钢发酵罐随机分为4处理,每个处理3个重复,每个试验周期为6 d,包括适应期3 d和采样期3 d。每种植物精油在1个月内重复2期试验。
1.4 瘤胃模拟系统及体外发酵
体外发酵装置采用中国农业科学院北京畜牧兽医研究所研制的“新型固液气分流式瘤胃模拟系统[10]”。该发酵系统实时监控并记录发酵罐内温度、pH和产气量,并能按照设定液体稀释率持续向发酵罐中注入人工唾液以及随时可以按照指令向发酵罐中持续冲入氮气(N2)以维持发酵罐内的厌氧环境。开始发酵时向每个发酵罐(有效体积1 L)中加入20 g饲粮、670 mL新鲜瘤胃液和330 mL人工唾液进行发酵,人工唾液采用Mc Dougall等[11]设计的配方配制。设定好各种试验条件:温度39℃;转速15 r/min;液体稀释率8%/h;固体稀释率4%/h;人工唾液中加入0.4 g/L尿素,以模仿瘤胃氮循环。每天09:00和21:00从排固口抽出100 mL发酵过食糜,然后从加料口向每个发酵罐中加入20 g饲粮(补料)和100 mL人工唾液。补料时向每个发酵罐加入相应种类和水平的植物精油,同时向发酵罐中持续充入N2,以维持罐内厌氧环境。
1.5 样品采集
每天(整个试验期)补料前从发酵罐中部的排液口采集发酵液5 mL用于原虫数量的测定,从发酵罐底部的排泄口收集消化后过筛网的食糜于尼龙袋中用于食糜的干物质(DM)、粗蛋白质(CP)、中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)的测定。以天为单位计算粗蛋白质降解率(dCP)、中性洗涤纤维降解率(dNDF)和酸性洗涤纤维降解率(dADF),以研究植物精油对瘤胃微生物降解活性影响的趋势。因为补料3 h后发酵系统和瘤胃微生物发酵都处于相对稳定的状态,因此,整个试验期的每天09:00补料后3 h时采集发酵液4 mL用于NH3-N和VFA浓度的测定,以研究瘤胃微生物对植物精油的适应情况。采样期(第4~6天)每天09:00补料后6、9和12 h均采集发酵液2 mL用于VFA浓度的测定,以研究植物精油对每个补料周期内VFA浓度的变化情况。通过安装在罐内的pH电极自动检测发酵液pH,并自动录入计算机。因为每次补料间隔(12 h)内的pH变化规律一致,即以12 h为单位提取数据,研究植物精油对发酵液中pH变化规律的影响。采样期每个发酵罐外接一个标号气袋收集09:00补料后12 h内发酵所产生的气体,用于CH4体积分数的测定。
1.6 样本分析
采集的样品按10∶1比例加入25%的偏磷酸处理后用气相色谱(Agilent-6890 NGC system,Agilent,America)法测定VFA浓度。所采集的溢流液样品按3∶1比例加入25%的偏磷酸,摇匀后在12 000×g下离心20 min,取上清液采用靛酚比色法进行NH3-N浓度的测定。将从发酵罐中部取得的5 mL溢流液加入10 mL甲基绿染色液,摇匀静置过夜,采用Sedgewick-Rafter(ARTHUR Thomas NO.9851-C20)原虫计数板计数[12]。气体中CH4体积分数利用气相色谱(Agilent-6890 NGC system)测定。NDF和 ADF含量按照 Van Soest等[13]的方法测定。DM 含量参照GB 6435—86测定,根据发酵前后的DM质量关系计算体外干物质降解率。
1.7 数据分析
试验各项指标的数据用Excel 2007进行初步整理后,采用SAS 9.0中MIXED模型进行方差分析,数据用平均值±标准差表示,P<0.05为显著水平,并采用Tukey方法进行多重比较。
2 结果与分析
2.1 植物精油添加水平对发酵液p H的影响
由表2可知,各组pH在发酵初期均呈现较快地增加,随着发酵时间的延长,增加速度逐渐放缓,肉桂油各添加组在发酵36 h以后pH基本稳定在6.6~6.8之间,留兰香油各添加组在发酵48 h以后pH基本稳定在6.7~6.8之间。与对照组相比,添加100、500 mg/L的肉桂油和留兰香油均不同程度地提高了pH(P>0.05),添加1 500 mg/L的肉桂油在发酵108 h时pH显著降低(P<0.05),而在其余时间点未产生显著影响(P>0.05)。
2.2 植物精油添加水平对营养成分降解率的影响
由表3可知,添加100、500 mg/L的肉桂油和所有剂量的留兰香油对dCP、dNDF和dADF均未产生显著影响(P>0.05)。添加1 500 mg/L的肉桂油在发酵第5、6天 dNDF和 dADF显著降低(P<0.05),在发酵第 2、4、5和 6天 dCP显著降低(P<0.05),其余各时间这3种营养成分的降解率与对照组无显著差异(P>0.05)。
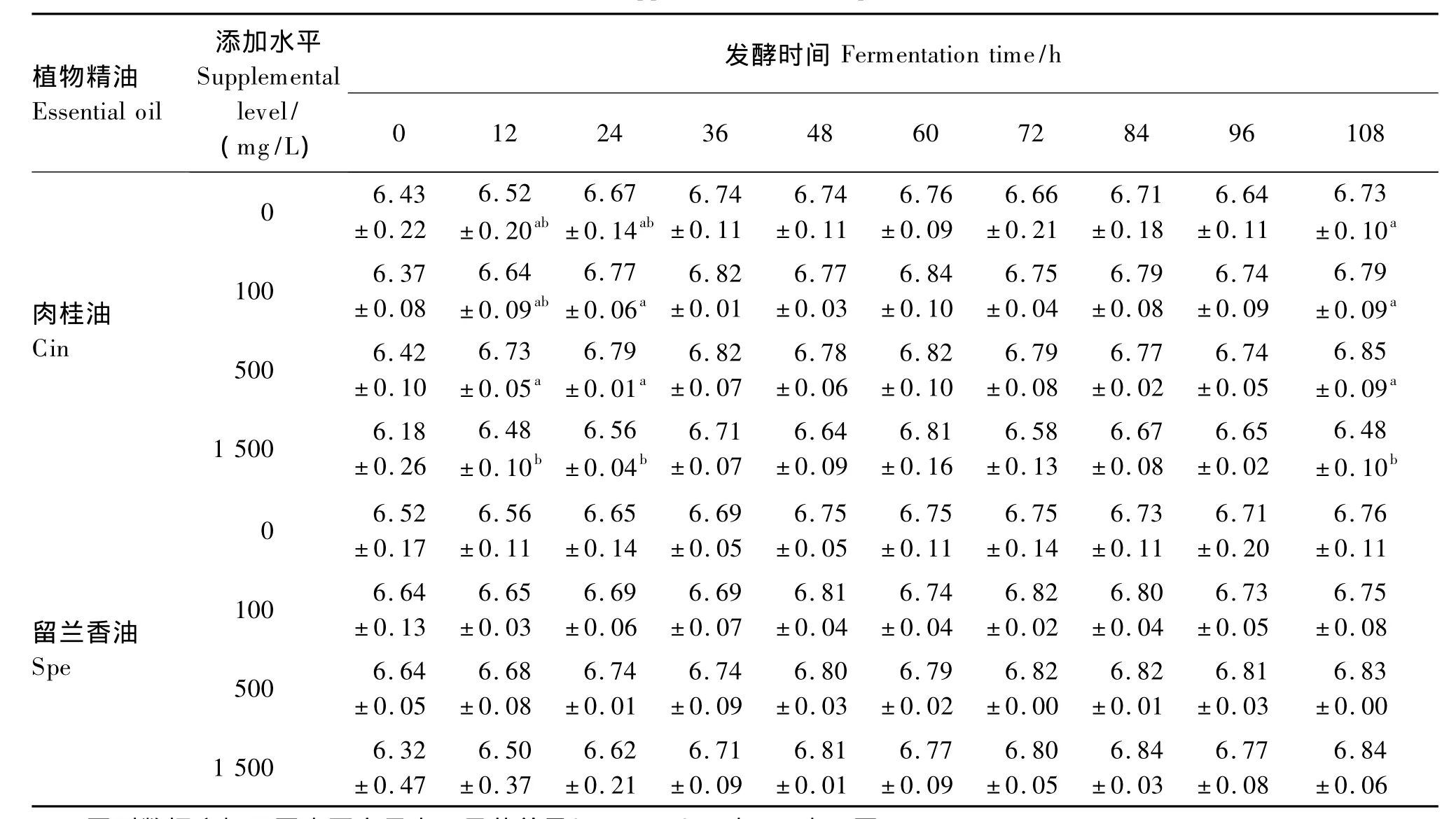
表2 植物精油添加水平对不同发酵时间pH的影响Table 2 Effects of essential oil supplemental level on pH at different fermentation time

表3 植物精油添加水平对不同发酵时间营养成分降解率的影响Table 3 Effects of essential oil supplemental level on nutrient degradation rate at different fermentation time %
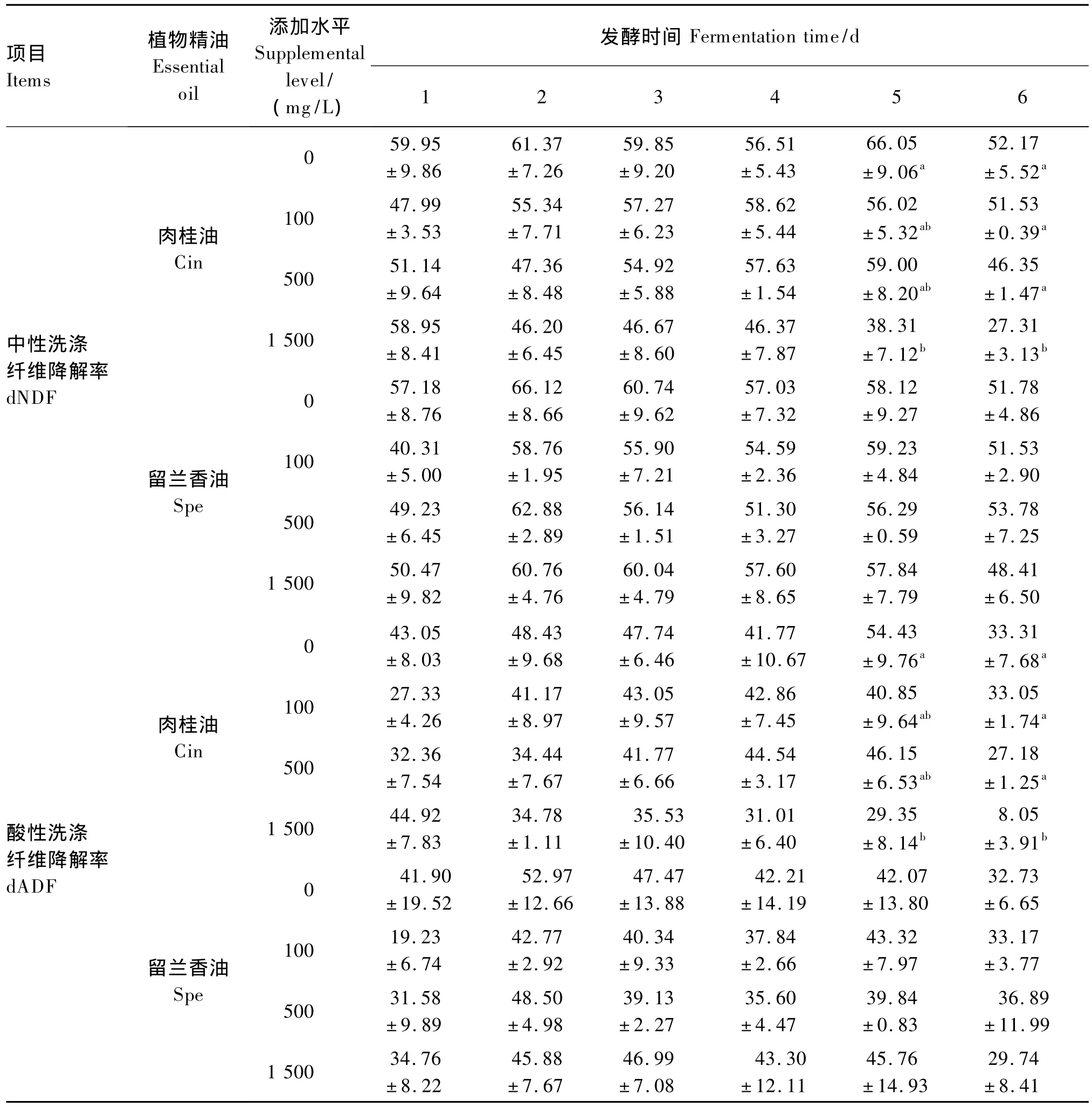
续表3
2.3 植物精油添加水平对VFA浓度的影响
从表4可知,在发酵初期(3 h)时添加肉桂油和留兰香油对TVFA、乙酸、丙酸浓度和乙酸/丙酸(A/P)均未产生显著影响(P>0.05)。从发酵27 h开始,1 500 mg/L肉桂油添加组的TVFA、乙酸和丙酸浓度显著下降(P<0.05),A/P显著升高(P<0.05)。1 500 mg/L留兰香油添加组TVFA在发酵123 h时显著下降(P<0.05),在发酵27、99和123 h时丙酸浓度显著下降(P<0.05),A/P从发酵27 h开始显著升高(P<0.05)。500 mg/L肉桂油添加组TVFA、乙酸和丙酸浓度在发酵27和99 h时显著降低(P<0.05),而在其余发酵时间点与对照组差异不显著(P>0.05)。100 mg/L的肉桂油、留兰香油和500 mg/L的留兰香油添加组对各发酵时间点的VFA浓度均未产生显著影响(P>0.05)。随着发酵时间的延长,0、100和500 mg/L肉桂油添加组TVFA、乙酸、丙酸浓度和A/P无显著变化(P>0.05),而1 500 mg/L肉桂油添加组TVFA、乙酸和丙酸浓度显著下降(P<0.05),A/P显著升高(P<0.05)。
由表5可知,1 500 mg/L肉桂油添加组在发酵的各个时间点均显著降低了TVFA、乙酸和丙酸浓度(P<0.05),提高了 A/P(P<0.05)。1 500 mg/L留兰香油添加组显著降低了丙酸浓度(P<0.05),显著提高了 A/P(P<0.05),而对TVFA和乙酸浓度无显著影响(P>0.05)。除了500 mg/L肉桂油添加组在补料后9 h时显著降低了乙酸浓度(P<0.05),在其余时间点100和500 mg/L肉桂油和留兰香油添加组对TVFA和乙酸浓度均未产生显著影响(P>0.05)。在1个补料周期(12 h)内,随着发酵时间的延长,各留兰香油添加组TVFA、乙酸和丙酸浓度呈现下降趋势,但均未达到显著水平(P>0.05)。

表4 植物精油添加水平对不同发酵时间VFA浓度的影响Table 4 Effects of essential oil supplemental level on VFA concentration at different fermentation time mmol/L

表5 植物精油添加水平对补料后12 h内VFA浓度的影响Table 5 Effects of essential oil supplemental level on VFA concentration within 12 h after feeding mmol/L
2.4 植物精油添加水平对NH3-N浓度的影响
由表6可知,添加100和500 mg/L肉桂油和留兰香油对发酵系统中NH3-N浓度均未产生显著影响(P>0.05)。添加1 500 mg/L肉桂油和留兰香油在发酵初期(27 h以内)对NH3-N浓度影响较小,从发酵27 h开始,1 500 mg/L肉桂油添加组NH3-N浓度显著降低(P<0.05),1 500 mg/L留兰香油添加组从发酵51 h时开始显著降低NH3-N浓度(P<0.05)。随着发酵时间的延长,0、100和500 mg/L的肉桂油和留兰香油添加组NH3-N浓度呈现上升的趋势,而1 500 mg/L肉桂油添加组NH3-N浓度则呈现下降趋势。
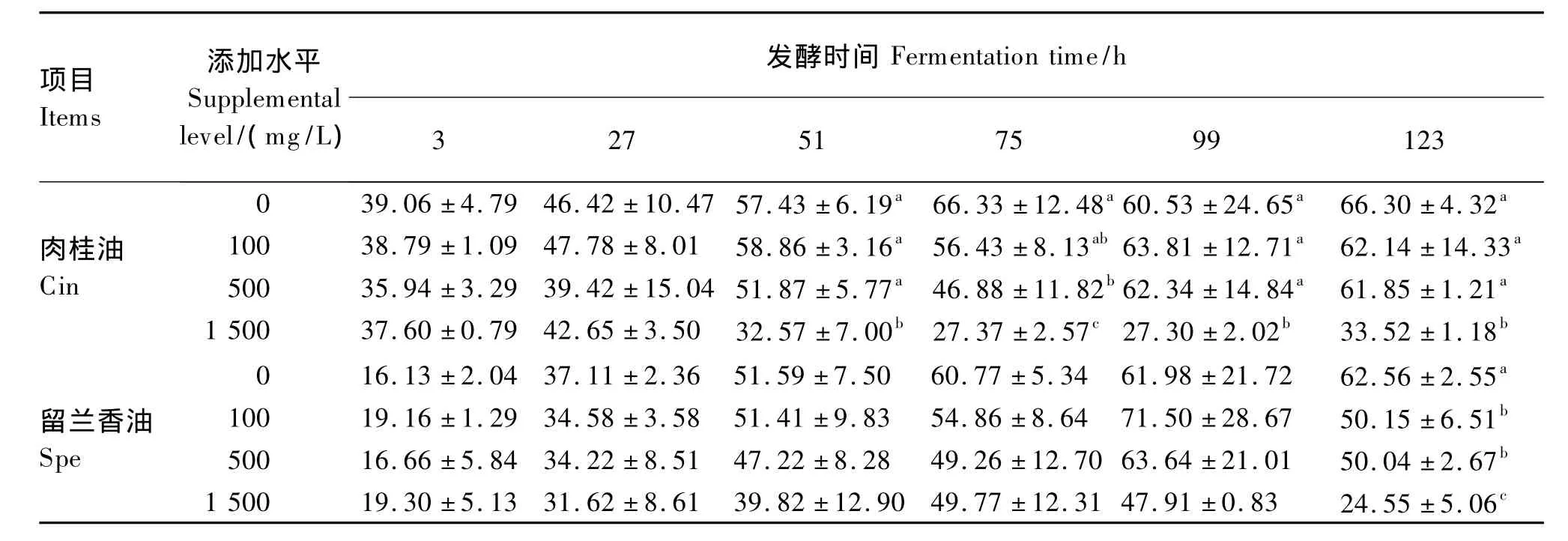
表6 植物精油添加水平对不同发酵时间氨态氮浓度的影响Table 6 Effects of essential oil supplemental level on NH3-N concentration at different fermentation time mg/dL
2.5 植物精油添加水平对原虫数量的影响
由表7可知,各肉桂油添加组在发酵第1天对原虫数量未产生显著影响(P>0.05),从第2天开始,添加500和1 500 mg/L肉桂油显著降低了原虫数量(P<0.05),而添加100 mg/L肉桂油对发酵液原虫数量无显著影响(P>0.05)。除在发酵第3天500 mg/L留兰香油添加组与对照组无显著差异(P>0.05)外,其余时间添加 500和1 500 mg/L的留兰香油均显著降低了原虫数量(P<0.05)。

表7 植物精油添加水平对不同发酵时间原虫数量的影响Table 7 Effects of essential oil supplemental level on the number of protozoa at different fermentation timelog/mL
2.6 植物精油添加水平对CH4体积分数的影响
由表8可知,添加100、500和1 500 mg/L肉桂油分别降低CH4体积分数的23.13%、38.28%和 50.40%(P<0.05)。添加100、500和1500 mg/L留兰香油分别降低CH4体积分数的17.63%、28.24%和35.14%(P<0.05)。添加肉桂油和留兰香油降低CH4体积分数的程度与添加剂量呈线性正相关(R2分别为0.91和0.87)。
3 讨论
3.1 植物精油添加水平对发酵液pH和饲粮营养物质降解率的影响
瘤胃pH的波动能反映瘤胃的综合发酵水平,它受饲粮性质、有机酸积聚和唾液分泌量的影响。本试验中所有试验组pH在发酵48 h内达到平衡状态,说明了发酵系统整体运行稳定。本试验中,添加不高于500 mg/L的2种植物精油均不同程度地增加了发酵液pH。Castillejos等[14]通过体外培养试验表明,添加500 mg/L几种植物精油的主要成分均增加了瘤胃液pH,这与本试验结果 一致。

表8 植物精油添加水平对甲烷体积分数的影响Table 8 Effects of essential oil supplemental level on CH4volume fraction
反刍动物依靠瘤胃纤维降解菌分泌的纤维素酶来分解利用饲料中的纤维物质,溶纤维丁酸弧菌、白色瘤胃球菌、黄色瘤胃球菌和产琥珀酸丝状杆菌是瘤胃中的主要纤维降解菌[15]。纤维降解菌对低pH非常敏感,pH降低将对纤维降解产生负面影响[5]。本试验中只有添加最高剂量的肉桂油在发酵后期显著降低了纤维降解率,因此,可以推断出纤维降解率的降低是由pH降低造成的。Calsamiglia等[16]报道,在补充相同饲粮的情况下,纤维降解率在pH为5.7时显著低于pH为6.4时的纤维降解率,这与本试验结果一致。
3.2 植物精油添加水平对VFA和NH3-N浓度的影响
反刍动物饲粮中的碳水化合物进入瘤胃后可被瘤胃微生物细胞内酶水解成单糖,最终发酵生成VFA,其生成量代表着反刍动物能量代谢情况。植物精油对于瘤胃内VFA浓度及比例的影响,因植物精油的种类、剂量、主要成分含量与发酵底物精粗比的不同而有所区别,也与pH具有很高相关性[17]。
Busquet等[9]通过体外试验表明,高水平(3 000 mg/L)肉桂油、茶树油和丁香油的添加水平能显降显著降低TVFA浓度,而低水平(3和30 mg/L)的添加则对TVFA浓度无显著影响。与该报道一致,本试验中添加500和1 500 mg/L的肉桂油均显著降低了TVFA和丙酸浓度,而100 mg/L肉桂油和留兰香油的添加对TVFA、乙酸和丙酸浓度无显著影响。Cardozo等[18]研究表明,添加300 mg/L的肉桂油显著降低了瘤胃液TVFA和支链脂肪酸浓度,而添加30 mg/L的肉桂油对TVFA和乙酸浓度无影响。这些结果共同说明了添加低水平肉桂油对体外发酵VFA浓度没有影响,高水平时降低VFA浓度,有效的临界剂量在100~300 mg/L之间。
肉桂醛是肉桂油的主要成分,一般占90%以上。研究表明,肉桂醛对特定的微生物菌群有抗菌作用,其作用机制与其分子结构中的羰基有关[19]。本试验中,0、100 和 500 mg/L 肉桂油添加组VFA浓度和比例随着发酵时间的延长无显著变化,从而说明在本发酵系统中,在1个发酵周期(6 d)内发酵性能比较稳定。而1 500 mg/L肉桂油添加组随发酵时间的延长VFA浓度显著下降,A/P比例显著升高,这种变化可能是由于添加高水平肉桂油时肉桂醛抑制了某些微生物菌群,改变了瘤胃发酵模式造成的。
蛋白质降解包括蛋白质水解、肽水解和脱氨基等一系列复杂过程。瘤胃液中的NH3-N浓度是衡量瘤胃氮代谢的一个重要指标,能间接反映出瘤胃微生物利用NH3-N合成微生物菌体蛋白和微生物分解饲料蛋白生成NH3-N的平衡情况[20]。植物精油可以通过抑制高活性氨基酸发酵菌活性和影响氨基酸的降解程度,从而影响瘤胃蛋白质代谢[21]。体外培养试验中添加留兰香油对发酵液中的NH3-N浓度的影响不尽一致[22]。Castillejos等[5]报道,在连续培养系统中添加混合植物精油对瘤胃细菌的氮代谢没有调节作用。本试验中只有2种精油的最高添加水平组NH3-N浓度显著降低。Cardozo等[23]的体外试验结果表明,肉桂醛(3 000 mg/L)可以通过抑制脱氨的作用而降低瘤胃液NH3-N浓度;Chaves等[24]报道,体外培养试验中添加留兰香油(1 500 mg/L)降低NH3-N浓度是由于其抑制了微生物蛋白的水解活性,与本试验结果一致。
随着发酵时间的延长,这2种植物精油的非最高添加剂量组和对照组NH3-N浓度均呈现上升的趋势,说明在整个试验周期内瘤胃微生物不断降解饲粮粗蛋白质生成NH3-N,并且生成NH3-N的速度大于瘤胃微生物利用NH3-N合成微生物蛋白的速度。而1 500 mg/L肉桂油添加组随着发酵时间的延长NH3-N浓度则呈现缓慢下降趋势,可能是高剂量肉桂油的添加抑制了具有脱氨基作用的细菌活性,从而导致NH3-N的生成速度小于瘤胃微生物利用NH3-N合成微生物蛋白的速度。
3.3 植物精油添加水平对发酵液中原虫数量和CH4体积分数的影响
瘤胃原虫是瘤胃微生物的重要组成部分,其在瘤胃内数量的变化可作为衡量瘤胃环境变化的指标。Kongmun等[25]报道,体外培养试验中添加椰子油和大蒜粉使原虫数量降低了68.4%~75.9%,从而调控瘤胃微生物菌群。本试验中添加500和1 500 mg/L植物精油显著降低了发酵液中的原虫数量。原虫数量的降低可能是由于细胞膜渗透性降低所导致,Talebzadeh等[26]报道,植物精油抗原虫机制可能是其主要成分中的酚基,其能导致对于细胞代谢至关重要的细胞膜破裂、酶失活和金属离子流失等[27]。
CH4是反刍动物消化过程中的产物,降低CH4排放既能提高反刍动物能量利用效率,又能降低温室效应。植物精油可以抑制产CH4菌活性或通过降低瘤胃液中原虫数量从而间接减少产CH4菌数量[28],金恩望等[29]通过体外产气试验表明,添加50~1 000 mg/L的肉桂油降低了CH4体积分数的 26.9% ~67.8%。Macheboeuf等[30]报道,体外发酵试验中添加500 mg/L的肉桂油能抑制瘤胃CH4菌活性,并降低了CH4产量的26%。与这些报道一致,本试验中添加这2种植物精油的各组均显著降低了CH4体积分数,并且降低CH4的程度与添加剂量均呈正相关。在瘤胃发酵体系中,产CH4菌附着在原虫表面与原虫形成内外共生关系[15]。原虫细胞膜内壁有多种脱氢酶,催化反应产生的氢分子通过种间氢转移被产CH4菌用于合成CH4[31]。因此,本试验中添加 500和1 000 mg/L的这2种植物精油组原虫数量的降低可能是导致CH4体积分数减少的重要原因。Pellikaan等[32]报道,体外发酵试验中添加肉桂醛能显著降低CH4生成,说明肉桂油降低CH4主要与其主要成分肉桂醛有关。肉桂醛的抗菌机制是破坏细菌的细胞质膜,从而导致细胞ATP消耗和影响葡萄糖运输[33]。
4 结论
①发酵体系中添加1 500 mg/L的肉桂油和留兰香油以及500 mg/L的肉桂油能降低发酵液中的NH3-N浓度、原虫数量和CH4体积分数,但同时也降低了发酵液中VFA浓度和饲粮营养物质降解率。其中添加1 500 mg/L肉桂油严重抑制了瘤胃微生物正常发酵。
②发酵体系中添加100 mg/L的肉桂油和留兰香油能显著降低CH4体积分数,同时对VFA的生成和饲粮营养物质降解率没有负面影响。
[1]ADESOGAN A T.Using dietary additives to manipulate rumen fermentation and improve nutrient utilization and animal performance[C]//Proceedings:20th florida ruminant nutrition symposium.Gainesville:[s.n.],2009:13-37.
[2]VAN NEVEL C J,DEMEYER D I.Manipulation of rumen fermentation[M]//HOBSON P N.The rumen microbial ecosystem.London:Elsevier Applied Science,1988:387-444.
[3]MCGUFFEY R K,RICHARDSON L F,WILKINSON JID.Ionophores for dairy cattle:current status and future outlook[J].Journal of Dairy Science,2001,84(Suppl.):E194-E203.
[4]王洪荣,郝志敏,李世霞,等.植物次生代谢产物对瘤胃发酵调控的研究进展[J].动物营养学报,2010,22(6):1471-1476.
[5]CASTILLEJOS L,CALSAMIGLIA S,FERRET A,et al.Effects of a specific blend of essential oil compounds and the type of diet on rumen microbial fermentation and nutrient flow from a continuous culture system[J].Animal Feed Science and Technology,2005,119(1/2):29-41.
[6]AZIZABADI H J,MESGARAN M D,VAKILI S A,et al.Effect of various medicinal plant essential oils obtained from semi-arid climate on rumen fermentation characteristics of a high forage diet using in vitro batch culture[J].African Journal of Microbiology Research,2011,5(27):4812-4819.
[7]EVANS J D,MARTIN S A.Effects of thymol on ruminal microorganisms[J].Current Microbiology,2000,41(5):336-340.
[8]BORCHERS R.Proteolytic activity of rumen fluidin vitro[J].Journal of Animal Science,1965,24(4):1033-1038.
[9]BUSQUET M,CALSAMIGLIA S,FERRET A,et al.Plant extracts affect in vitro rumen microbial fermentation[J].Journal of Dairy Science,2006,89(2):761-771.
[10]沈维军,姜雅慧,王加启,等.固液气分流式瘤胃模拟系统的设计与测试[J].农业工程学报,2012,28(3):20-26.
[11]MCDOUGALL E I.Studies on ruminant saliva.1.The composition and output of sheep’s saliva[J].Biochemical Journal,1949,43(1):99-109.
[12]DEHORITY B.Ciliate protozoa[M]//MAKKAR H,MCSWEENEY C,eds.Methods in gut microbial ecology for ruminants.Netherlands:Springer,2005:67-78.
[13]VAN SOEST P J,ROBERTSON J B,LEWIS B A.Methods for dietary fiber,neutral detergent fiber,and nonstarch polysaccharides in relation to animal nutrition[J].Journal of Dairy Science,1991,74(10):3583-3597.
[14]CASTILLEJOS L,CALSAMIGLIA S,FERRET A.Effect of essential oil active compounds on rumen microbial fermentation and nutrient flow in in vitro systems[J].Journal of Dairy Science,2006,89(7):2649-2658.
[15]辛杭书,段春宇,张永根,等.饲粮中添加海南霉素对奶牛瘤胃微生物区系的影响[J].动物营养学报,2012,24(11):2249-2256.
[16]CALSAMIGLIA S,FERRET A,DEVANT M.Effects of pH and pH fluctuations on microbial fermentation and nutrient flow from a dual-flow continuous culture system[J].Journal of Dairy Science,2002,85(3):574-579.
[17]SPANGHERO M,ZANFI C,FABBRO E,et al.Effects of a blend of essential oils on some end products of in vitro rumen fermentation[J].Animal Feed Science and Technology,2008,145(1):364-374.
[18]CARDOZO P W,CALSAMIGLIA S,FERRET A,et al.Screening for the effects of natural plant extracts at different pH on in vitro rumen microbial fermentation of a high-concentrate diet for beef cattle[J].Journal of Animal Science,2005,83(11):2572-2579.
[19]SMITH-PALMER A,STEWART J,FYFE L.Antimicrobial properties of plant essential oils and essences against five important food-borne pathogens[J].Letters in Applied Microbiology,1998,26(2):118-122.
[20]王加启.反刍动物营养学研究方法[M].北京:现代教育出版社,2011.
[21]MCINTOSH F M,WILLIAMS P,LOSA R,et al.Effects of essential oils on ruminal microorganisms and their protein metabolism[J].Applied and Environmental Microbiology,2003,69(8):5011-5014.
[22]NEZHAD M T,ALIPOUR D,GOUDARZI M T,et al.Dose response to carvone rich essential oils of spearmint(Mentha spicata L.):in vitro ruminal fermentation kinetics and digestibility[J].Journal of Agricultural Science and Technology,2011,13(Suppl.):1013-1020.
[23]CARDOZO P W,CALSAMIGLIA S,FERRET A,et al.Effects of natural plant extracts on ruminal protein degradation and fermentation profiles in continuous culture[J].Journal of Animal Science,2004,82(11):3230-3236.
[24]CHAVESA V,HE M L,YANG W Z,et al.Effects of essential oils on proteolytic,deaminative and methanogenic activities of mixed ruminal bacteria[J].Canadian Journal of Animal Science,2008,88(1):117-122.
[25]KONGMUN P,WANAPAT M,PAKDEE P,et al.Manipulation of rumen fermentation and ecology of swamp buffalo by coconut oil and garlic powder supplementation[J].Livestock Science,2011,135(1):84-92.
[26]TALEBZADEH R,ALIPOUR D,SAHARKHIZ M J,et al.Effect of essential oils of Zataria multiflora on in vitro rumen fermentation,protozoal population,growth and enzyme activity of anaerobic fungus isolated from Mehraban sheep[J].Animal Feed Science and Technology,2012,172(3/4):115-124.
[27]GOEL G,PUNIYA A K,AGUILAR C N,et al.Interaction of gut microflora with tannins in feeds[J].Naturwissenschaften,2005,92(11):497-503.
[28]OHENE-ADJEI S,CHAVES A V,MCALLISTER T A,et al.Evidence of increased diversity of methanogenic archaea with plant extract supplementation[J].Microbial Ecology,2008,56(2):234-242.
[29]金恩望,王加启,卜登攀,等.利用体外产气法研究植物精油对瘤胃体外发酵和甲烷生成的影响[J].中国农业大学学报,2013,18(3):99-106.
[30]MACHEBOEUF D,MORGAVI D P,PAPON Y,et al.Dose-response effects of essential oils on in vitro fermentation activity of the rumen microbial popula-tion[J].Animal Feed Science and Technology,2008,145(1):335-350.
[31]陆燕,林波,王恬,等.大蒜油对体外瘤胃发酵、甲烷生成和微生物区系的影响[J].动物营养学报,2010,22(2):386-392.
[32]PELLIKAAN W F,HENDRIKS W H,UWIMANA G,et al.A novel method to determine simultaneously methane production during in vitro gas production using fully automated equipment[J].Animal Feed Science and Technology,2011,168(3):196-205.
[33]OUWEHAND A C,TIIHONEN K,KETTUNEN H,et al.In vitro effects of essential oils on potential pathogens and beneficial members of the normal microbiota[J].Veterinarni Medicina,2010,55(2):71-78.
