牛磺酸转运体的调节机制及其在动物营养研究中的意义
2013-09-20张小龙张素云唐志如
张小龙 邓 欢 陈 澄 张素云 唐志如*
(1.西南大学动物科技学院,生物饲料与分子营养实验室,重庆 400715;2.贵州大学生命科技学院,贵阳 550025)
牛磺酸(taurine,Tau)又称2-氨基乙磺酸,具有调节激素释放、保持细胞内外渗透压平衡、维持细胞钙稳态、清除自由基和抗脂质过氧化等作用。牛磺酸转运体(taurine transporter,TAUT)是一种Na+及Cl-依赖性转运体,在哺乳动物组织内广泛表达。TAUT对Tau的转运起着重要的作用。Roig-Pérez等[1]发现,Tau 能够通过 TAUT 转运进入人肠上皮Caco-2细胞,抑制脂质过氧化物的产生;敲除TauT基因后,血清中丙二醛(MDA)、一氧化氮(NO)和过氧化氢(H2O2)的水平升高,使肠道产生严重氧化应激反应。Ito等[2]同样报道,敲除TauT基因会增加细胞炎症和氧化应激反应,并使许多肌肉组织发生严重病变。这些研究表明TAUT对运输Tau以及调节机体稳态具有重要作用,因此研究TAUT的调节机制对Tau在养殖业中的应用具有重要意义。
1 TAUT的种类与结构
1.1 TAUT的种类
TAUT广泛存在于细胞膜上,也有少量存在于NIH3T3成纤维细胞中核区室内[3]。目前,TAUT已在多种动物的不同组织中得到了克隆,包括脑、肾脏、甲状腺、小肠、胎盘、肝脏等部位。不同动物和组织中的TAUT具有高度的同源性,为包含599~638个氨基酸残基的蛋白质(表1)。
1.2 TAUT的结构
TAUT具有许多丝氨酸(Ser)和Ser残基,是蛋白激酶C(protein kinase C,PKC)介导磷酸化的潜在靶点。TauT基因的启动子区包含p53、sp1、Wilms肿瘤 1 基因(Wilms tumor 1 gene,WT1)、渗透压反应元件(tonicity-responsive element,TonE)、核因子 - κB(nuclear factor-κB,NF-κB)、抗氧化应激反应元件(antioxidant responsive element,ARE)、热应激因子1(heat shock transcription factor 1,HSF1)和激活蛋白1(activated protein 1,AP1)的结合位点(图1)。
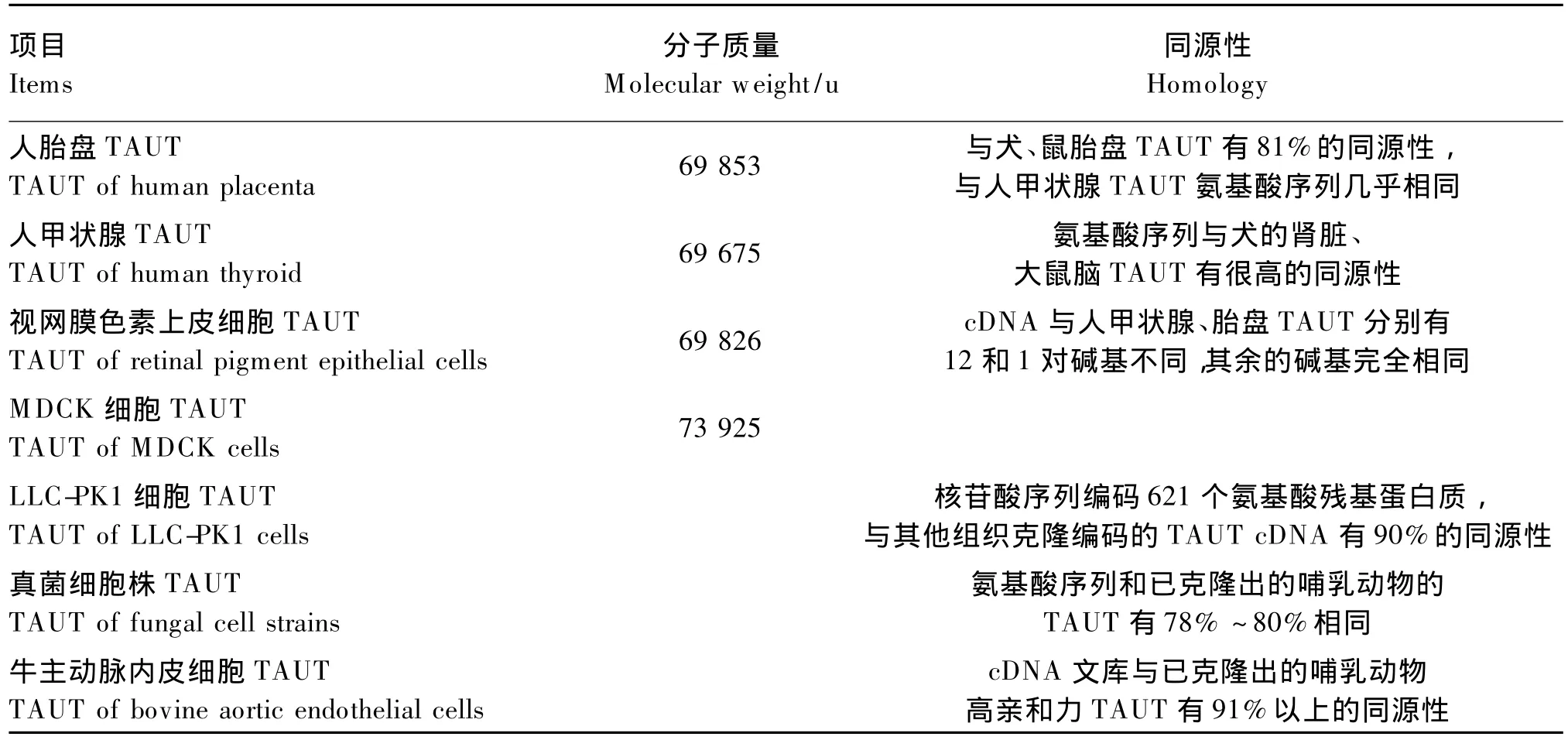
表1 不同动物和组织中TauT的分子质量和同源性Table 1 Molecular weight and homology of TauT in different animals and tissues[4-6]

图1 TauT mRNA的序列和潜在的转录因子结合位点Fig.1 Sequence and potential transcription factor binding sites of TauT mRNA[7]
2 TAUT的调节机制
TAUT的调节机制包括转录水平和转录后水平2方面。转录水平的调节主要是发生在TauT mRNA启动子区的结合位点上,转录后水平的调节主要发生在TAUT S4跨膜区的Ser-322位点上。
2.1 转录水平上的调节
根据TauT mRNA启动子区的结合位点,TauTmRNA转录水平上的调节主要分为:p53和c-Jun的调节、TonE的调节、NF-κB的调节和氧化应激元件的调节。
2.1.1 p53和c-Jun对TauT mRNA的调节机制
p53的结合位点位于TauT mRNA启动子下游的663~695区域[8]。TauT基因受p53负调节,其过程如下:p53与转录因子sp1的GC框(GC-box)DNA结合位点的SV40区域结合后,p53通过干扰sp1介导的TauT mRNA转录,竞争结合到sp1位点,从而抑制TauT mRNA的表达。同时,sp1和p53可以形成1个杂络合物,识别p53或sp1结合位点[9],进而抑制 TauT mRNA 的表达[10](图 2)。

图2 p53对TauT mRNA的调节机制Fig.2 Regulation mechanism of TauT mRNA by p53[11-12]
c-Jun氨基端激酶(c-Jun NH2-terminal kinase,JNK)是丝裂原活化蛋白(mitogen-activated protein,MAP)激酶的亚群,受细胞因子和应激环境激活。在应激状态下,MAP激酶激酶激酶(MAPkinase kinase kinase,MAPKKK)亚群中蛋白激酶激活MAP激酶激酶亚群中的丝裂原活化蛋白激酶激酶4(MAP kinase kinase 4,MKK4)和丝裂原活化蛋白激酶激酶7(MAP kinase kinase 7,MKK7),这2种蛋白激酶分别磷酸化JNK的酪氨酸(Tyr)和苏氨酸(Thr)位点[11]。JNK信号通路的主要靶点是通过磷酸化c-Jun和相关分子激活AP1 的转录因子[12]。Wagner等[13]报道,JNK 基因敲除的胚胎成纤维细胞中AP1转录水平明显下降,这与生长素反应因子(ARF)、p53和p21表达量增加有关。研究发现,c-Jun结合到肾细胞TauT mRNA启动子的AP1的2个位点(Ser-63和Ser-73)上,并且与p53共同调节TauT mRNA的表达。细胞应激通过MAPKKK亚群中的蛋白激酶激活MKK4和MKK7,然后激活JNK,JNK磷酸化并激活p53和c-Jun,下调TauT mRNA的表达;研究还发现,p53在JNK信号通路调节中占主导,提出p53和c-Jun在共同调节TauT mRNA表达过程中p53竞争性抑制c-Jun结合到TauT mRNA启动子区域(图3)。
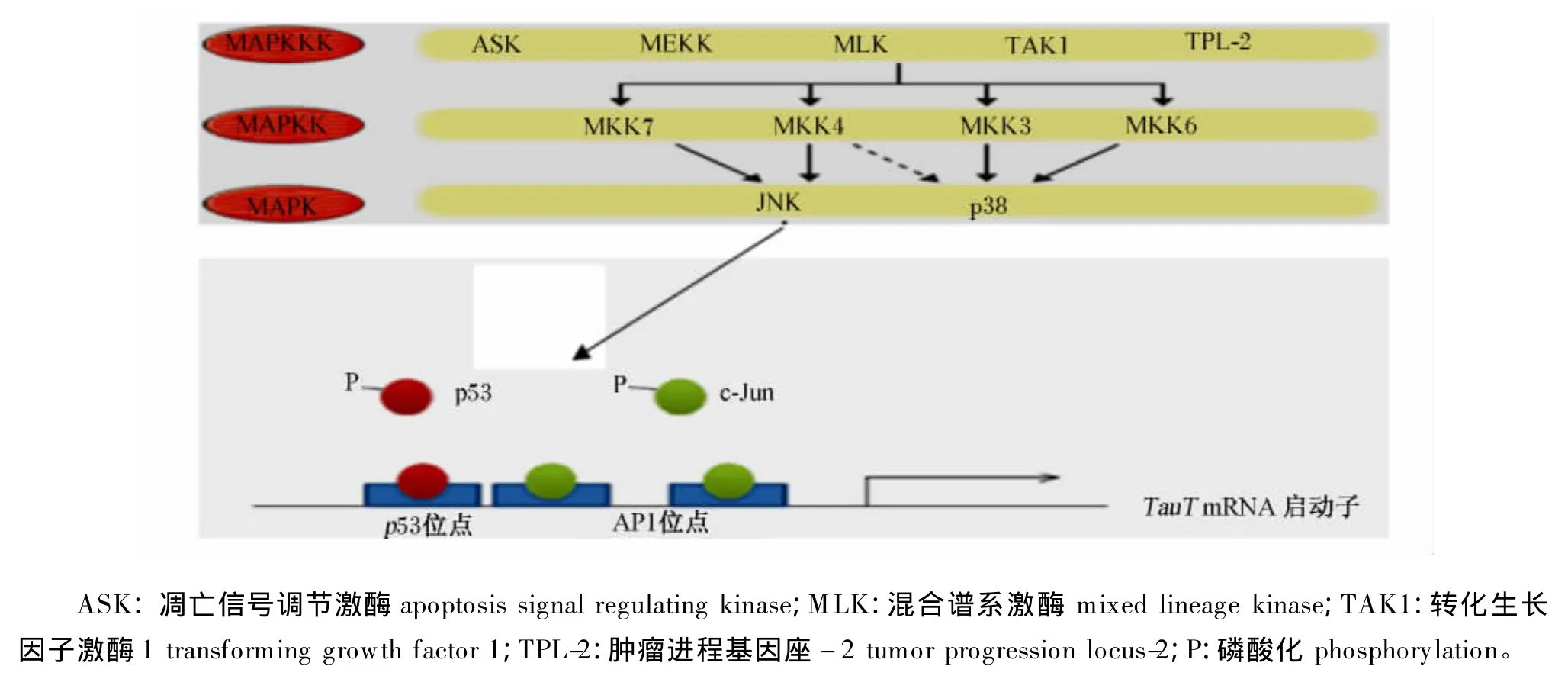
图3 c-Jun通过JNK信号转导通路调控TauT mRNAFig.3 c-Jun regulates TauT mRNA by JNK signaling pathway[14]
同样,在人类胚胎肾293细胞中发现WT1能够通过与p53的相互作用结合到位于TauT mRNA启动子169~171区域的WT1/EGR-1/SP重叠位点上,上调 TauT mRNA 的表达[15]。p53和 WT1之间的相互作用在肿瘤发生过程中起着非常重要的作用。体外免疫共沉淀和蛋白质印迹(Westernblot)分析显示,p53和WT1在初生小鼠肾细胞中发生物理性的结合,WT1主要通过延长p53的半周期增加p53的稳定性,并且抑制乳头瘤病毒E6介导的 p53降解,从而调节 TauT mRNA的表达[16]。
2.1.2 TonE对TauT mRNA的调节机制
TonE的序列位点位于TauT mRNA启动子的100~110区域,是高渗上调TauT mRNA表达的反应元件。在高渗或低渗调节下,TonE通过TonE/TonE结合蛋白(tonicity-responsive element binding protein,TonEBP)途径调节 TauT mRNA的表达。在高渗调节下培养HepG2细胞,发现诱变TonE可消除高渗对TauT mRNA启动子活性的调节,过量表达的TonEBP增加TonE的活性[17]。TonEBP作为广泛表达蛋白,能够通过Rel蛋白的氨基末端区域结合到 TonE上。TonEBP是 Rel/NF-κB/NFAT家族的转录因子,被认为是参与高渗细胞应激的转录因子。TonEBP不仅受渗透压的调节,在阿霉素(DOX)作用下TonEBP还可以通过蛋白酶途径降解。有研究发现DOX促进TonEBP的降解,从而下调TauT mRNA的表达,同时TonEBP的降解能被蛋白酶抑制剂所阻断,推测TonE可能通过蛋白酶途径影响TonEBP与TonE的结合来调节TauT mRNA的表达(图4),但是具体机制尚需进一步究。

图4 TonE对TauT mRNA可能的调节机制Fig.4 Possible regulation mechanism of TauT mRNA by TonE[18]
2.1.3 NF-κB对TauT mRNA的调节机制
Mochizuki等[19]在 Caco-2 细胞中发现 TauT mRNA的表达受肿瘤坏死因子-α(TNF-α)的调节。电泳迁移率变动分析(EMSA)法显示NF-κB能够结合到TauT mRNA启动子NF-κB相似序列上,抗肿瘤坏死因子受体1(TNFR1)抗体抑制TauT mRNA的上调,提出TNF-α通过NF-κB通路调节TauT mRNA的表达。NF-κB通路是一条抗细胞凋亡的信号通路。TNFR1是抗TNF-α受体,含有富半胱氨酸重复序列和死亡结构域(DD)。TNF-α诱导细胞凋亡信号通过含有分子适配器的DD转导,激活胱门蛋白酶。TNF-α能与TNFR1结合形成1个受体复合物而产生内化,并募集肿瘤坏死因子受体相关DD蛋白(TRADD)。受体复合物能够激活NF-κB介导激酶(NIK)和NF-κB抑制因子(I-κB)激酶(IKK)。激活 IKK磷酸化NF-κB 抑制蛋白 α(IκBα)的 Ser-32 和 Ser-36 位点,导致Lys-21和Lys-22位点蛋白化,并引发后继蛋 白 酶依赖性降 解[20]。IκBα 的 降解 导致NF-κB核移位,然后基因表达启动,上调 TauT mRNA的表达。还有一种调节机制可能是TNF-α促进活性氧(ROS)的产生,导致氧化应激激活NF-κB上调 TauT mRNA 的表达[21],具体机制尚需进一步研究。
2.1.4 氧化应激元件对TauT mRNA的调节机制
氧化应激对TauT mRNA的调节通过2条途径:一条调节途径是通过调节TauT基因的启动子区 ARE。TauT mRNA 的启动子含有 ARE[22],被促氧化剂激活,上调TauT mRNA的表达,使细胞免受损伤。ARE的调节涉及到碱性亮氨酸拉链(bZIP)蛋白质一类(基本区域含有亮氨酸拉链基因)的转录基因。bZIP转录因子NF-E2的相关因子2(Nrf2)介导ARE驱动的氧化应激,对许多受氧化应激调控基因的转录活化非常重要[23]。Nrf2能调节ARE的活性,Nrf2能被KELCH-ECH相关蛋白1(Keap1)所抑制。Keap1是Nrf2在细胞质中的富含半胱氨酸的结合蛋白,通过结合Nrf2使之无法进入细胞核,从而抑制Nrf2的活性,避免细胞对应激源的敏感性升高,例如敲除Keap1基因导致NRF2信号非常活跃。在无应激条件下,Nrf2在细胞质中通过与Keap1结合而被抑制,而当在氧化应激和过量ROS刺激时,半胱氨酸在Keap1中的残留量会增加,随后Keap1作为E3连接酶的活性变弱,Nrf2和Keap1之间的连接被打乱,导致Nrf2泛化和衰退减少,细胞质中自由的Nrf2增多,转移进细胞核的 Nrf2增多,进入细胞核的Nrf2与小Maf蛋白形成异源二聚体并且和ARE连接在一起[24]。随后,ARE被激活并且启动抗氧化基因的转录,从而使TauT mRNA表达上调。另外一条调节途径是通过激活HSF1上调TauT mRNA的转录。氧化应激产生的生理信号通过激活HSF1使HSF1结合到许多基因启动子特定序列热反应元件(HSE),如热休克蛋白(HSPs)中。热休克蛋白90(HSP90)是量最大的伴侣蛋白,能够抑制 HSF1的激活。正常状态下,HSP90与HSF1以动态复合物的形式存在。在应激状态下,外来蛋白累积并竞争HSF1结合到HSP90上,HSP90-HSF1复合物分解,未结合的HSF1多肽累积,导致HFS1三聚体的大量形成。HSF1单体寡聚成同型三聚体占领TauT mRNA启动子区域附近隐匿的顺式元件上调TauT mRNA的表达(图5)。

图5 氧化应激通过HFS1调节TauT mRNA的机制Fig.5 Mechanism of oxidant stress regulating TauT mRNA by HFS1[25-26]
2.2 转录后水平上的调节
12-肉豆蔻佛波醇酯(PKM)或13-乙酸酯激活PKC下调非洲爪蛙卵母细胞TAUT的活性。Lee等[27]发现PKC的激活影响TAUT的活性,但是对TauT mRNA的表达没有影响,从而得出PKC对TAUT的调节发生在转录后水平上。Han等[28]早期研究发现,位于TAUT S4跨膜区的Ser-45和Ser-321是PKC磷酸化的关键位点,在后续的研究中证实,PKC通过磷酸化位于TAUT S4跨膜区并包含12个带点残基的Ser-322位点降低TAUT的活性(图6)。

图6 TAUT S4跨膜区的Ser-322是PCK磷酸化关键位点Fig.6 Ser-322 is a critical site of PCK phosphorylation located in the S4intracellular segment of TAUT[29]
PKC是一个由多基因家族编码的多肽类物质,其N-末端结构域的C1区是甘油二酯(DG)或DG结构类似物佛波酯结合位点;C2区与酶对钙的敏感性有关[30]。PKC通常以无活性的形式存在于细胞中,细胞外信号分子与受体结合通过偶联蛋白活化磷脂酶C(PLC),使磷脂酰肌醇4,5-二磷酸(PIP2)分解,产生三磷酸肌醇(IP3)和DG。IP3促钙池中的Ca2+释放,使胞浆中Ca2+浓度升高,PKC被激活。石彦荣等[31]培养的钙化大鼠心肌细胞发现TAUT的活性降低,推测其机制可能是胞浆中Ca2+浓度升高,与PKC的C2区作用,从而激活PKC,降低TUAT的活性。过去曾认为磷脂酰肌醇(IP)水解是DG产生的唯一来源。但研究表明,刺激细胞表面受体可产生一系列膜磷脂的降解过程,其磷脂的降解产物可直接控制细胞反应。不饱和脂肪酸、磷脂酶D(PLD)和磷脂酶A2(PLA2)催化磷脂酰胆碱(PC)降解,以及微粒体的磷脂酸磷酸脂酶(PAP)降解磷脂酸后均可产生DG,进而激活PKC调节TAUT的活性[32]。
3 TAUT调节机制在动物营养研究中的意义
3.1 TAUT与断奶应激
断奶应激使动物机体产生严重的炎症反应和氧化应激反应,导致严重的胃肠道疾病以及腹泻。TNF-α是通过NF-κB通路诱导肠上皮细胞发生炎症反应的重要因子。Bauer等[33]研究发现断奶仔猪肠上皮细胞中NF-κB和TNF-α含量明显升高。有学者报道,TNF-α通过上调TauT mRNA表达量增加Tau的转运,从而抑制人肠道Caco-2细胞炎症反应[34]。据此推测饲料中添加 Tau可以通过TauT mRNA表达的上调抑制断奶应激所诱导的炎症反应。早期断奶后,短期采食量下降,消化吸收功能降低,有益菌减少,有害菌增加和代谢增强可能是导致机体氧化应激的主要原因。Zhu等[35]报道,21日龄断奶仔猪血清中过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)活性明显下降,MDA和H2O2水平显著升高。断奶应激产生的大量氧自由基能够激活ARE和HSF1并上调TauT mRNA的表达,从而增加Tau的转运,缓解氧化应激所诱导的机体损伤。Brandsch等[36]发现大肠杆菌耐热性肠毒素(STa)能够通过PKC下调人肠道Caco-2细胞TAUT的活性,从而使Tau的转运量明显下降,这为以后研究饲料中添加Tau能缓解断奶仔猪肠道中由STa所致的腹泻提供了重要的理论依据。
3.2 TAUT介导的营养物质代谢
高渗条件下,许多营养物质(如葡萄糖)的吸收都会受到影响[37]。TonE能通过TonE/TonEBP途径上调TauT mRNA的表达,增加Tau的转运量来调节细胞渗透压平衡,从而平衡营养物质的吸收。同样,不饱和脂肪酸和钙能够激活PKC降低TAUT的活性,显示不饱和脂肪酸和钙是Tau的营养拮抗物质,高不饱和脂肪酸和高钙饲料都会抑制 TAUT的活性,从而减少 Tau的转运量[38]。Tau属于β-氨基酸,Tau的摄入可被Tau结构类似物(亚牛磺酸、β-丙氨酸)强烈抑制,被L-丙氨酸部分抑制,因为Tau结构类似物会竞争Tau结合到TAUT转运位点上,从而抑制 Tau的转运[39]。以上研究对饲料中Tau与其他营养物质的相互作用有重要指导意义。
4 小结
综上所述,TAUT的调节发生在转录和转录后水平上。转录水平上的调节主要是对TauT mRNA启动子的调节,包括对 p53、c-Jun、WT1、TonE、NF-κB、ARE和HSF1结合位点的调节。转录后水平上的调节主要是通过PKC磷酸化对TAUT的调节,位于TAUT S4跨膜区Ser-322是PKC磷酸化关键位点。PKC受许多因素的激活,如高钙、PMA以及细胞膜表面刺激物等。虽然对TAUT已经有了大量的研究,但是还是存在很多问题,如对TAUT的研究对象大多以人、小鼠、爪蛙为主,在家畜、家禽中的研究较少,特别是TAUT调节机制在动物营养中的应用;并且有些调节机制尚不清楚,如TonE是否是通过蛋白酶途径影响TonEBP与TonE的结合来调节TauT mRNA的表达,TNF-α上调TauT mRNA的表达是否还通过促进ROS的产生,导致氧化应激激活NF-κB这条途径等,需要进一步探究。
致谢:
感谢西南大学动物科技学院孙志洪教授对文稿提出的宝贵意见。
[1]ROIG-PÉREZ S,FERRER C,RAFECAS M,et al.Correlation of taurine transport with membrane lipid composition and peroxidation in DHA-enriched Caco-2 cells[J].Journal of Membrane Biology,2009,228:141-150.
[2]ITO T,OISHIS,TAKAIM,et al.Cardiac and skeletal muscle abnormality in taurine transporter-knockout mice[J].Journal of Biomedical Science,2010,17(Suppl.1):S20.
[3]VOSS J W,PEDERSEN S F,CHRISTENSEN S T,et al.Regulation of the expression and subcellular locali-zation of the taurine transporter TauT in mouse NIH3T3 fibroblasts[J].European Journal of Biochemistry,2004,271(23/24):4646-4658.
[4]石彦荣,唐朝枢.牛磺酸转运体[J].生理科学进展,2002,33(2):145-147.
[5]HERNÁNDEZ-BENÍTEZ R,PASANTES-MORALES H,PINZÓN-ESTRADA E,et al.Functional expression and subcellular localization of the taurine transporter TauT in murine neural precursors[J].Developmental Neuroscience,2010,32:321-328.
[6]BIANCHI L,LARI R,ANICHINI R,et al.Taurine transporter gene expression in peripheral mononuclear blood cells of type 2 diabetic patients[J].Amino Acids,2012,42:2267-2274.
[7]HAN X B,CHESNEY R W.Stress-responsive gene TauT and acute kidney injury[J].Biomedical Science,2010,17(Suppl.1):S28.
[8]HAN X B,YUE J M,CHESNEY R W.Functional TauT protects against acute kidney injury[J].Journal of the American Society of Nephrology,2009,20:1323-1332.
[9]CHOI W I,JEON B N,YUN C O,et al.Proto-oncogene FBI-1 represses transcription of p21CIP1 by inhibition of transcription activation by p53 and sp1[J].The Journal of Biological Chemistry,2009,284(19):12633-12644.
[10]LIN R K,WU C Y,CHANG JW,et al.Dysregulation of p53/Sp1 control leads to DNA methyltransferase-1 overexpression in lung cancer[J].Cancer Research,2010,70:5807-5817.
[11]WESTON C R,DAVISR J.The JNK signal transduction pathway[J].Cuttent Opinion in Cell Biology,2007,19:142-149.
[12]DHANASEKARAN D N,REDDY E P.JNK signaling in apoptosis[J].Oncogene,2008,27,6245-6251.
[13]WAGNER E F,NEBREDA A R.Signal integration by JNK and p38 MAPK pathways in cancer development[J].Nature Reviews Cancer,2009,9:537-549.
[14]WESTON C R,DAVISR J.The JNK signal transduction pathway[J].Current Opinion in Genetics & Development,2002,12:14-21.
[15]HAN X B,CHESNEY R W.Regulation of taurine transporter(TauT)gene by WT1[J].FEBS Letters,2003,540:71-76.
[16]HUANG W T,HUANG C C,WENG S W,et al.Expression of the multidrug resistance protein MRP and the lung-resistance protein LRP in nasal NK/T cell lymphoma:further exploring the role of p53 and WT1 gene[J].Pathology,2009,41(2):127-132.
[17]ITO T,FUJIO Y,HIRATA M,et al.Expression of taurine transporter is regulated through the TonE(tonicity-responsive element)/TonEBP(TonE-binding protein)pathway and contributes to cytoprotection in HepG2 cells[J].Biochemical Journal,2004,382:177-182.
[18]ITO T,FUJIO Y,SCHAFFER SW,et al.Involvement of transcriptional factor TonEBP in the regulation of the taurine transporter in the cardiomyocyte[J].Advances in Experimental Medicine and Biology,2009,643:523-532.
[19]MOCHIZUKI T,SATSU H,SHIMIZU M.Signaling pathways involved in tumor necrosis factor a-induced upregulation of the taurine transporter in Caco-2 cells[J].FEBS Letters,2005,579:3069-3074.
[20]PERKINS N D.Integrating cell-signalling pathways with NF-κB and IKK function[J].Nature Reviews Molecular Cell Biology,2007,8:49-62.
[21]KITATANI K,AKIBA S,SATO T.Ceramide-induced enhancement of secretory phospholipase A2 expression via generation of reactive oxygen species in tumor necrosis factor-a-stimulated mesangial cells[J].Cellular Signalling,2004,16:967-974.
[22]NAKASHIMA E,POP-BUSUI R,TOWNS R,et al.Regulation of the human taurine transporter by oxidative stress in retinal pigment epithelial cells stably transformed to overexpress aldose reductase[J].Antioxidants & Redox Signaling,2005,7:1530-1542.
[23]YANG C H,ZHANG X J,FAN H G,et al.Curcumin upregulates transcription factor Nrf2,HO-1 expression and protects rat brains against focal ischemia[J].Brain Research,2009,1282:133-141.
[24]NGUYEN T,NIOI P,PICKETT C B.The Nrf2-antioxidant response element signaling pathway and its activation by oxidative stress[J].The Journal of Biological Chemistry,2009,284(20):13291-13295.
[25]JUNG M K,KIM K Y,LEE N Y,et al.Expression of taurine transporter(TauT)is modulated by heat shock factor 1(HSF1)in motor neurons of ALS[J].Molecular Neurobiology,2013,47:699-710.
[26]WHITESELL L,LINDQUIST S.Inhibiting the transcription factor HSF1 as an anticancer strategy[J].Expert Opinion on Therapeutic Targets,2009,13(4):469-478.
[27]LEE N Y,KANG Y S.Regulation of taurine transport at the blood-placental barrier by calcium ion,PKC activator and oxidative stress conditions[J].Journal of Biomedical Science,2010,17(Suppl.1):S37.
[28]HAN X B,BUDREAU A M,CHESNEY R W.Role of conserved peptide in taurine transporter inactivation modulated by protein kinase C[J].Journal of the A-merican Society Nephrology,1996,7(10):2088-2096.
[29]HAN X B,PATTERS A B,JONES D P,et al.The taurine transporter:mechanisms of regulation[J].Acta Physiologica,2006,187(1/2):61-73.
[30]MARTINY-BARON G,FABBRO D.Classical PKC isoforms in cancer[J].Pharmacological Research,2007,55:477-486.
[31]石彦荣,王述姮,卜定芳,等.培养的钙化大鼠心肌细胞牛磺酸转运障碍[J].中国医学科学院学报,2002,24(4):359-363.
[32]NAKAMURA H,HIRABAYASHI T,SHIMIZU M,et al.Ceramide-1-phosphate activates cytosolic phospholipase A2α directly and by PKC pathway[J].Biochemical Pharmacology,2006,71:850-857.
[33]BAUER E,METZLER-ZEBELI B U,ZEBELI M A,et al.Intestinal gene expression in pigs:effects of reduced feed intake during weaning and potential impact of dietary components[J].Nutrition Research Reviews,2011,24:155-175.
[34]ROIG-PÓREZ S,MORETÓ M,FERRER R.Transepithelial taurine transport in Caco-2 cell monolayers[J].Journal of Membrane Biology,2005,204:85-92.
[35]ZHU L H,ZHAO K L,CHEN X L,et al.Impact of weaning and an antioxidant blend on intestinal barrier function and antioxidant status in pigs[J].Journal of Animal Science,2012,90:2581-2589.
[36]BRANDSCH M,RAMAMOORTHY S,MARCZIN N,et al.Regulation of taurine transport by Escherichia coli heat-stable enterotoxin and guanylin in human intestinal cell lines[J].Journal of Clinical Investigation,1995,96:361-369.
[37]TOMI M,TERAYAMA T,ISOBE T,et al.Function and regulation of taurine transport at the inner bloodretinal barrier[J].Microvascular Research,2007,73(2):100-106.
[38]CHEEMA T A,PETTIGREW V A,FISHER SK.Receptor regulation of the volume-sensitive efflux of taurine and iodide from human SH-SY5Y neuroblastoma cells:differential requirements for Ca2+and protein kinase C[J].The Journal of Pharmacology and Experimental Therapeutics,2007,320(3):1068-1077.
[39]BATISTA T M,RIBEIRO R A,AMARAL A G,et al.Taurine supplementation restores glucose and carbachol-induced insulin secretion in islets from lowprotein diet rats:involvement of Ach-M3R,Synt 1 and SNAP-25 proteins[J].Journal of Nutritional Biochemistry,2012,23:306-312.
